短链葡聚糖-姜黄素纳米乳液的制备及结构表征
2019-01-18曾小兰OsvaldoCampanella
冯 涛,曾小兰,王 珂,Osvaldo Campanella
短链葡聚糖-姜黄素纳米乳液的制备及结构表征
冯 涛1,曾小兰1,王 珂2,Osvaldo Campanella3
(1. 上海应用技术大学香料香精技术与工程学院,上海 201418;2. 江南大学食品学院,无锡 214000; 3. 普度大学食品科学系惠斯特勒碳水化合物研究中心,西拉斐特 43845,美国)
利用短链葡聚糖(short glucan chains,SGC)的螺旋空间结构来包埋姜黄素(curcumin,CUR)。通过使用高剪切分散乳化机高速剪切溶液5 min,用纳米均质机在50 MPa压力下高压均质经剪切后的乳液2次制备成纳米乳液以提高其包埋率和载药量。XRD (x-ray diffraction)和TGA (thermogravimetric analysis)很好的验证了包合物的形成,通过TGA、SEM (scanning electron microscopy)、激光粒径分析仪等各种表征分析得出短链葡聚糖-姜黄素纳米乳液制备成功,所制得的乳液对姜黄素的包埋率和载药量都高于短链葡聚糖-姜黄素包合物,分别达到了71.11%和12.07%,说明制备成纳米乳液对姜黄素的包埋率和载药量都有了明显的提高。所制备的纳米乳液的粒径小于300 nm,粒径分布均一,Zeta电位观测表明所制得的乳液的稳定性有所提高。为提高食品及医药领域姜黄素的生物利用率提供了一定的参考意义。
乳液;纳米包合材料;微观结构;蜡质玉米淀粉;短链葡聚糖;普鲁兰酶;姜黄素;纳米乳液
0 引 言
姜黄素 [(E,E)-1,7-双(4-羟基-3-甲氧基 - 苯基)庚二烯-3,5-离子]是从姜黄中提取的主要酚类色素[1]。它通常用作香料,食品防腐剂,调味剂和着色剂。过去50 a的广泛研究表明,姜黄素具有强力的抗氧化剂[2-3],抗炎[4-5],抗肿瘤[6],抗HIV[7],抗菌和抗微生物特性[8-9]。还抑制脂质过氧化和清除超氧阴离子氧、一氧化氮和羟基[10-11],新研究证明其对治疗呼吸系统疾病有很大的贡献。然而由于姜黄素的生物利用率很低,水溶性差,稳定性也很低,因此其在食品工业和医药邻域的广泛应用受到了极大的限制,从而影响了这种重要化合物对人类的健康益处的发挥[12-14],这使得解决上面这些问题成为了一个热门的话题。有研究表明,包埋具有生物活性的物质可以提高生物分子在人体胃肠道中的利用率,包埋可以提高生物活性物质的水溶性,保护他们免遭人体胃肠道中某部位的不良条件影响,并在人体中靶向吸收以提高吸收率。
淀粉是人们食物的主要来源,主要储存在植物的根茎当中,是目前食品工业中用量最大的原料,直径大小在1~100m范围内[15]。淀粉是由直链淀粉和支链淀粉组成的聚合物,不同来源的淀粉其直链和支链的组成比有很大的差别,其具有安全、无毒、价廉,良好的生物相容性,可降解等优点。同时单一酶和复合酶作用淀粉时对生成的短链葡聚糖颗粒表面体积大小会有一定的影响[16]。短链葡聚糖是1种低分子量的亲水性线性聚合物,其聚合度约为17,是由支链淀粉通过酶解(普鲁兰酶)脱支制备而得[17]。支链淀粉经酶解脱支,形成具有一定聚合度的线性直链淀粉短链,线性短链通过两两碰撞、缠绕并形成双螺旋分子,使支链淀粉的消化性降低,改善了天然淀粉作为壁材输送生物活性物质易被人体胃肠道中酸和酶侵蚀的缺点。以短的直链淀粉为宿主的包合体系正受到越来越多的关注。Fanta等[18]通过蒸汽喷射糊化法制备了纳米级的直链淀粉-油酸包合物。Marinopoulou等[19]利用碱消化法制备了直链淀粉与癸酸、肉豆蔻酸和油酸的包合物。Le Bail等[20]以高压法制备了稳定的直链淀粉-癸酸以及香荆芥酚的包合物。Zhu等[21]以化学或酶法变性的高直链玉米淀粉成功制备了与-萘酚的包合物。Ades等[22]采用直链淀粉包合了薄荷酮,薄荷醇。
但目前所制得短链葡聚糖-姜黄素包合物还存在一些缺点,例如包合物粒径是微米级、包埋率和载药量都很低、溶解度不是很好等。为了解决利用廉价安全的短直链淀粉作为壁材包埋姜黄素时少量存在的问题,该文在制备了短链葡聚糖-姜黄素包合物后将其制备成纳米乳液,试验发现后者可以很好的提高包合物的稳定性、包埋率和载药量。姜黄素被制备成纳米颗粒后,其游离基氧化稳定性较游离态姜黄素得到显著提高[23]。纳米粒子的粒径通过影响被包埋的分子在胃肠道中的保留时间、溶解速率和消化酶的行为来影响被包埋分子的生物利用率[24]。短链葡聚糖-姜黄素纳米乳液的粒径在150~300 nm,被包埋的姜黄素延长了消化时间,得以靶向释放,生物价值得以利用。以OSA(octenyl succinic anhydride)变性淀粉为乳化剂,对脂溶性功能成分中易挥发和不易溶解的营养素类物质构建稳定、高效、生物兼容性强的水包油(O/W)型纳米乳液[25]。杨宝玲等[26]通过玉米淀粉和辛烯基琥珀酸发生淀粉酯化反应成功地包埋了亚麻油并制备成微胶囊。本试验将制备好的短链葡聚糖-姜黄素包合物采用剪切分散乳化的方法制备成纳米乳液,表征包合物的成功制备,观察其动力学乳液稳定性,以提高其包埋率和载药量。
1 材料与方法
1.1 试验材料
蜡质玉米淀粉(国民淀粉),普鲁兰酶(1 000 U/g,诺维信),姜黄素(≥94%姜黄色素含量,≥80%姜黄素含量,Sigma),姜黄素标准品(Sigma,色谱纯),吐温80(国药试剂有限公司,分析纯),卵磷脂(来自鸡蛋)(梯希爱化成工业发展有限公司,分析纯),一水合柠檬酸,磷酸氢二钠,无水乙醇(国药(上海)试剂有限公司,分析纯)。
1.2 仪器设备
热重分析仪(TGA,thermogravimetric analysis,Q5000 IR,美国TA仪器公司)、扫描式电子显微镜(日本高新那珂事业所)、激光粒度分布仪(Zetasizer Nano ZS,马尔文仪器(中国)有限公司)、Nano Homogenize Machine(美国ATS Engineering 有限公司)、PC型紫外可见分光光度计(UNICO公司)、Hishear 高剪切分散乳化机(上海跃迪机械设备有限公司)。
1.3 方 法
1.3.1 短链葡聚糖的制备[27]
将称量好的蜡质玉米淀粉中分别加入200 mL缓冲液(pH值为5.0的磷酸氢钠一水合柠檬酸缓冲液),配制成质量浓度为10%、15%、20%、25%的淀粉溶液。先搅拌均匀,然后在沸水浴中继续加热搅拌30~40 min直到淀粉溶液充分糊化以后温度降至58 ℃,加入普鲁兰酶(1 000 U/g),保温8 h并不断搅拌,之后快速离心(10 000 r/min, 2 min),取上清液并在100℃下加热30 min,消除普鲁兰酶的活性,4℃冰箱里储存6~8 h之后冷冻干燥72 h,即得短链葡聚糖。短链葡聚糖分别依次记为SGC1,SGC2,SGC3,SGC4。
1.3.2 短链葡聚糖-姜黄素纳米乳液的制备
按照表1中配方制备葡聚糖-姜黄素纳米乳液,共6个处理。具体制备过程如下:1)15%(SGC2)的短链葡聚糖结晶度最高,且热稳定性最好,故选其作为包埋姜黄素的壁材,并按照5 mg/mL的浓度配置成100 mL的溶液,按表1配方的量加入吐温80,超声15 min使短链葡聚糖充分均匀分散到体系中,90~100 ℃加热30~40 min直至溶液彻底糊化均匀。2)按表1配方称取姜黄素于2 mL无水乙醇(助溶)中,加入卵磷脂并将配置好的姜黄素溶液缓慢滴加入上步制备的短链葡聚糖溶液中,后25 ℃加热搅拌2 h,后初去乙醇,再用Hishear 高剪切分散乳化(D档,5 min)。纳米均质机在50 MPa压力下高压均质经剪切2次后的乳液即得短链葡聚糖-姜黄素纳米乳液。短链葡聚糖-姜黄素包合物的制备同上,少去乳化剂的加入和均质剪切。

表1 空白对照及短链葡聚糖-姜黄素纳米乳液配方
1.3.3 短链葡聚糖-姜黄素及其纳米乳液包埋率和载药量的测定
本文选用紫外分光光度法测定短链葡聚糖-姜黄素包合物及其纳米乳液的包埋率和载药量,测定方法如下:1)绘制姜黄素标准曲线:取姜黄素标准品用无水乙醇配置浓度为0.598 mg/mL的溶液,并用250 mL的容量瓶定容。然后量取比色皿2/3体积的量进行检测并找到姜黄素的最大吸收波长。接着从母液中分别移取5.000、2.500、1.250、1.000、0.625、0.500 mL的姜黄素溶液置于100 mL容量瓶中,用无水乙醇定容,得到浓度分别为29.90、14.95、7.48、5.98、3.74、2.99g/mL梯度稀释的标样溶液,分光光度计测定被稀释溶液的吸光度值,得出的一列数据建立标准曲线。2)游离姜黄素的测定:取一定量的短链葡聚糖-姜黄素包合物,用无水乙醇配置成浓度为0.2 mg/mL的包合物溶液,超声振荡萃取2 min,静置后取上清液,并测定其在最大吸收波长处的吸光度,代入标准曲线计算对应姜黄素的质量浓度。3)姜黄素总量的测定:同样的方法配置质量浓度为0.2 mg/mL的溶液,用高速离心(10 000 r/min,20 min)使其结构完全破坏,姜黄素游离出来,同样离心后取上清液测姜黄素最大吸收波长处的吸光度,根据标准曲线计算对应姜黄素浓度。
包埋率=(1-样品中游离姜黄素的质量/样品中姜黄素总质量)×100% (1)
载药量=(样品中姜黄素的总质量/样品中短链葡聚糖的总质量)×100% (2)
1.3.4 短链葡聚糖-姜黄素纳米乳液包合物的表征
1)短链葡聚糖-姜黄素纳米乳液包合物的外观
姜黄素作为食品工业和医药邻域广泛需要的原料,其包合物溶解度的稳定性也至关重要,因此本试验采用静置的方式,每隔一天对样品观察一次,观察样品的溶解度变化及是否有分层和沉淀现象发生。
2)短链葡聚糖-姜黄素纳米乳液动态光散射(dynamic light scattering)
粒径分布、PDI(particle distribution index)和Zeta电位通过Zetasizer Nano ZS型激光粒度分布仪测定的。测定前,先将样品配置成均匀分散的体系,所有样品需过0.45m的微孔滤膜,以便除去掉大颗粒的聚集体。将样品溶液于室温条件下分别放置1和7 d测定纳米乳液的Zeta电位。测定时粒径池和电位池装样量约为该容器体积的1/3,样品设置测定3次取其平均值。
3)短链葡聚糖-姜黄素包合物的X射线衍射(X-ray diffraction)
短链葡聚糖-姜黄素包合物、短链葡聚糖-姜黄素混合物和姜黄素的结晶度和晶型通过X-射线衍射仪测定。XRD测试仪器的电压为30 kV,电流为30 mA, 扫描角度范围为5°~50°,扫描速度为4(°)/min,间隔时间为0.4 s,间隔宽度为0.02°,发散狭缝宽度为0.2 mm,衍射狭缝宽度为0.6 mm,接收狭缝宽度为0.2 mm,测试时讲冷冻干燥好的样品取1~2 mg置于样品台上进行观测。
4)纳米乳液扫描电子显微镜观察(scanning electron microscopy,SEM)
短链葡聚糖-姜黄素纳米乳液的微观形貌采用扫描电子显微镜观察。 取0.1 mg样品至于10 mL超纯水中分散,超声处理10 min,取1滴样品于导电胶上并固定到样品台上,后将样品进行喷金处理,然后在电流3 mA,加速电压15 kV条件下观察微观形貌。
5)纳米乳液热重分析(thermogravimetric analysis,DSC)
测定短链葡聚糖-姜黄素纳米乳液的高温质量损失情况来分析卵磷脂添加量对纳米乳液包埋效果的影响。样品盘装样之前最好酒精灼烧5 s以除去盘中的杂质,称取3~5 mg的样品于坩埚中,置于热重分析仪系统。设置氮气流量20 mL/min,升温速率为10 ℃/min,样品在30~600 ℃范围内进行热重分析。
6)统计分析方法
试验数据均以平均值±标准差形式表示,采用SPSS 18.0统计软件对数据进行单因素方差分析(ANOVA),显著性水平<0.05。
2 结果与讨论
2.1 短链葡聚糖-姜黄素纳米乳液的溶解度和稳定性直观观测
图1为样品初始和第7天的分散情况。姜黄素水溶液本身溶解性差(图1中A),配置好的溶液中大部分姜黄素沉淀于瓶底,还有一部分悬浮于水溶液中。Aditya等[28]报导的结果与图1所显示的结果类似,天然姜黄素的溶解度极低,为0.39±0.05g/mL。空白对照2(图中C)中姜黄素均匀的溶解在水溶液中,这说明乳化剂吐温80和卵磷脂对姜黄素起到了很好的乳化效果,并提高了姜黄素的溶解性。其中4在制备过程中未加乳化剂,这说明姜黄素溶解度的提高不只是由与吐温80和卵磷脂的乳化作用而引起,短链葡聚糖对姜黄素的包埋也提高了姜黄素的溶解度。这可能是由于蜡质玉米淀粉制备成短链葡聚糖产生的氢键与姜黄素形成了一定的相互作用,阻止了姜黄素结晶的生长,使其保持在无定型状态,从而提高其水溶性,这与Gomand等[29]淀粉制备成纳米颗粒形成大量的氢键研究一致,纳米乳液D(吐温/卵磷脂=300/100)、E(吐温/卵磷脂=300/200)、F(吐温/卵磷脂=300/300)、G(无吐温和卵磷脂),从图7可以看出,F始终都没有形成沉淀,这是由于随着卵磷脂浓度的增加,额外的水/油界面的形成。

注:A(姜黄素水溶液),B(空白对照1,短链葡聚糖/乳化剂),C(空白对照2,姜黄素/乳化剂),D:1(配方1),E:2(配方2),F:3(配方3),G:4(配方4)。
2.2 短链葡聚糖-姜黄素及其纳米乳液的粒径、粒径分布指数(PDI)、Zeta电位、包埋率、载药量测定
2.2.1 短链葡聚糖-姜黄素包合物的粒径、粒径分布指数(PDI)、包埋率、载药量测定
从表2[30]可以看出,利用普鲁兰酶水解得到的单一短链葡聚糖包埋率和载药量都不高,分别是28.46%和1.27%。为了改进短链葡聚糖-姜黄素包合物包埋率和载药量偏低的问题,从而提高姜黄素的生物利用价值,后面进一步研究了将短链葡聚糖-姜黄素包合物制备成纳米乳液。

表2 短链葡聚糖-姜黄素包合物物化参数
注:同一列不同字母表示显著性差异,<0.05,下同。
Note: Different letters in the same column indicate significant differences,<0.05, the same below.
2.2.2 短链葡聚糖-姜黄素纳米乳液的粒径、粒径分布指数(PDI)、Zeta电位、包埋率、载药量测定
姜黄素水溶液的粒径目前有很多人做过研究,可关于短链葡聚糖-姜黄素纳米乳液粒径分布和电位与姜黄素稳定性的关系的研究还比较少,如表3所示。上面测得包合物的颗粒大小为2到20m。而后制备成纳米乳液之后的粒径分布在150~300 nm,主要集中在200 nm左右,与试验得出的SEM图结果相符。Zeta电位代表纳米乳液的体外稳定性。Marsh等[31]发现淀粉由于含有脂类、蛋白及金属离子等,从而导致淀粉纳米乳液有Zeta电位的存在。他与表面可电离基团的种类、数量直接相关。从表3可知,所有样品的Zeta电位均小于20 mV,表明乳液的稳定性偏低,这与2.1部分的乳液第7天稳定性直观观测的结果一致。从表3中空白的短链葡聚糖乳液Zeta电位为负,这是因为超声处理使淀粉羟基基团在水溶液中更倾向于电离[32]。表3纳米乳液样品1、2、3的Zeta电位值随加入卵磷脂的量的增加而变大,表明卵磷脂可以提高所制备乳液的稳定性,粒径由238.33降低到170.87 nm,这可能是由于随着乳化剂量的增多,额外的水/油界面形成,支持了更小液滴的形成[33],这与2.1直观观测的结果一致。PDI值越小,粒径分布越均一,则形成的乳液越稳定。从表3中可以看出,放置7 d后,样品Blank 1、1、2、4的PDI值均大于0.3,说明所得乳液粒径分布不均一,样品Blank 2、3的PDI值小于0.3,说明所得乳液粒径分布均一。综合表2表3可以看出制备成纳米乳液之后姜黄素的溶解性有了很好的改善,包埋率和载药量都有很大的提高,且包埋率和载药量在一周的时间基本上没有变化,包埋效果稳定。

表3 短链葡聚糖-姜黄素包合物纳米乳液物化参数
2.3 短链葡聚糖-姜黄素包合物的XRD分析
短链葡聚糖-姜黄素包合物的结晶特性和物理状态通过X射线衍射来表征。由图2可知,短链葡聚糖SC2样品分别在14.0°,16.8°,19.42°,22.0°,23.9°处出现衍射峰,可以判断晶型为B+V型。图2b姜黄素的衍射峰较尖锐,说明姜黄素的结晶性很好,短链葡聚糖姜黄素混合物的衍射峰基本上为短链葡聚糖和姜黄素的衍射峰叠加。短链葡聚糖-姜黄素包合物4个样品基本都在14.10°,16.93°,21.93°附近出现衍射峰,其中14.10°是V型结晶结构衍射峰,16.93°,21.93°是B型结晶结构衍射峰。这说明包合物的晶型结构为B+V型。从图中可以看出,包合物与短链葡聚糖的衍射峰出峰位置相同且没有表现出明显的姜黄素晶体的衍射峰,说明短链葡聚糖-姜黄素包合物的成功形成且姜黄素被包埋后呈无定形状态。为后续制备成纳米乳液的包合物提供基础。
2.4 扫描电子显微镜观察
短链葡聚糖-姜黄素纳米乳液和空白的SEM如图3所示。样品Blank 1, 1, 2, 3没有独立的球形存在,而样品4倾向于形成均匀且大小均一的球形或者椭圆。可能是由于淀粉被酶解之后生成的短链葡聚糖,颗粒变小,表面有被腐蚀的痕迹,大多呈现出不规则的形状,表面粗糙,部分有裂纹但整体保持叫完成的形态,颗粒之间部分粘连,而且乳化剂的双重作用使得颗粒大小均一。Kim等[34]也发现了淀粉纳米颗粒聚集的现象,这也与Sihem等[35]研究淀粉纳米颗粒表观形态互相聚集的结果相似。另外,由于酶解而生成了短链葡聚糖,使得淀粉结晶区域容易形成大量氢键,而导致淀粉纳米颗粒的互相吸引,这与Gomand等[29]研究的淀粉纳米颗粒通过氢键相互吸引的结果类似。
2.5 热重分析 (TGA,thermogravimetric analysis)
短链葡聚糖纳米乳液及空白对照的TGA和DTG如图所示。由图4所见,Blank 1为添加乳化剂最多的,其质量曲线缓慢下降,在20~104℃范围内,出现1个失质量峰,失质量率仅为1.15%,该阶段主要是样品中水分的损失或小分子量碳氢化合物分解[36]。分析样品热重曲线得出,在200~358℃范围内,Blank 1曲线位于样品1、2、3的下方,该阶段主要是由于壁材短链葡聚糖的热分解速率大于包合物。根据图4中DTG曲线可知,短链葡聚糖最大失质量速率对应温度约为302 ℃,这与苑春苗等[37]用TGA测定的玉米淀粉的最大失质量速率对应的温度是一致的,包合物样品1、2、3可能是由于短链葡聚糖与姜黄素分子间形成了氢键而减缓了短链葡聚糖的分解速度。这与上面SEM中淀粉纳米颗粒聚集通过氢键互相吸引结果一致。从DTG曲线可以看出,从366 ℃起样品Blank 1、1、2、3及Blank 1又出现了1个失质量峰,最大失质量速率对应的温度约为405 ℃,而样品4未出现此峰。其中样品1、2、3与4的物质成分区别是1、2、3在制备过程中加入了乳化剂吐温80和卵磷脂,而4在制备过程中卵磷脂和吐温80的加入量都为0,这说明了此失质量峰可能是乳化剂的失质量峰。在358~600 ℃,样品1、2、3的曲线位于Blank 1的下方,可能因为壁材短链葡聚糖分解后,被包埋的姜黄素受热分解。

图2 不同配方样品的X射线衍射图谱

图3 不同配方样品的扫描电子显微镜图片
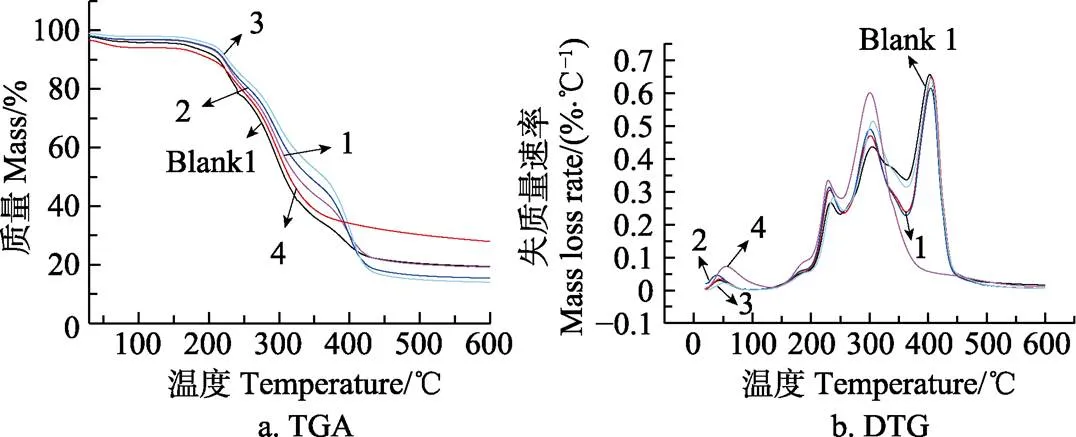
图4 不同配方样品的TGA(thermogravimetric analysis)和 DTG(derive temperature gravimetric)曲线
3 结 论
本试验利用Hishear高压乳化剪切的方法将短链葡聚糖-姜黄素包合物制备成纳米乳液,比短链葡聚糖螺旋空腔结构直接包埋姜黄素后得到包埋物的稳定性增加很多,而且很大程度的提高了姜黄素的包埋率和载药量,使其分别从28.46%、1.27%最高达到了71.11%、12.07%。对于短链葡聚糖-姜黄素纳米乳液,通过热重分析、粒径(150~300 nm)、粒径分布指数(PDI< 0.3)、Zeta电位(< 20 mV,稳定性好),得出短链葡聚糖-姜黄素纳米乳液成功制备,而且稳定性很好,粒径分布均一,粒径小于300 nm。同时结合直观图还发现溶液趋向于澄清的状态,说明姜黄素的溶解性也在很大程度上提高了,为医学领域寻找包埋姜黄素的壁材提供了1个合适的途径,也为食品领域更好的发挥和利用姜黄素的使用价值提供参考,其动力学稳定性将是接下来需要深入的研究。
[1] Mitchell M S. Isolation of curcumin from turmeric[J]. Journal of Chemical Education, 2000, 77(3): 359-360.
[2] Pizzo P, Scapin C, Vitadello M, et al. Grp94 acts as a mediator of curcumin-induced antioxidant defence in myogenic cells[J]. Journal of Cellular & Molecular Medicine, 2010, 14(4): 970-981.
[3] Sugiyama Y, Kawakishi S, Osawa T. Involvement of the beta-diketone moiety in the antioxidative mechanism of tetrahydrocurcumin[J]. Biochemical Pharmacology, 1996, 52(4): 519-544.
[4] Srimal R C, Dhawan B N. Pharmacology of diferuloyl methane (curcumin), a non-steroidal anti-inflammatory agent[J]. Journal of Pharmacy & Pharmacology, 2011, 25(6): 447-452.
[5] Aggarwal B B, Harikumar K B. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases[J]. International Journal of Biochemistry & Cell Biology, 2009, 41(1): 40-59.
[6] Lee Y K, Lee W S, Hwang J T, et al. Curcumin exerts antidifferentiation effect through AMPKalpha-PPAR-gamma in 3T3-L1 adipocytes and antiproliferatory effect through AMPKalpha-COX-2 in cancer cells[J]. Journal of Agriculture and Food Chemistry, 2009, 57(1): 305-315.
[7] Jordan W C, Drew C R. Curcumin:A natural herb with anti-HIV activity[J]. Journal of the National Medical Association, 1996, 88(6): 333.
[8] De R, Kundu P, Swarnakar S, et al. Antimicrobial activity of curcumin against helicobacter pylori isolates from India and during infections in mice[J]. Antimicrobial Agents & Chemotherapy, 2009, 53(4): 1592-1599.
[9] Wang Y, Lu Z, Wu H, et al. Study on the antibiotic activity of microcapsule curcumin against foodborne pathogens[J]. International Journal of Food Microbiology, 2009, 136(1): 71-74.
[10] Jovanovic S V, Boone Charles W, Steenken, et al. How curcumin works preferentially with water soluble antioxidants [J]. Journal of the American Chemical Society, 2001, 123(13): 3064-3072.
[11] Chignell C F, Bilskj P, Reszka K J, et al. Spectral and photochemical properties of curcumin[J]. Photochemistry & Photobiology, 1994, 59(3): 295-302.
[12] Yang C,Su X , Liu A , et al. Advances in clinical study of curcumin[J]. Current Pharmaceutical Design, 2013, 19(11): 1966-1973.
[13] Aggarwal B B, Sung B. Pharmacological basis for the role of curcumin in chronic diseases: An age-old spice with modern targets[J]. Trends in Pharmacological Sciences, 2009, 30(2): 85-94.
[14] Anand P, Kunnumakkara A B, Newman R A, et al. Bioavailability of curcumin: Problems and promises[J]. Molecular Pharmaceutics, 2007, 4(6): 807-818.
[15] Freitas R A, Paula R C, Jpa F, et al. Amylose contents, rheological properties and gelatinization kinetics of yam () and cassava () starches[J]. Carbohydrate Polymers, 2004, 55(1): 3-8.
[16] 方晨璐,黄峻榕,任瑞珍,等. 酶解薯类淀粉适用于电镜观察其颗粒表面及内部结构[J]. 农业工程学报,2018,34(22): 306-312. Fang Chenlu, Huang Junrong, Ren Ruizhen, et al. Amylases enzymolysis of tuber starch granules for surface and internal structure observation under scanning electron microscopy[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 306-312. (in Chinese with English abstract)
[17] Chang R, Yang J, Ge S, et al. Synthesis and self-assembly of octenyl succinic anhydride modified short glucan chains based amphiphilic biopolymer: Micelles, ultrasmall micelles, vesicles, and lutein encapsulation/release[J]. Food Hydrocolloids, 2017, 67: 14-26.
[18] Fanta G F, Kenar J A, Felker F C. Nanoparticle formation from amylose-fatty acid inclusion complexes prepared by steam jet cooking[J]. Industrial Crops and Products, 2015, 74: 36-44.
[19] Marinopoulou A, Kalogianni E P, Raphaelides S N. Amylose-fatty acid inclusion complexes as examined by interfacial tension measurements[J]. Colloids Surf B Biointerfaces, 2016, 137: 133-137.
[20] Le Bail P, Chauvet B, Simonin H, et al. Formation and stability of amylose ligand complexes formed by high pressure treatment[J]. Innovative Food Science & Emerging Technologies, 2013, 18: 1-6.
[21] Zhu F, Wang Y J. Characterization of modified high-amylose maize starch-α-naphthol complexes and their influence on rheological properties of wheat starch[J]. Food Chemistry, 2013, 138(1): 256-262.
[22] Ades H, Kesselman E, Ungar Y, et al. Complexation with starch for encapsulation and controlled release of menthone and menthol[J]. LWT - Food Science and Technology, 2012, 45(2): 277-288.
[23] 王永辉,杨晓泉,王金梅,等. 蛋白水解物及多糖负载姜黄素制备纳米颗粒及其稳定性[J]. 农业工程学报,2015,31(10):296-302. Wang Yonghui, Yang Xiaoquan, Wang Jinmei, et al. Preparation of curcumin nanoparticles by protein hydrolysates and polysaccharids and its stabilization[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(10): 296-302. (in Chinese with English abstract)
[24] Yu H, Huang Q. Investigation of the absorption mechanism of solubilized curcumin using Caco-2 cell monolayers[J]. Journal of Agricultural & Food Chemistry, 2011, 59(17): 9120-9126.
[25] Yu H, Huang Q. Improving the oral bioavailability of curcumin using novel organogel-based nanoemulsions[J]. Journal of Agricultural & Food Chemistry, 2012, 60(21): 5373-5382.
[26] 杨宝玲,陈烨. 玉米淀粉-辛烯基琥珀酸淀粉酯制备亚麻油微胶囊[J]. 农业工程学报,2010,26(7): 364-368.Yang Baoling, Chen Ye. Preparation of linseed oil microcapsules by starch octenyl succinate-maize starch[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010,26(7): 364-368. (in Chinese with English abstract)
[27] Sun Q, Li G, Dai L, et al. Green preparation and characterisation of waxy maize starch nanoparticles through enzymolysis and recrystallisation[J]. Food Chemistry, 2014, 162(11): 223-228.
[28] Aditya N P, Yang H, Kim S, et al. Fabrication of amorphous curcumin nanosuspensions using-lactoglobulin to enhance solubility, stability, and bioavailability[J]. Colloids & Surfaces B Biointerfaces, 2015, 127: 114-121.
[29] Gomand S V, Lamberts L, Grommes C J, et al. Molecular and morphological aspects of annealing-induced stabilization of starch crystallites[J]. Biomacromolecules, 2012, 13(5): 1361-1370.
[30] 冯涛,曾小兰,张钰,等. 短链葡聚糖包合姜黄素的分子机制[J]. 现代食品科技,2018, 34(10):111-116. Feng Tao, Zeng Xiaolan, Zhang Yu, et al. Green preparation of short glucan chain and its inclusion behavior of molecular dynamics simulation behavior with curcumin[J]. Modern Food Science and Technology, 2018, 34(10): 111-116. (in Chinese with English abstract)
[31] Marsh M R A, Waight M S G. The Effect of pH on the Zeta Potential of Wheat and Potato Starch[J]. Starch‐Stärke, 1982, 34(5): 149-152.
[32] Liu D, Wu Q, Chen H, et al. Transitional properties of starch colloid with particle size reduction from micro- to nanometer [J]. Journal of Colloid & Interface Science, 2009, 339(1): 117.
[33] Heiati H, Phillips N C, Tawashi R. Evidence for Phospholipid Bilayer Formation in Solid Lipid Nanoparticles Formulated with Phospholipid and Triglyceride[J]. Pharmaceutical Research, 1996, 13(9): 1406-1410.
[34] Kim H Y, Han J A, Kweon D K, et al. Effect of ultrasonic treatments on nanoparticle preparation of acid-hydrolyzed waxymaize starch[J]. Carbohydrate Polymers, 2013, 93(2): 582-588.
[35] Sihem Bel Haaj, Magnin Albert. Starch nanoparticles formation via high power ultrasonication[J]. Carbohydrate Polymers, 2013, 92(2): 1625.
[36] Mansaray K G, Ghaly A E. Determination of kinetic parameters of rice husks in oxygen using thermogravimetric analysis[J]. Biomass & Bioenergy, 1999, 17(1): 19-31.
[37] 苑春苗, 李畅,李刚,等. 氮气气氛下玉米淀粉热分解动力学参数[J]. 东北大学学报: 自然科学版, 2012, 33(4): 584-587. Yuan Chunmiao, Li Chang, Li Gang, et al. Kinetic parameters of thermal decomposition of corn starch under nitrogen atmosphere[J]. Journal of Northeastern University: Natural Science Edition, 2012, 33(4): 584-587. (in Chinese with English abstract)
Preparation and structure characterization of short glucan chain-curcumin nano-emulsion
Feng Tao1, Zeng Xiaolan1, Wang Ke2, Osvaldo Campanella3
(1.201418,; 2.214000; 3.43845)
In order to solve the problem of curcumin’s low biological value in food and drug, the helical space structure of the short glucan chains with a short DP (degree of polymerization) was induced to embed the water insolubility curcumin and to enhance its biological value. This article introduced a way how to make short glucan chains and use short glucan chains to encapsulate with curcumin to make inclusion complexes and nano-emulsions. Short glucan chains were obtained by pullanase’s enzymatic hydrolysis, which came out successfully by the verification of XRD (X-ray diffraction) results. The inclusion complexes were made by mixing, but its poor encapsulation efficiency and loading content were about 28.46% and 1.27%, separately. Short glucan chain-curcumin nano-emulsions were produced by emulsification and shearing to improve the embedding rate and drug loading, using the Hi-shear dispersing emulsifier with D-speed shearing solution for 5 min to get SGC-CUR nano-emulsion, and the nano-homogenizer was used to homogenize the sheared emulsion twice under a pressure of 50 MPa to prepare the emulsion. High embedding rate and drug loading were produced by making curcumin-short glucan chain into nano-emulsions, and we got a good result of embedding rate and drug loading: 71.11% and 12.07%, respectively. Popular methods as SEM (scanning electron microscopy), TGA (thermogravimetric analysis), Zeta etc. were measured to analysis stability, water solubility and structure characterization. Curcumin’s solubility was not only increased by adding emulsifier but also by interaction behaviors between short glucan chains and curcumin, which stop crystal’s growing and kept amorphous state to enhance its solubility. From SEM we knew that the short glucan chain-curcumin had rough surface because of the enzymatic hydrolysis, partially cracked and stuck together, this phenomenon was almost the same with former studies that starch nanoparticles were adhered. As for nano-emulsions’ Zeta potential were below 20 mV which means it has a low stability and has a room to improve, this result was same with the picture showed at the 7thday that the emulsion slowly began to stratify. The nano-emulsion particle size changed from 238.33 to 170.87 nm when fewer emulsifier were added, probably because of more water/oil interface had produced, which supported the formation of smaller droplets. The PDI (particle size distribution index) of nano-emulsions was all less than 0.3, which means the particle size distribution followed a uniform distribution pattern. The process greatly improved the solubility of curcumin, increased the stability of curcumin, and provided a suitable way for the medical field to find better embedding of curcumin wall materials.
emulsions; nanocomposites; microstructure; waxy corn starch; short chain glucan; pullulanase; curcumin; nano-emulsions
2018-07-25
2018-12-03
上海市曙光项目计划(2015SG1)
冯 涛,教授,工学博士,主要从事变性淀粉的相关研究。 Email:fengtao@sit.edu.cn
10.11975/j.issn.1002-6819.2019.01.037
TS231
A
1002-6819(2019)-01-0303-07
冯 涛,曾小兰,王 珂,Osvaldo Campanella. 短链葡聚糖-姜黄素纳米乳液的制备及结构表征[J]. 农业工程学报,2019,35(1):303-309. doi:10.11975/j.issn.1002-6819.2019.01.037 http://www.tcsae.org
Feng Tao, Zeng Xiaolan, Wang Ke, Osvaldo Campanella. Preparation and structure characterization of short glucan chain-curcumin nano-emulsion[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(1): 303-309. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.01.037 http://www.tcsae.org
