溴氰菊酯农药残留检测的分子印迹预聚体系筛选及吸附性能
2019-01-18周刘梅解新安
李 璐,周刘梅,解新安,李 雁
溴氰菊酯农药残留检测的分子印迹预聚体系筛选及吸附性能
李 璐,周刘梅,解新安,李 雁
(华南农业大学食品学院,广州 510640)
为快速筛选及确定合适的预聚体系,以高效制备对茶叶等食品中残留的溴氰菊酯具有特异识别能力的分子印迹聚合物,以溴氰菊酯为模板,采用Materials Studio软件和紫外光谱对预聚体系中功能单体和溶剂进行种类筛选及配比确定,辅助溴氰菊酯分子印迹聚合物的合成设计。对模板与不同功能单体预聚体系的结合能计算和光谱分析结果均表明溴氰菊酯与丙烯酰胺能形成更为稳定的复合物,且以乙腈为溶剂更有利于溴氰菊酯分子印迹聚合物的制备。差示紫外光谱计算进一步得出当溴氰菊酯与丙烯酰胺的化学配位比=4时,可在乙腈溶液中形成稳定的预聚体系,其结合常数为6.614×105。基于上述结果,采用沉淀聚合法正交优化制备溴氰菊酯分子印迹聚合物,扫描电镜和静态平衡吸附试验结果表明所制备聚合物具有良好的多孔结构和特异吸附性,印迹因子为2.269,对3种结构类似物的分离因子均大于3.2。研究结果表明分子模拟和光谱分析方法对分子印迹预聚体系筛选和聚合物合成设计具有重要的指导意义。
农药;分子动力学;紫外可见光谱
0 引 言
拟除虫菊酯类农药凭借杀虫谱广、高效等优点被广泛应用于农业生产和公共卫生领域[1]。但该类农药经食物链富集进入人体内后会引起头晕、恶心和皮肤刺激等不良反应,而且其对机体的免疫力和心血管也有明显的毒害作用[2-3]。因此,建立一种快速、灵敏、便捷的菊酯类农药残留检测方法对于保障食品安全很有必要。分子印迹聚合物(molecularly imprinted polymers,MIPs)作为一类性质稳定、成本低且对模板分子具有特异识别性能的新型材料现已被广泛应用于农残检测的色谱分离、固相萃取和传感器等领域[4-6]。分子印迹聚合中功能单体与模板分子形成的预聚体系及聚合溶剂环境对所制备MIPs的吸附和识别性能有举足轻重的影响[7-8]。目前常用的功能单体和溶剂的筛选方法是试错法,即结合参考文献设计一系列的试验,通过对比试验结果,得到最优的MIPs制备方案。该方法虽能够优化合成方案,但是盲目性强且试验周期长、试错成本高。因此,通过研究预聚体系中模板分子-功能单体间的相互作用情况以实现印迹条件的快速优化成为分子印迹技术的研究热点。

本文以拟除虫菊酯类农药中毒性强、应用范围广的溴氰菊酯(decamethrin,DM)为模板分子,采用计算机分子动力学和紫外光谱法综合研究溴氰菊酯与不同功能单体间的相互作用强弱,完成对功能单体种类及其与模板分子适宜比例的筛选,同时确定适宜的聚合溶剂。以前述预聚体的研究结果为基础,设计正交试验优化沉淀聚合法制备溴氰菊酯MIPs,并对其微观结构和吸附特性进行研究。研究结果将为分子印迹技术应用于拟除虫菊酯类农药的残留检测提供理论依据和数据支持。
1 材料与方法
1.1 基础试剂与仪器
溴氰菊酯、氯氰菊酯、高效氯氟氰菊酯和联苯菊酯(质量分数>98%),江苏荣德试剂厂;丙烯酸(acrylic acid,AA)、丙烯酰胺(acrylamide,AM)、甲基丙烯酸(methacrylic acid,MAA)、乙二醇二甲基丙烯酸酯、偶氮二异丁腈,分析纯,阿拉丁;甲醇、溴化钾,分析纯,浙江晋巨化工有限公司;冰乙酸、乙腈,分析纯,天津大茂化学试剂厂。
UV-2500紫外-可见分光光度计,德国斯派克分析仪器公司;S-4800扫描电子显微镜,日本Hitachi公司;Gemini VII 2390全自动比表面及孔隙分析仪,美国麦克公司;Vertex 70傅里叶变换红外光谱仪,德国布鲁克公司。
1.2 分子印迹预聚体系筛选
1.2.1 分子动力学模拟
计算模拟硬件采用Intel Pentium Dual-Core 2.8 GHz E6300处理器,软件采用Materials Studio软件的Amorphous Cell模块和Discover模块。
模拟过程采用Compass力场,首先通过Amorphous Cell模块建立包含1个模板分子和不同功能单体比例的预聚体系,然后用Discover模块中的minimizer寻找到能量最低构象后通过Discover进行动力学模拟。动力学模拟采用NVT系综,模拟初始速度由Boltzmann分布随机生成,初始温度为298 K,模拟过程中采用Andersen恒温浴以保持温度不变。系统达到平衡后统计复合物、模板分子和功能单体的单点能,并按式(1)计算模板与功能单体相互作用结合能。

式中为各组分的单点能,kJ/mol。
分子动力学模拟中采用显性溶剂模型研究溶剂化效应,模型采用Amorphous Cell模块建立包含1个溴氰菊酯、经确定的功能单体用量及10个溶剂分子的预聚体系,其余参数同上。对溶剂模型,结合能计算公式如式(2)。

1.2.2 溴氰菊酯、功能单体及其混合物紫外吸收光谱扫描
取一系列具塞试管,分别添加10L的1 mmol/L溴氰菊酯乙腈溶液、20L的10 mmol/L功能单体乙腈溶液和摩尔比为1∶2的溴氰菊酯-功能单体混合溶液,加入乙腈定容至10 mL,超声(600 W,20 min),室温静置14 h。乙腈溶液为空白参比,在紫外光谱区(190~400 nm)对溴氰菊酯、功能单体及其混合物进行紫外吸收光谱扫描。
1.2.3 不同摩尔比的模板分子-功能单体混合物预组装体系紫外光谱扫描
取一系列具塞试管,每根试管内均加入1 mmol/L溴氰菊酯乙腈溶液10L,使得试管中溴氰菊酯的浓度固定为0.000 1 mmol/L;依次加入不同体积的10 mmol/L功能单体乙腈溶液,使得溴氰菊酯与功能单体的摩尔比为1∶2、1∶4、1∶6、1∶8、1∶10、1∶12、1∶14,加入乙腈定容至10 mL,超声(600 W,20 min),室温静置14 h。以0.000 1 mmol/L溴氰菊酯乙腈溶液为空白参比,在紫外光谱区(190~400 nm)对模板分子-功能单体混合物预组装体系进行紫外吸收光谱扫描。
1.3 材料制备与表征
1.3.1 溴氰菊酯分子印迹聚合物和非印迹聚合物的制备
采用沉淀聚合法制备溴氰菊酯分子印迹聚合物。称取1.010 g (2 mmol)溴氰菊酯、0.569 g (8 mmol)丙烯酰胺于锥形瓶中,再加入80 mL乙腈溶解,置于磁力搅拌器上常温搅拌1 h,使模板分子与功能单体充分作用形成超分子配合物。然后加入7.920 g (40 mmol)交联剂乙二醇二甲基丙烯酸酯和1.314 g (8 mmol)引发剂偶氮二异丁腈,继续磁力搅拌10 min,使超分子配合物与交联剂和引发剂充分接触,混合均匀,形成透明体系。超声脱气10 min后将混合物转移至三口烧瓶中,在60 ℃恒温水浴锅中机械搅拌反应24 h,搅拌速度控制在100~200 r/min。
对所得聚合物进行抽滤,并用无水乙醇和蒸馏水各清洗2次,于65 ℃烘箱中干燥12 h;以甲醇乙酸溶液(体积比1∶1)作为洗脱溶剂,85 ℃恒温抽提10 h以除去模板分子,用甲醇洗去乙酸后再用蒸馏水反复清洗聚合物,最后将其置于65 ℃烘箱中烘干至质量恒定,得到的白色粉末状聚合物即为溴氰菊酯分子印迹聚合物。
非印迹聚合物(non-imprinted polymers,NIPs)的制备及处理方法同MIPs,但不加入模板分子。
1.3.2 溴氰菊酯分子印迹聚合物和非印迹聚合物的表征
将溴氰菊酯MIPs和NIPs进行喷金处理后,用扫描电子显微镜观测形貌。使用Gemini VII 2390分析仪测量MIPs和NIPs比表面积和孔隙参数。采用溴化钾压片法,用Vertex 70傅里叶变换红外光谱仪对MIPs和NIPs进行红外光谱分析(波数范围:4 000~400 cm–1)。
1.4 溴氰菊酯分子印迹聚合物吸附性能试验设计
1.4.1 静态吸附试验
称取25 mg聚合物,置于装有25 mL浓度为100 mg/L 的溴氰菊酯乙腈溶液中,在室温下水浴振荡24 h (100 r/min)。静置5 min后,过滤,取滤液稀释后用紫外-可见光分光光度计在220 nm处测定吸光度,根据标准曲线(Abs=0.067 81+0.079 9,2=0.998 3,标准曲线适用浓度范围为2~12 mg/L)计算平衡吸附后的物质浓度,并由式(3)计算聚合物的吸附量。
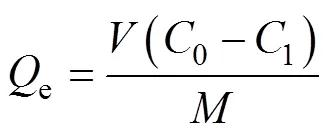
式中1为平衡吸附后溶液中目标物质的浓度,mg/L;0为目标物质的起始浓度,mg/L;为聚合物的质量,g;e为静态平衡吸附量,mg/g;为物质溶液的体积,mL。
1.4.2 选择性吸附试验
称取25 mg聚合物加入浓度为100 mg/L的溴氰菊酯溶液及其结构类似物(即氯氰菊酯、高效氯氟氰菊酯和联苯菊酯)溶液25 mL,在30 ℃下振荡24 h后取滤液,于各菊酯类农药的特征波长下用紫外-可见光分光光度计测定吸光度,根据标准曲线计算平衡吸附后的物质浓度,并根据式(3)、(4)、(5)和(6)计算溴氰菊酯MIPs对各菊酯类农药的吸附量(e)、静态分配系数()、分离因子()和印迹因子(IF)。

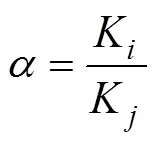

式中P为底物结合在聚合物上的浓度,mg/L;IF用于表征MIPs及NIPs的特异性结合能力,IF越大表明特异性越强;和分别为模板分子和竞争分子。为静态分配系数,越大表明聚合物的吸附能力越大;MIPs和NIPs分别为MIPs和NIPs的静态分配系数;>1说明溴氰菊酯MIPs能识别模板分子,且越大说明印迹效果越好。
2 结果与讨论
2.1 计算机分子动力学模拟
功能单体的选择主要由模板分子的结构特征确定,它必须能与模板分子作用且足够强,以利于MIPs中选择性识别位点的形成。溴氰菊酯分子中含有卤素双键、酯键、氰基等官能团,有3个不对称的碳原子,在酸性介质中较稳定。因此初选甲基丙烯酸(methacrylic acid, MAA)和丙烯酸(acrylic acid, AA)2种酸性单体、丙烯酰胺(acrylamide, AM)中性单体为功能单体,设定模板分子与功能单体的比例为1∶2、1∶4、1∶6、1∶8,用1.2.1中所述模拟方法,在Compass力场和NVT系综下对模板分子与功能单体构型进行优化,得到复合物平衡构象,然后采用结合能Δ来表征溴氰菊酯和不同单体之间的相互作用,结果见图1。

图1 溴氰菊酯与不同功能单体在不同比例下的结合能(DE)
模板分子溴氰菊酯与功能单体形成复合物时结合能越低,说明模板与功能单体的结合作用力越大,复合物也相对越稳定[18]。由图1可知,3种复合物的结合能均随着功能单体比例的增加而降低,当模板分子与功能单体的比例在1∶6~1∶8范围时结合能的变化趋于平缓,其中DM-AM复合物在1∶2~1∶4的比例范围内结合能的下降趋势最为明显且结合能最低,这说明3种功能单体均能与溴氰菊酯相互作用,而DM与AM之间可形成更为稳定的预聚体系。据此推测制备DM MIPs时AM为更合适的功能单体,DM和AM的摩尔比在1∶4~1∶6所得聚合物可能更稳定。
基于以上结果,采用Amorphous Cell模块建立包含1个DM、4个AM及10个溶剂(溶剂种类为乙腈、丙酮、氯仿和正己烷)的预聚体系,对不同溶剂中溴氰菊酯和AM的结合能进行计算,结果如表1所示。

表1 不同溶剂中DM-4AM复合物的结合能
由表1可知,1个DM和4个AM复合物体系中,结合能的大小为正己烷>氯仿>丙酮>乙腈,说明复合物与乙腈的相互作用最小,有利于提供较好的聚合环境。用此配比在不同溶剂中按1.3.1所述方法进行沉淀聚合,发现以氯仿为聚合溶剂时,无沉淀析出,合成失败;以丙酮为聚合溶剂时,所制备的MIPs粒径较大,且按1.4.1所述方式测定的静态吸附量(23.81 mg/g)较低,而在乙腈溶剂中合成的溴氰菊酯MIPs具有较好的印迹效果,其静态吸附量为51.04 mg/g,试验结果表明可依据计算机模拟计算所得结合能快速筛选聚合所需溶剂。
2.2 紫外光谱分析
2.2.1 溴氰菊酯、功能单体以及混合物的紫外吸收光谱差异分析
根据紫外光谱测定的原理可知,对于相互之间没有任何相互作用力的2种化合物,其混合物在某一波长下的吸光度应该等于2种化合物分别于该波长下的吸光度之和(即理论吸光度)[19];其中,在分子印迹中不同功能单体与模板分子相互作用力的大小可由模板分子-功能单体的实际吸光度与理论值的差示吸光度的大小作初步的判断。模板分子-功能单体实际值与理论值的最大吸收峰处的差示吸光度越大,预示着模板分子与功能单体之间相互作用越强,所制备的分子印迹聚合物的选择性识别能力越高[20]。本研究采用紫外光谱法研究乙腈溶液中模板分子溴氰菊酯与3种不同功能单体(AA、AM和MAA)的相对结合能力,结果如图2所示。
由图2可知,溴氰菊酯-功能单体(AA、 AM和MAA)混合物在吸收峰处吸光度的实际值均大于理论值,说明溴氰菊酯与3种功能单体之间均存在可相互结合的作用力。在吸收峰(200 nm)处实际值与理论值的差示吸光度∆具体为:∆DM–AA=0.174、∆DM–AM=0.187、∆DM–MAA= 0.132;其中DM-AM混合物的紫外差示吸光度最大。由此可知,溴氰菊酯与AM之间的相互作用更强,即以溴氰菊酯为模板分子时,相比较于AA和MAA,AM是较为理想的功能单体,这一结果与分子动力学模拟结果相一致。

图2 溴氰菊酯、丙烯酸、丙烯酰胺、甲基丙烯酸及其混合物的紫外吸收光谱
2.2.2 预聚体系差示紫外光谱分析
差示紫外光谱法通常被用于研究分子印迹预聚体系中主客体的相互作用,该方法通过测定模板分子-功能单体复合物的差示吸光度∆并对其进行拟合,绘制∆对单体浓度b(=1、2、3……代表各浓度梯度)的化学配位数幂b之比∆b–n与∆的曲线,考察曲线线性相关性并确定模板分子和功能单体间的化学配位比和结合常数,进而指导和优化MIPs的合成。溴氰菊酯与3种功能单体在不同浓度比例下的差示紫外光谱如图3所示。
由图3可知,整体而言,随着功能单体浓度的增加,复合物的吸光度呈现上升的趋势,当功能单体浓度达到一定值时,上升的趋势趋于缓慢;同时,特征吸收峰向长波长移动发生了红移现象。由此可知,在一定范围内增加功能单体的比例,有助于溴氰菊酯与功能单体形成更多的选择性识别位点;但当功能单体浓度过量时,可能出现功能单体自身结缔作用,造成非特异性识别位点增多。再对比图3a、图3b和图3c的红移程度,其中DM-AA复合物特征峰的吸光度红移了2 nm,DM-AM复合物特征峰吸光度红移了4 nm,DM-MAA复合物特征峰吸光度红移2 nm;由此可知DM-AM复合物特征峰的位移量相对较大,即溴氰菊酯与AM的作用力更加稳固。

图3 溴氰菊酯与不同比例的功能单体预聚体差示紫外光谱
参考已报道的文献[21],模板分子与功能单体间相互作用的公式可推导整理如式(7)。
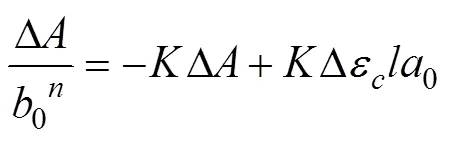
式中为化学配位比,在0≥0前提下,可取=1、2、3……等整数;0为功能单体浓度;0为模板溴氰菊酯浓度;∆为溴氰菊酯-功能单体复合物的差示吸光度;为结合常数;∆ε=(ε–ε),其中ε和ε分别为溴氰菊酯和溴氰菊酯-功能单体复合物的摩尔吸光系数;为比色皿厚度。
依据图3数据以∆0–n对∆作图时发现,当溴氰菊酯与功能单体浓度比为1∶2、1∶4和1∶6时,拟合曲线相关性较差。分析原因是式(7)成立的假设条件是0≥0,即功能单体的添加量远大于模板分子添加量,显然这3种浓度并不满足上述假设条件,因此只对比例为1∶8~1∶14时的最强吸收峰值进行拟合计算,结果如表2所示。
从表2可以看出,对于DM-AA体系,当化学配位比为1、2、3时拟合曲线的2均大于0.96,体现出良好的线性相关性,但三者中=3时的结合常数最大,说明1个溴氰菊酯最有可能与3个AA作用,形成较为稳定的复合物。对于DM-AM体系,5条拟合直线的线性相关性总体较高,其中=2、3和4的拟合曲线的2均大于0.99,表明1个溴氰菊酯与2个、3个或4个AM分子形成的复合物相对稳定。同时可以看出,当溴氰菊酯与AM的配位比=4时,所得复合物的结合常数最大,为6.614´105,说明DM与AM形成的最主要复合物为DM-4AM型。而对于DM-MAA体系,5条拟合直线的线性都比较差,说明溴氰菊酯与MAA难以形成稳定的复合物。

表2 溴氰菊酯与不同功能单体预聚体系的紫外光谱拟合参数
注: ∆为溴氰菊酯-功能单体复合物的差示吸光度。
Note: ∆is differential absorbance of deltamethrin - functional monomer complex.
上述紫外光谱研究结果表明,相比较于AA和MAA,溴氰菊酯与AM可形成更为稳定的复合物,相互间的作用力更强;且当=4,即溴氰菊酯与AM的化学配位比为1∶4时,形成的预聚体复合物较为稳定。
综合动力学模拟和紫外光谱法对预聚体系的研究结果可知,当以溴氰菊酯为模板分子时,选择AM为功能单体且其与溴氰菊酯的化学配位比为1∶4,且以乙腈为聚合溶剂时,可制备具有较好印迹效果的分子印迹聚合物。
2.3 多因素正交试验
根据2.1和2.2部分对溴氰菊酯与不同功能单体预聚体系的研究结果,选取功能单体AM用量、交联剂乙二醇二甲基丙烯酸酯用量、溶剂乙腈用量作为3个因素,利用L9(34)设计正交试验,其因素和水平如表3所示。

表3 正交试验因素水平
固定溴氰菊酯与丙烯酰胺的摩尔比为1∶4,以偶氮二异丁腈为引发剂,采用沉淀聚合法在所设计的因素水平下制备溴氰菊酯分子印迹聚合物。正交试验结果及方差分析见表4和表5。由表4的极差分析可以看出,各因素对印迹聚合物的静态吸附性能影响顺序为功能单体用量>溶剂用量>交联剂用量,得出的最佳试验组合是221,即功能单体AM用量4 mmol,交联剂乙二醇二甲基丙烯酸酯用量20 mmol即(溴氰菊酯)、丙烯酰胺与乙二醇二甲基丙烯酸酯的摩尔比为1∶4∶20,乙腈溶剂用量40 mL,恰好是表4中的7号试验组。参照此条件,对所得的优化配方进行3次平行试验验证,所制备聚合物的平均静态吸附量为68.61 mg/g。表5的方差分析结果也表明功能单体和溶剂用量对聚合物吸附特性影响显著,再次印证对功能单体和溶剂进行预聚体系筛选的必要性。
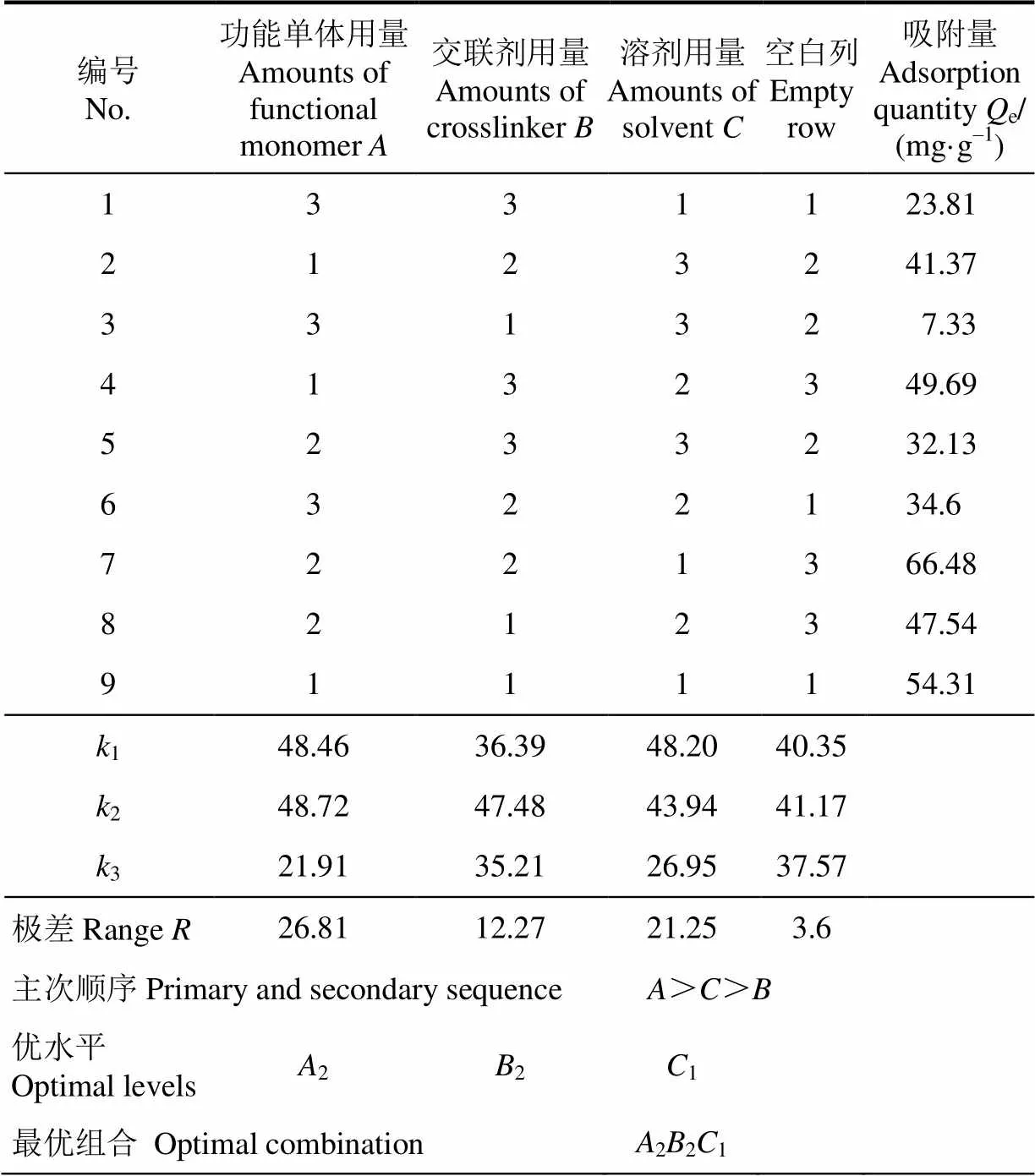
表4 正交试验方案及结果
注:1~3分别表示各因素各水平下值的总和。
Note:1-3refer to sum of values of each factor at each level.

表5 正交试验方差分析
注:*代表差异显著,<0.05。
Note: * represents test factor is significant different,<0.05.
2.4 分子印迹聚合物的表征
2.4.1 溴氰菊酯MIPs的微观结构
聚合物的表面结构、孔径和孔容等对其吸附和识别性能有很大的影响。分子印迹聚合物应具备一定的三维孔穴结构,使识别位点固定在聚合物的骨架中确保目标分子能够快速的与识别位点结合,同时能够保持洗去模板分子后孔穴的大小和形状,使孔穴维持对模板分子的再结合能力[22]。
以上述优化比例制备溴氰菊酯分子印迹聚合物的表观结构及孔特性如图4和表6所示。
由图4可以看出,所制备的溴氰菊酯MIPs形状规整,粒径较小且相对均匀,存在紧密交错的网络状微孔;NIPs表面则呈现不规则的块状,且存在团聚现象。从表6的比表面积和孔容参数可知,溴氰菊酯MIPs的孔径小于NIPs,这与扫描电镜图的结果一致,但具有更大的比表面积和孔容,这种三维孔穴结构有利于底物与结合位点接触,使得溴氰菊酯MIPs比NIPs具有更好的吸附能力[23]。
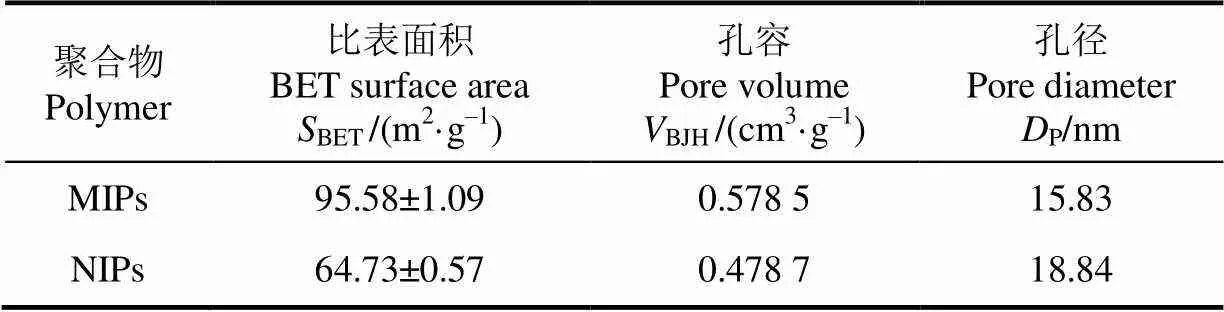
表6 分子印迹聚合物和非印迹聚合物的比表面积与孔容参数
2.4.2 傅里叶红外光谱分析
红外光谱法是根据分子内部原子间的相对振动和分子转动等信息来确定物质分子结构和鉴别化合物的方法,可用于分析分子印迹聚合物中模板分子与功能单体结合过程中基团的变化以及结合位点的位置[24]。采用红外光谱技术测定溴氰菊酯标准品、NIPs、溴氰菊酯MIPs和吸附溴氰菊酯后的MIPs的红外谱图,结果见图5。

注:a为DM;b为NIPs;c为DM MIPs;d为吸附DM后的MIPs。
由图5可知,所制备溴氰菊酯MIPs在 3 565和 3 454 cm–1处有吸收峰,且谱带较强,为丙烯酰胺的N-H的伸缩振动。2 987和2 955 cm–1处为烷烃C-H的伸缩振动吸收峰。1 730 cm–1处为C=O的伸缩振动。1 635 cm–1处为C=C的伸缩振动,说明可能存在未反应完全的C=C。1 259和1 157 cm–1分别为C-O-C的对称和不对称伸缩振动,说明交联剂与功能单体等进行了交联聚合[25]。溴氰菊酯MIPs和NIPs的谱图相似,证明聚合物成功聚合和洗脱[26]。吸附溴氰菊酯后的MIPs其吸收峰比MIPs强;同时在3 200~3 600 cm–1范围内,吸收峰向短波数方向移动,可能存在酰胺的N-H的伸缩振动和溴氰菊酯中C=O的伸缩振动,且N-H和C=O可形成氢键[27];烷烃C-H的伸缩振动峰强度增大且存在泛频峰;1 048和880 cm–1处的C-N伸缩振动和乙烯基中C-H的面外弯曲振动吸收峰均有加强,表明溴氰菊酯成功吸附于MIPs;溴氰菊酯中的C=O质子受体与3 454 cm–1处的N-H作用形成的氢键为模板与聚合物的主要结合点。
2.5 溴氰菊酯MIPs的特异性吸附
以溴氰菊酯及其结构类似物氯氰菊酯、高效氯氟氰菊酯和联苯菊酯为底物,底物质量浓度为100 mg/L,采用静态平衡结合方法,在30 ℃温度下吸附24 h后测定所制备聚合物对各底物的静态吸附量、分离因子和印迹因子(见表7)。从表7可以看出,溴氰菊酯MIPs对溴氰菊酯的吸附量及静态分配系数明显高于其结构类似物,且相应的分离因子均大于3.2;同时,溴氰菊酯MIPs和NIPs对各物质的印迹因子均大于1,其中溴氰菊酯对应的印迹因子为2.269,说明溴氰菊酯MIPs对模板溴氰菊酯表现出较高的特异吸附性。结合溴氰菊酯及其类似物的结构可知,氯氰菊酯和高效氯氟氰菊酯与溴氰菊酯的结构相似,但是2个溴原子的改变使得它们与聚合物的三维孔穴结构的匹配度下降且亲和性降低等;联苯菊酯的结构与溴氰菊酯差异较大,同时存在空间位阻而导致溴氰菊酯MIPs对其吸附性能较差。试验结果表明计算机和紫外光谱分析辅助设计所制备的溴氰菊酯MIPs具有较高的特异吸附性。

表7 溴氰菊酯MIPs和NIPs的选择性参数
3 结 论
本文以溴氰菊酯为模板,采用计算机分子模拟和紫外光谱分析法筛选适宜的聚合溶剂和功能单体,同时确定功能单体与溴氰菊酯的比例;以此为基础采用沉淀聚合法制备溴氰菊酯分子印迹聚合物并通过正交试验优化制备方案,同时对其吸附特性进行研究。可得出以下结论:
1)采用分子动力学和紫外光谱法对预聚体进行研究,结合能和差示紫外光谱法结果表明:丙烯酰胺为功能单体,且当溴氰菊酯与功能单体的摩尔比为1∶4时,可在乙腈溶液中得到较为稳定的复合物预聚体。
2)以预聚体的研究结果为基础通过正交试验对合成方案进行优化,结果表明:模板分子(溴氰菊酯)、功能单体(丙烯酰胺)与交联剂(乙二醇二甲基丙烯酸酯)的摩尔比为1∶4∶20,对应40 mL乙腈聚合溶剂,制备的聚合物的选择性和印迹效率最佳,平行验证试验确认其饱和吸附量为68.61 mg/g,印迹因子为2.269。
3)微观结构和红外光谱表征结果表明所制备MIPs具有较规整的交错微孔结构,溴氰菊酯中的羰基与酰胺基团可作用形成氢键,是主要的特异性识别位点。
论文研究结果表明计算机分子模拟和紫外光谱法对预聚体系的研究有助于提高优化试验条件效率,所制备溴氰菊酯MIPs具有较高的特异吸附性能。
[1] Liu Xingyu, Zhang Qiuping, Li Shibao, et al. Developmental toxicity and neurotoxicity of synthetic organic insecticides in zebrafish (): A comparative study of deltamethrin, acephate, and thiamethoxam[J]. Chemosphere, 2018, 199(1): 16-25.
[2] Liu Pengyan, Liu Yujie, Liu Qingxue, et al. Photodegradation mechanism of deltamethrin and fenvalerate[J]. Journal of Environmental Sciences, 2010, 22(7): 1123-1128.
[3] Rehman H, Ali M, Atif F, et al. The modulatory effect of deltamethrin on antioxidants in mice[J]. Clinica Chimica Acta, 2006, 369(3): 61-65.
[4] 赵风年. 基于磁性纳米分子印迹技术的三唑类农药多残留检测方法研究[D]. 北京:中国农业科学院,2017. Zhao Fengnian. Study on the Multi-residues Detection of Triazole Pesticides Based on Magnetic Nano Molecularly Imprinted Technology[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2017. (in Chinese with English abstract)
[5] Ge Shengguang, Lu Juanjuan, Ge Lei, et al. Development of a novel deltamethrin sensor based on molecularly imprinted silica nanospheres embedded CdTe quantum dots[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2011, 79(5): 1704-1709.
[6] Shi Xizhi, Liu Jinghua, Sun Aili, et al. Group-selective enrichment and determination of pyrethroid insecticides in aquaculture seawater via molecularly imprinted solid phase extraction coupled with gas chromatography-electron capture detection[J]. Journal Chromatogr A, 2012, 1227: 60-66.
[7] Mariusz M, Teobald K, Piotr P W, et al. Computational modeling of molecularly imprinted polymers as a green approach to the development of novel analytical sorbents[J]. Trends in Analytical Chemistry, 2018, 98: 64-78.
[8] Han Yi, Gu Lili, Zhang Mengxiao, et al. Computer-aided design of molecularly imprinted polymers for recognition of atrazine[J]. Computational and Theoretical Chemistry, 2017, 1121: 29-34.
[9] 黄雨杰,朱秋劲,赵晓联.紫外光谱与密度泛函理论在亚精胺分子印迹预组装体系中的研究[J]. 北京化工大学学报:自然科学版,2014(4):48-54. Huang Yujie, Zhu Qiujin, Zhao Xiaolian. Ultraviolet spectroscopy and density functional theory study of spermidine molecularly imprinted pre-assembly systems[J]. Journal of Beijing University of Chemical Technology: Natural Science, 2014(4): 48-54. (in Chinese with English abstract)
[10] 尹小英,衷友泉,江一帆,等. 分子印迹聚合反应中功能单体与模板分子间作用力的光谱分析[J]. 光谱学与光谱分析,2010(8):2211-2214. Yin Xiaoying, Zhong Youquan, Jiang Yifan, et al. The spectroscopy analysis of intermolecular interaction between the template molecule and functional monomer before polymerization[J]. Spectroscopy and Spectral Analysis, 2010(8): 2211-2214. (in Chinese with English abstract)
[11] 朱晓兰. 久效磷分子印迹聚合物的研究与应用[D]. 合肥:中国科学技术大学,2006. Zhu Xiaolan. Monocrotophos-specific Molecular Imprinted Polymers and its Applications for Analysis of Organophosphorus Pesticides[D]. Hefei: University of Science & Technology of China, 2006. (in Chinese with English abstract)
[12] Farrington K, Magner E, Regan F. Predicting the performance of molecularly imprinted polymers: Selective extraction of caffeine by molecularly imprinted solid phase extraction[J]. Analytica Chimica Acta, 2006, 566(1): 60-68.
[13] Yang Wenming, Liu Lukuan, Zhou Zhiping, et al. Rational preparation of dibenzothiophene-imprinted polymers by surface imprinting technique combined with atom transfer radical polymerization[J]. Applied Surface Science, 2013, 282: 809-819.
[14] Chen Lingxin, Wang Xiaoyan, Lu Wenhui, et al. Molecular imprinting: Perspectives and applications[J]. Chemical Society Reviews, 2016, 45(8): 2137-2211.
[15] Martins N, Carreiro E P, Locati A, et al. Design and development of molecularly imprinted polymers for the selective extraction of deltamethrin in olive oil: An integrated computational-assisted approach[J]. Journal of Chromatography A, 2015, 1409: 1-10.
[16] 郭逸蓉. 计算机辅助设计拟除虫菊酯类农药分子印迹聚合物研制[D]. 杭州:浙江大学,2010. Guo Yirong. Computer-assisted Design for the Preparation of Molecularly Imprinted Polymers for Pyrethroid Pesticides[D]. Hangzhou: Zhejiang University, 2010. (in Chinese with English abstract)
[17] 戴芳芳. 溴氰菊酯电化学快速检测及分子印迹预组装体系研究[D]. 重庆:西南大学,2016. Dai Fangfang. Research on Deltamethri`s Rapid Detection by Electrochemical Merhod and Molecular Imprinting Preassembly System[D]. Chongqing: Southwest University, 2016. (in Chinese with English abstract)
[18] Bakas I, Oujji N B, Moczko E, et al. Computational and experimental investigation of molecular imprinted polymers for selective extraction of dimethoate and its metabolite omethoate from olive oil [J]. Journal of Choromatography A, 2013, 1274(1): 13-18.
[19] 朱淮武. 有机分子结构波谱解析[M]. 北京:化学工业出版社,2005.
[20] 高文惠,高林,刘博,等. 制备戊唑醇分子印迹聚合物前功能单体的选择[J]. 中国食品学报,2015,15(6):173-177. Gao Wenhui, Gao Lin, Liu Bo, et al. Selection of functional monomer before the preparation of tebuconazole molecularly imprinted polymer[J]. Journal of Chinese Institute of Food
Science and Technology, 2015, 15(6): 173-177. (in Chinese with English abstract)
[21] 张孝刚,朱秋劲,胡萍. 三聚氰胺分子印迹预组装体系紫外光谱研究[J]. 食品科学,2011,32(21):128-132.Zhang Xiaogang, Zhu Qiujin, Hu Ping. Ultraviolet spectroscopy investigation into molecular imprinting pre-assembly system[J]. Food Science, 2011, 32(21): 128-132. (in Chinese with English abstract)
[22] Cormack P A G, Elorza A Z. Molecularly imprinted polymers: Synthesis and characterisation[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2004, 804(1): 173-182.
[23] 张连科,刘心宇,王维大,等. 油料作物秸秆生物炭对水体中铅离子的吸附特性与机制[J]. 农业工程学报,2018,34(7):218-226. Zhang Lianke, Liu Xinyu, Wang Weida, et al. Characteristics and mechanism of lead adsorption from aqueous solutions by oil crops straw-derived biochar[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(7): 218-226. (in Chinese with English abstract)
[24] Chrzanowska A M, Poliwoda A, Wieczorek P P. Characterization of particle morphology of biochanin A molecularly imprinted polymers and their properties as a potential sorbent for solid-phase extraction[J]. Materials Science and Engineering: C, 2015, 49: 793-798.
[25] Wang Hongwu, Liu Yanqing, Yao Su, et al. Selective recognization of dicyandiamide in bovine milk by mesoporous silica SBA-15 supported dicyandiamide imprinted polymer based on surface molecularly imprinting technique[J]. Food Chemistry, 2018, 240: 1262-1267.
[26] 庞思思. 沉淀制备双酚A π-π堆积自组装印迹聚合物及其特异性识别机理研究[J]. 高分子学报,2014(1):49-55. Pang Sisi. Synthesis of bisphenol-A stacking self-assembly imprinted polymer by precipitation polymerization and study on specificity recognition mechanism[J]. Acta Polymerica Sinica, 2014(1): 49-55. (in Chinese with English abstract)
[27] 佘永新,王淼,史晓梅,等. 类特异性分子印迹聚合物微球的识别机理及其光谱学研究[J]. 光谱学与光谱分析, 2010,30(11):3052-3055. She Yongxin, Wang Miao, Shi Xiaomei, et al. Spectroscopy study of binding mechanisms and molecular recognition of class-specific molecularly imprinted polymer beads[J]. Spectroscopy and Spectral Analysis, 2010, 30(11): 3052-3055. (in Chinese with English abstract)
Screening of molecularly imprinted pre-assembly system for detection of deltamethrin pesticide residues and its specific adsorption properties
Li Lu, Zhou Liumei, Xie Xinan, Li Yan
(510640,)
To efficiently prepare decamethrin molecular (DM) imprinted polymers, the molecular dynamics simulation and ultraviolet spectrum were involved to study the preassembled system of DM and functional monomers in this paper. The binding energy (∆) between DM and three different functional monomers (acrylic acid, AA; acrylamide, AM; methacrylic acid, MAA) in different solvents (n-hexane, chloroform, acetone and acetonitrile) were calculated by molecular dynamics simulation. Results showed that the AM monomer and acetonitrile solvent had the highest stabilization energy for the pre-polymerization adducts. Additionally, the polymer obtained from the molar ratio of DM to AM at 1:4 to 1:6 may be more stable. Ultraviolet spectrum analysis results showed that there was strong interaction between DM and AM, the red shift degree of ultraviolet spectrum maximum absorption peak followed the order: AM > AA = MAA, and then indicated that AM was most suitable monomers for DM molecular imprinted polymers, which was consistent with the predictions based on the computer simulation. Differential ultraviolet spectrum showed that when acetonitrile used as solvent, one DM molecule could be combined with AA monomer in the ratio of 1:3 or AM monomer in the ratio of 1:4. However, it was difficult for DM to form stable complex with MAA because the fitting correlation coefficient of the equation was less than 0.86. Best performance was observed when chemical coordination ratio () between DM and AM was equal to 4, at this time, the fitting correlation coefficientof the equation was 0.997 3, and the binding constantwas 6.614×105. Based on the above computer simulation and ultraviolet spectrum analysis results, the molecularly imprinted polymers of DM were synthesized by the precipitation polymerization method with the AM as the functional monomer, and its synthetic formula was optimized through orthogonal experiment design. Then, the optimum imprinting conditions were established: 1 mmol DM as the template molecule, 4 mmol AM as the functional monomers, 40 mL acetonitrile as the solvent, 20 mmol ethylene dimethacrylate (EGDMA) as the cross-linker. Using these conditions, the DM molecular imprinted polymers had bigger saturated adsorption capacity of 68.61 mg/g than other conditions. The prepared molecular imprinted polymers were characterized by scanning electron microscopy (SEM), brunauer-emmett-teller (BET) and Fourier transform infrared spectroscopy (FTIR). SEM demonstrates that the DM molecular imprinted polymers formed staggered porous structure. The data of BET revealed that the DM molecular imprinted polymers had smaller pore size (15.83 nm) than non-imprinted polymers (18.84 nm), but with a larger specific surface area (95.58 m2/g) and pore volume (0.578 5 cm3/g). The FTIR results confirmed the successful preparation of the DM molecular imprinted polymers. And then the adsorption selectivity of prepared polymers on deltamethrin and its analogues cypermethrin, lambda-cyhalothrin and bifenthrin were studied. The experimental results showed that the static equilibrium adsorption capacity and static distribution coefficient of DM was much higher than that of other analogues. Its imprinting factor (IF) was 2.269, and the corresponding separation factor α was more than 3.2, which has exhibited obvious specific identification. All above results showed that computer simulation and ultraviolet spectrum analysis could help to design the better performance molecular imprinted polymers.
pesticide; molecular dynamics; ultraviolet visible spectroscopy
2018-06-09
2018-10-19
广州市科技计划项目(20160701140); 国家自然科学基金项目(31501471)
李 璐,副教授,主要从事功能材料的制备与应用研究。 Email:lulu_lee@scau.edu.cn
10.11975/j.issn.1002-6819.2019.01.033
TQ424.3
A
1002-6819(2019)-01-0269-09
李 璐,周刘梅,解新安,李 雁.溴氰菊酯农药残留检测的分子印迹预聚体系筛选及吸附性能[J]. 农业工程学报,2019,35(1):269-277. doi:10.11975/j.issn.1002-6819.2019.01.033 http://www.tcsae.org
Li Lu, Zhou Liumei, Xie Xinan, Li Yan.Screening of molecularly imprinted pre-assembly system for detection of deltamethrin pesticide residues and its specific adsorption properties[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(1): 269-277. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.01.033 http://www.tcsae.org
