睡眠问题与特应性皮炎:双向车道?
2019-01-17YungSenChangMDMPHPhDandBorLuenChiangMDPhD
Yung-Sen Chang, MD, MPH, PhD, and Bor-Luen Chiang, MD, PhD
翻译:李俊达 中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科
审校:李 巍 复旦大学附属华山医院皮肤科
特应性皮炎(AD)是一种常见的慢性复发性、瘙痒性、炎症性皮肤病,儿童患病率约15%~30%,成人约2%~10%[1],其发病机制复杂,目前尚未完全阐明[2]。长期以来人们就发现睡眠障碍在AD患者非常常见,是导致生活质量下降的主要因素[3-5],常被看作是AD症状之一。例如,SCORAD指数(最常用于评估AD症状的评分)包括对主观睡眠缺失的视觉模拟量表[6],评价AD治疗效果的研究通常观察治疗能否改善睡眠[7-9]。然而,越来越多的研究发现睡眠障碍与AD存在复杂的相互作用,并对AD患者具有广泛的影响。因此,我们建议将AD患者睡眠问题看作AD的并发症,并单独进行定期评估和治疗。
1 AD患者的睡眠问题
据报道47%~80%的儿童AD患者和33%~87.1%的成年AD患者存在睡眠障碍(表1)[1-21],大多数研究中对AD患者睡眠障碍的评价都是基于主观睡眠问题的问卷。儿童和成年AD患者的常见睡眠问题包括入睡困难、夜间频醒和日间嗜睡[4,10,13-14,16-20]。研究发现AD患儿在入睡后更容易醒来,早上醒来也更困难[4,14-15,19-21]。Chamlin等报道30%的AD患儿与父母同睡,其中66%的患儿会影响他们父母的睡眠。
仅有少数研究客观评估AD患者的睡眠(表1)。实验室多导睡眠描记术(PSG,评价睡眠的金标准)很少被用来评估AD患儿睡眠[22-24],可能是因为需要在睡眠中心过夜不够便利,同时PSG检测期间需要连接多条引线和设备可能对AD患者皮肤造成更多刺激。应用PSG方法,Hon等[24]发现相比于健康对照,AD患儿睡眠效率(床上入睡时间的占比)显著降低(72%vs88%,P=0.04);Stores等[25]报道称AD患儿睡眠紊乱程度至少是健康对照的4倍,无论是短时(<2 min)清醒期还是长时(>2 min)清醒期;我们团队发现AD患者相比于健康对照睡眠效率显著降低(71.2%vs76.2%,P=0.004),深度睡眠期(non-REM)减少[15]。
活动记录仪是一种小型腕带设备,它基于活动来监测评估睡眠-清醒状态,因为使用方便,越来越多地被应用于客观评估AD患者睡眠[3]。我们团队验证了活动记录仪在评价AD患者时与金标准PSG有很好的相关性,建议活动记录仪作为未来研究评估AD患者睡眠的有效方法[15]。Benjamin等[26]发现AD患儿夜晚睡眠时间相较于健康对照平均减少46 min(468±3vs422±37 min)。Hon等[27]报道活动记录仪结果与疾病严重程度具有相关性(r=0.52,P<0.01),尤其是AD患儿在进入睡眠的前3个小时。我们利用活动记录仪评估了72个AD患儿和32个健康对照,发现AD患儿睡眠效率降低(74.5%±9.2%vs81.2%±7.6%,P=0.001)、入睡后醒来次数增多(73.2±45.7vs50.7±29.9 min,P=0.004)、需要更多时间入睡(45±29.3vs27±16.2 min,P<0.001)和睡眠碎片化程度更高[15]。
据报道一些特定类型的睡眠问题与AD有关。
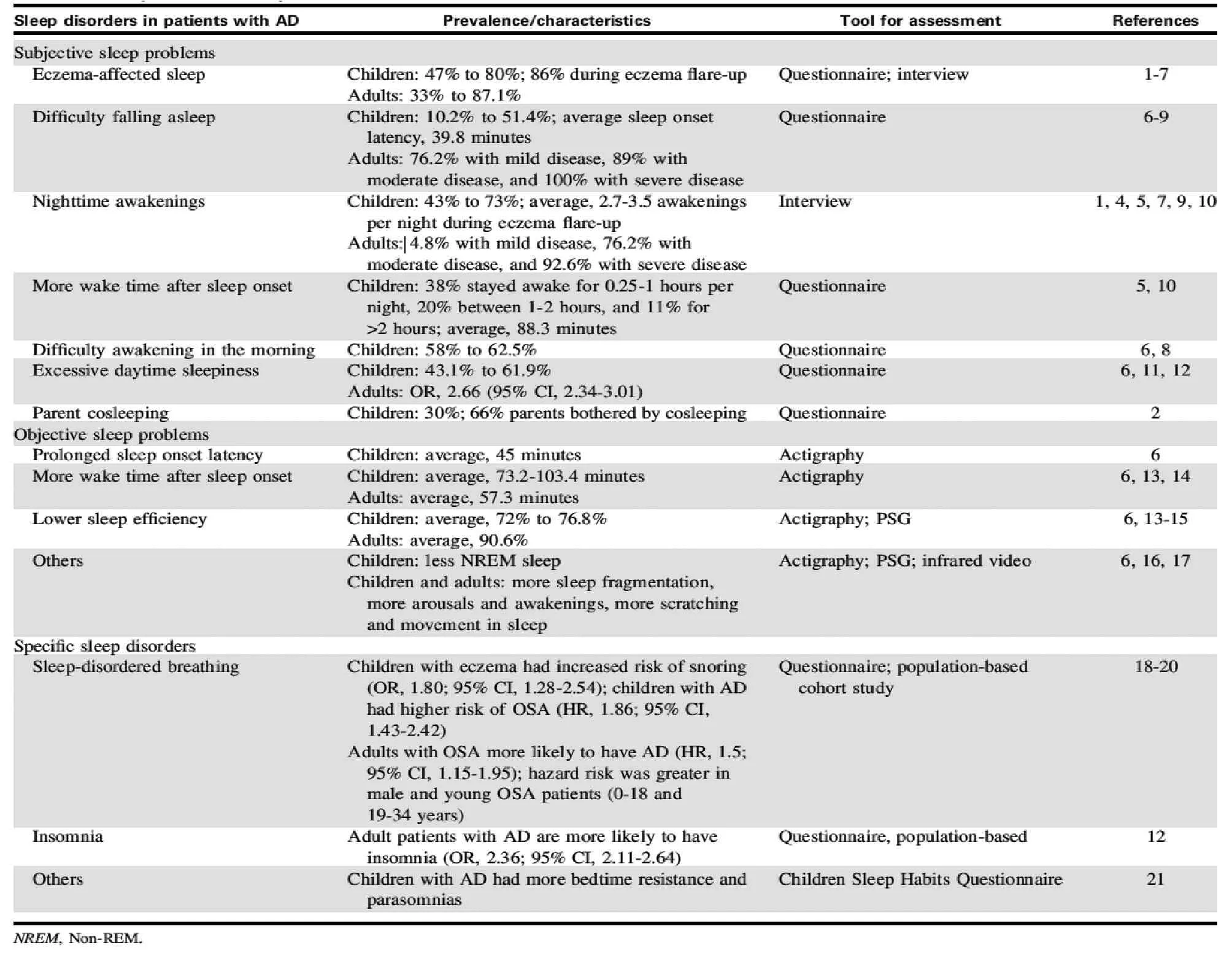
表1 AD患者睡眠障碍
数项研究发现睡眠呼吸障碍和AD有关:Chng等针对新加坡幼儿园儿童和小学生的研究发现习惯性打鼾与AD有关(优势比[OR],1.80; 95%CI,1.28~2.54)[28]。中国台湾一项人群研究发现睡眠呼吸暂停综合征(OSA)患者的AD风险更高(风险比[HR], 1.5; 95%CI,1.15~1.95),尤其是男性(HR,1.53;95%CI,1.14~2.06)、18岁以下儿童患者(HR,4.01; 95%CI,1.57~10.26)和19~34岁患者(HR,1.75; 95%CI,1.00~3.04;适用于过敏性鼻炎和过敏性哮喘)[29]。18岁以下AD患者的OSA风险更大(HR,1.86; 95%CI,1.43~2.42;适用于AD的并发症,例如鼻炎)[30]。目前关于AD和OSA之间联系的假设可能是由于氧化应激和全身炎症的共享信号通路引起[29-30]。AD患者交感神经兴奋和睡眠碎片化可能同样是由于睡眠中上呼吸道不稳定性造成的[31]。一项美国人群研究发现成人湿疹与长期失眠有关(OR,2.36;95%CI,2.11~2.64)[20]。Urrutia-Pereira等[18]报道称在拉丁美洲儿童中,AD患者更容易出现入睡困难、睡眠呼吸紊乱和异常睡眠。Cicek 等[32]报道称AD患者更易出现不宁腿综合征,虽然联系的机制尚不清楚。因此,我们建议存在睡眠问题的AD患者应该仔细评估其睡眠障碍并进行足够的治疗。
2 睡眠障碍对AD患者的影响
睡眠障碍是排在瘙痒之后影响AD患者生活质量的第二大因素[12]。相比于其他慢性皮肤病如银屑病、荨麻疹、痤疮和其他慢性疾病如肾病、哮喘、囊性纤维化、癫痫和糖尿病等,儿童AD患者生活质量更差[33]。
家庭成员生活质量和睡眠也受到儿童AD患者的影响。在慢性疾病患儿父母中,AD患儿父母受睡眠障碍影响数量最大,约54%~86%受到影响[34]。AD患儿发病期间,父母睡眠时间平均减少0.66~2.6 h[13,35]。Lawson等[36]报道称64%的AD患儿父母由于睡眠问题感到沮丧和疲惫,63%的兄弟姐妹也会出现睡眠减少。另一项研究表明AD患儿父母睡眠障碍程度与父母焦虑(母亲:r=0.58,P=0.002;父亲:r=0.59,P=0.01)和母亲焦虑(r=0.73,P<0.001)程度相关[35]。
睡眠障碍本身即可以对儿童造成多种负面影响,包括行为问题、认知功能障碍和情绪改变的比例显著增加[37-38]。一项研究发现54%的AD患儿父母称患儿出现行为方面的问题,如在AD发作期间易怒、脾气差和伤害其他家庭成员[36]。一项包括1658名儿童的大型队列研究发现婴儿期湿疹伴睡眠障碍可以预测在10岁时的情绪(OR,2.63; 95%CI,1.20~5.76)和社交(OR, 3.03; 95%CI,1.01~9.12)问题[39]。
研究还发现当伴随睡眠问题时,AD与注意力缺乏多动症和矮小症相关[40-41]。睡眠是生长和发育必不可少的,而睡眠障碍会导致注意力难以集中和行为障碍,因此AD患者的睡眠障碍与其行为、生活质量等诸多方面具有重要关联性(图1)[40-41]。
数项研究也报道了睡眠问题对成年AD患者的重要影响。一项美国人群研究发现AD患者睡眠障碍预示着更差的整体身体状况、更多的病假天数和就诊次数[20]。成年AD患者中,伴有睡眠障碍和疲劳更容易在日常生活中面临困难,包括注意力、记忆、表演、做财务和开车灯,生活质量、心理健康和社交等也经常出现问题(图1)[16]。
3 AD患者睡眠问题的机制
AD患者睡眠障碍的发病机制复杂,目前尚不完全清楚,但是可能涉及几方面的因素[42]。多项研究发现疾病严重程度与儿童AD患者睡眠障碍相关[3,15]。瘙痒和搔抓动作可能是导致AD患儿睡眠障碍的最直接原因,因为在夜里患者会更痒。引起AD患者瘙痒的原因包括神经肽介导的血管舒张、皮肤温度改变、嗜酸性粒细胞引起的皮肤神经生长或皮肤神经生长因子的水平增高导致的感觉过敏[43-45]。有报道称IL-31(大脑来源的亲神经因子)和P物质也在AD患者瘙痒中起作用[1,46]。然而,关于AD患者瘙痒或促瘙痒因子与睡眠障碍之间关系的研究或者缺乏,或者结果相互矛盾[42]。报道称仅仅15%的AD患儿夜间觉醒是由于瘙痒引起的[22]。因此瘙痒和搔抓动作是瘙痒的促进因子,但可能不是导致AD患者睡眠障碍的唯一因素。
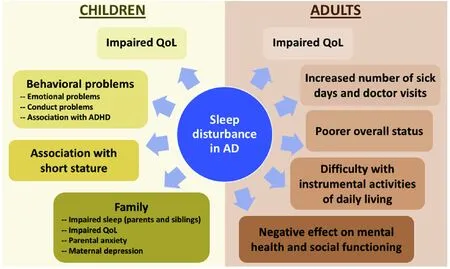
图 1 睡眠障碍对AD患者的影响
生物钟调节免疫功能和细胞因子产生、皮质醇分泌和皮肤生理状态,这些机制可能在AD患者睡眠障碍中发挥作用。多种免疫细胞数量、功能和细胞因子水平呈现昼夜节律变化[42]。促炎因子(例如IL-1β、IL-2、TNF-α、IFN-γ和IL-6)水平在夜间增加,整体上讲有助于睡眠;而抗炎因子(例如IL-4和IL-10)在清醒后产生,有可能抑制睡眠[47-48]。
AD发病机制复杂。AD急性皮损以Th2和Th22应答为主,IL-4和IL-13发挥主要作用,同时伴随IL-5、IL-31、CCL18和IL-22水平升高。Th17相关分子(例如IL-17A、弹力蛋白抑制酶3和CCL20)在AD急性和慢性患者中均上调。AD慢性皮损以Th2和Th22应答为主,同时可以伴随Th1轴活化(IFN-γ,CXCL9和CXCL10水平上调)[49]。组胺、胸腺基质淋巴细胞生成素、IL-33、IL-31、IL-4、IL-13被认为是AD患者瘙痒的重要介质[50]。血清IL-31、CCL17、CCL22和CCL27水平被发现与AD疾病活动期有关[49]。
因为多种细胞因子和趋化因子参与了AD发病,细胞因子水平(例如IL-4)失调可能导致睡眠障碍[42,51]。然而,关于细胞因子水平或免疫细胞活动与AD患者睡眠的直接关系方面的研究很少。Bender等[52]报道了抗-CD3刺激PBMCs所产生的IL-6在早、晚的不同程度增加与AD患者睡眠效率有关。Hon等[27]发现睡眠期间手腕活动与黏膜T细胞诱导因子、胸腺和活化相关趋化因子及巨噬细胞来源趋化因子相关,而与主观瘙痒和睡眠无关。我们发现在AD患儿中,早晨血清高IL-4水平与睡眠效率有关,睡眠效率低的患儿IFN-γ/IL-4比例偏低。我们还发现早晨IL-31水平与N1阶段睡眠比例偏低有关[15]。
皮肤细胞表达生物钟基因,例如昼夜运动节律输出周期中断(CLOCK)和大脑和肌肉芳烃受体和转录样因子1(BMAL1),和皮肤屏障功能通过昼夜节律受到调节。皮肤血流量在中午和傍晚最高,第二高峰出现在夜晚睡觉之前[53]。AD患者夜间瘙痒可能由于晚上油脂产生减少和表皮水分丢失加快造成的[54-55]。晚上入睡后皮质醇水平低可能导致夜间瘙痒增加[54]。然而,目前缺乏皮质醇水平或昼夜皮肤生理状态与AD患者睡眠障碍关系的直接研究,还需进一步评估。
褪黑素是调节睡眠和昼夜节律不可或缺的一种激素。它主要由松果体分泌,其他组织也会有分泌,例如皮肤、淋巴细胞和肥大细胞[56]。褪黑素具有影响睡眠、免疫调节和抗氧化能力,因此它可能在AD患者中发挥作用[57]。Schwarz等[58]报道AD患者褪黑素昼夜节律减弱。我们团队发现AD患者夜间褪黑素分泌高于健康对照,在AD患者中,夜间高褪黑素与睡眠效率更高、睡眠碎片化更低和症状更轻有关[15]。在一项随机双盲安慰剂对照试验中,我们团队发现AD患儿在睡前连续口服褪黑素3 mg 4周缩短入睡时间21.4 min(95%CI,-38.6~-4.2;P=0.02)。同时褪黑素可以减轻AD严重程度,相比于安慰剂组SCORAD评分下降9.1(95%CI,-13.7~-4.6;P<0.001)。但SCORAD评分改善和入睡时间改变并没有相关性[59]。这些研究提示褪黑素除了促进睡眠,还能通过免疫调节或抗氧化来调节AD。
有少数几项研究分析了AD患者睡眠障碍和环境因素之间的关系。我们团队发现AD患儿的睡眠障碍和血清尘螨(屋尘螨和粉尘螨)sIgE水平相关,包括睡眠效率降低、睡眠期间觉醒次数增多和睡眠碎片化加重[15]。睡眠期间的过敏原暴露将导致AD患者睡眠困难。其他过敏原和睡眠环境的影响还有待进一步研究。
研究表明,即使AD处于临床缓解期,睡眠障碍如睡眠碎片化和频繁觉醒也会持续存在[22]。这可能是由于AD患者在发作期因为睡眠障碍养成了较差睡眠习惯,导致了病情缓解的时候仍然会有行为相关睡眠问题。AD患儿常与父母同睡,同睡是健康儿童夜间觉醒的预测指标[60],目前尚不清楚它是否进一步导致AD患儿睡眠障碍。因为皮肤问题,父母可能对孩子的就寝时间更加宽容或者孩子对就寝时间有抵触情绪,这样就会增加失眠的风险。
4 睡眠问题加重AD症状吗?
搔抓导致组织损伤和结构蛋白释放,从而介导IgE应答,进一步导致痒-挠循环而加重AD[1]。研究发现AD患者主要在睡眠N1期出现搔抓,但是在N2和N3期(这个时期健康人群很少有肢体动作)并未减弱[15,52]。相比于白天,晚上患者很难有意识地去控制搔抓,频繁的夜间觉醒也可能增加夜间搔抓的意识,从而导致更多搔抓。临床上,父母经常称很难控制孩子夜间搔抓,在不好的睡眠质量和搔抓后更容易AD发作。这可能由于睡眠障碍自身加重AD患者痒-挠循环。
睡眠和生物钟与免疫功能有密切的关系。许多研究发现睡眠缺失可能导致免疫系统失调。对LPS的免疫应答、对微生物的易感性和疫苗接种会根据刺激的时间而改变,这些都会因为睡眠障碍而受到影响[61-62]。研究发现急性睡眠剥夺会导致IL-1β、IL-6和TNF-α水平上升,慢性部分睡眠剥夺会导致IL-1β、IL-6、IL-17和高反应性C反应蛋白水平升高[63]。一项基于银屑病动物模型的研究发现,睡眠剥夺会导致促炎因子(例如IL-1β、IL-6、IL-12)水平升高而抗炎因子IL-10水平降低;恢复睡眠48 h后这些因子水平恢复正常[64]。炎性疾病(如炎性肠病)的细胞因子水平也因为睡眠障碍而出现波动,提示睡眠障碍和炎症之间“鸡生蛋”的关系[65]。
睡眠剥夺同样可以破坏调节性T细胞的节律功能[42,66],使Th1/Th2平衡向Th2倾斜[67]。我们团队发现AD患儿中,睡眠效率较差的患儿IFN-γ/IL-4比率更低[15]。这和睡眠缺失导致Th1/Th2平衡改变的理论一致,提示睡眠缺失更可能加重AD。
研究表明压力会加重AD这类炎症性疾病,其可能机制是Th2细胞转换异常和下丘脑-垂体对压力刺激应答的减弱。皮肤细胞同样可以在压力刺激下产生促肾上腺皮质激素释放激素,从而导致局部炎症反应和肥大细胞脱颗粒[68]。AD患者慢性睡眠障碍可能由于慢性压力导致,从而进一步加重AD。
综上所述,有充分的理由相信睡眠障碍本身即可加重AD,AD和睡眠障碍间有双向通道互相影响,但是目前缺乏明确证据。需要进一步研究证实是否AD患者睡眠障碍加重痒-挠循环、造成免疫失调或压力,从而导致AD患者症状进一步加重(图2)。
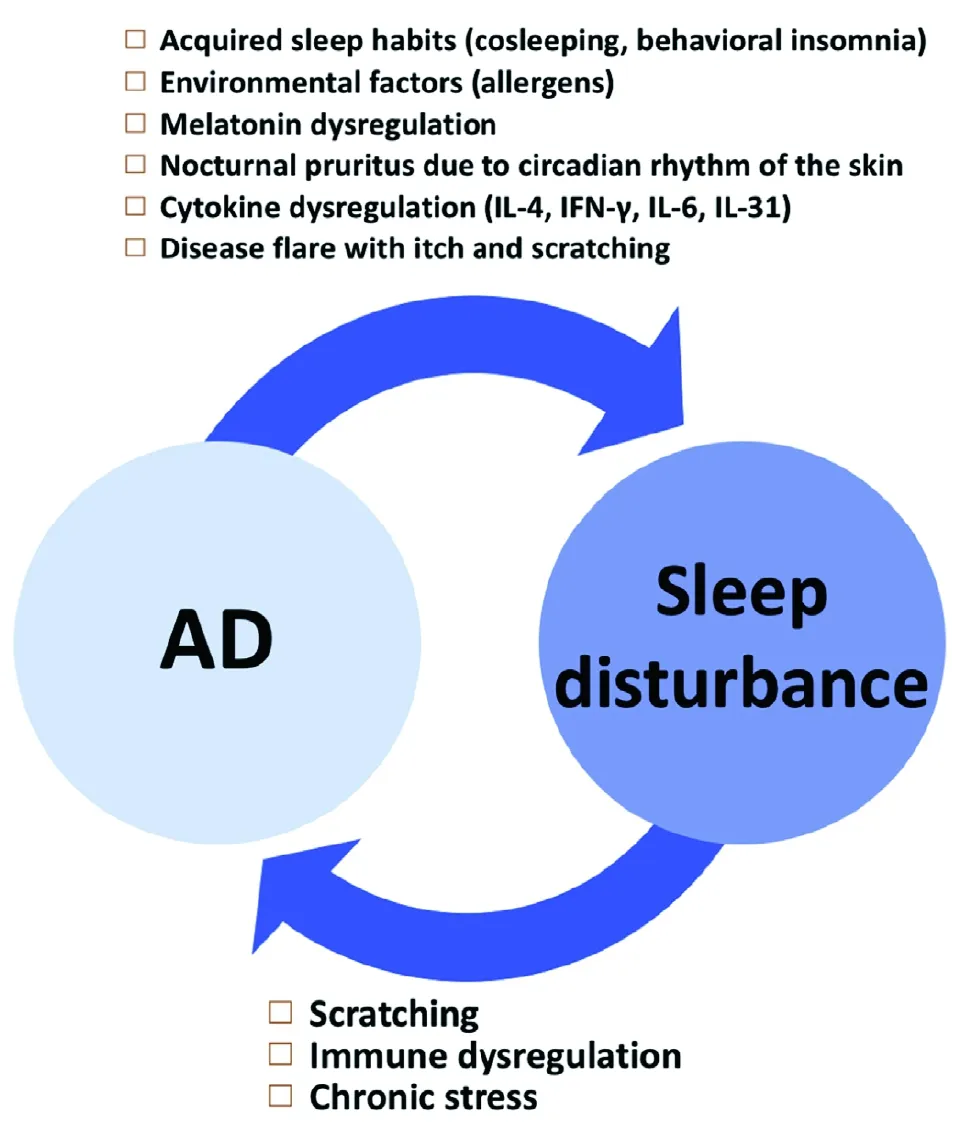
图 2 睡眠障碍和AD的双向关系AD患者睡眠障碍的机制复杂并涉及多个影响因子;睡眠障碍自身也能加重AD,形成恶性循环
5 AD患者睡眠障碍的治疗
目前并没有针对AD患者睡眠障碍治疗的指南,大多治疗方法依据专家意见[69]。AD指南建议AD治疗需要关注对病情的控制,而睡眠障碍作为控制病情的指标之一[70]。目前评估治疗对AD患者睡眠影响的临床试验也大多是针对病情控制药物的试验,这些试验往往将睡眠作为次要指标。这些实验包括局部激素、他克莫司、环孢霉素、甲氨喋呤、咪唑硫嘌呤、湿包裹、光疗和Dupilumab单抗的使用,均利用主观视觉模拟量表进行睡眠质量评价[69-71]。从目前已有证据来看,AD疾病严重程度与睡眠障碍有关,瘙痒和搔抓是重要因素。因此有效控制疾病有助于治疗AD患者睡眠问题。然而,随着对AD和睡眠障碍相互关系的不断了解,我们建议治疗方案应该同时围绕病情控制和睡眠(图3)。
通常用于AD睡眠问题治疗的是第一代抗组胺药,它可以透过血脑屏障并影响组胺在维持中枢神经系统兴奋中的作用,从而达到镇静效果,同时通过抑制肥大细胞和嗜碱性粒细胞释放组胺来抑制瘙痒,然而,抗组胺药在减轻AD患者痒症状方面缺少高等级循证医学证据[68,72]。在抗组胺药4~7 d治疗后经常出现耐药性,并且会出现抗胆碱能副作用(例如视力模糊和嘴干)[73]。镇静类抗组胺药还会影响睡眠质量、减少REM睡眠和损害白天认知能力和工作效率[72]。
其他促进AD睡眠的药物(例如苯二氮平类、水合氯醛和可乐定)均缺乏支持证据[70,74]。苯二氮平类有耐受镇静、停药后睡眠障碍复发并加重、上瘾和记忆障碍的副作用[74]。水合氯醛会导致肝中毒和呼吸抑制[70]。可乐定使用需要检测血压并有抗胆碱能副作用,同时还会抑制REM睡眠,而快速停药会导致REM反弹[68]。
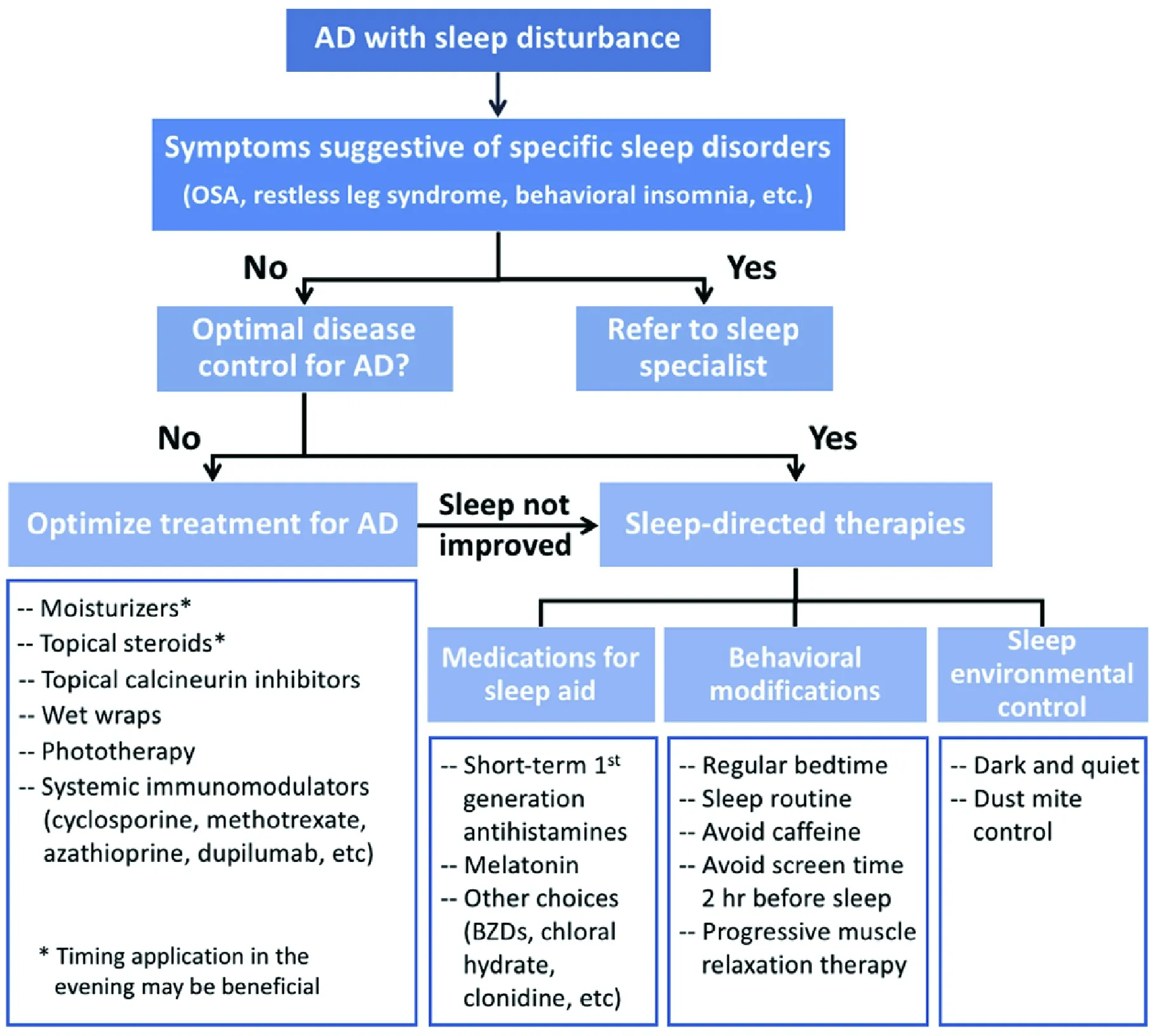
图 3 AD患者睡眠障碍治疗策略
伴有睡眠障碍的AD患者首先应该筛查是由存在睡眠问题; 因为睡眠障碍和AD之间存在相互影响,治疗应同时考虑疾病控制和改善睡眠; BZDs:苯二氮平类药物。
在一项随机对照研究中发现口服褪黑素可以提高AD患儿入睡时间和减轻疾病严重程度[59]。同时褪黑素安全性好,对患儿是个不错的选择。然而最佳剂量和疗程有待进一步研究。
应该强调提高睡眠卫生和睡眠指导行为治疗的重要性,这样可以改善睡眠和预防获得性行为失眠症,而失眠可能在疾病控制后持续存在。提升睡眠卫生的一般方法包括坚持规律作息、制定一个宽松的就寝计划、保持一个安静的就寝环境和避免喝咖啡[69]。鉴于昼夜节律对AD的影响,晚上使用保湿霜和局部外用激素是有益处的,因为夜间局部激素对表皮水分流失和皮肤血液流动影响较大[42]。保湿霜和局部药物的使用也应该是就寝计划的一部分。光线,尤其是蓝光可以抑制褪黑素分泌,因此睡前2 h禁止看屏幕和保持黑暗睡眠环境极其重要[42]。
尘螨过敏可能也影响AD患者出现睡眠障碍[15],因此建议控制睡眠环境的尘螨浓度。研究表明渐进式肌肉松弛疗法(这个循环过程包括对目标肌肉群施加10 s的压力,然后放松20 s)同样有助于AD患者减少瘙痒、睡眠丢失和焦虑,可以在较大儿童和成人中使用[75]。
如果行为性失眠出现,建议向心理学家或睡眠医学专家咨询进行行为纠正,例如消退、逐渐消退、预定唤醒、减少就寝时间和反应代价法[69]。目前正念冥想常用于改善成人和青少年失眠症[76-77],可能对治疗银屑病或其他皮肤疾病有益处[78-80]。正念冥想是否对AD睡眠障碍有效还需进一步探索。
筛查与AD相关的特定睡眠障碍也很重要。打鼾频率、睡眠呼吸暂停或抑制、张口呼吸和非正常睡眠体位(例如靠在枕头上或颈部过度伸展)可能导致OSA。由于休息和躺在床上导致的下肢不适伴随无法抗拒的运动冲动加剧和运动后部分缓解可能引起不宁腿综合征[81],如果症状提示有特殊的睡眠障碍,建议转诊睡眠专家进一步评估和治疗(图3)。
结语
睡眠障碍在AD患者中非常常见并影响极大,睡眠障碍和AD像双向车道,互相影响并形成恶性循环。我们建议不只是把睡眠障碍看作是AD症状之一或者评估疾病严重程度的指标,而应当将其视为AD的并发症,并且需要定期评价,应将对睡眠障碍的具体治疗纳入治疗方案中。
参考文献请见原文:
J Allergy Clini Immunol, 2018,142: 1033-1040
