维生素D3对仿刺参幼参生长、体组成及抗氧化能力的影响*
2019-01-17王丽丽李宝山王际英孙永智韩秀杰王雅平郝甜甜王世信
王丽丽 李宝山 王际英① 孙永智 韩秀杰 王雅平 郝甜甜 王世信
(1.上海海洋大学水产与生命学院 水产科学国家级实验教学示范中心 农业农村部鱼类营养与环境生态研究中心水产动物遗传育种中心上海市协同创新中心 上海 201306;2.山东省海洋资源与环境研究院山东省海洋生态修复重点实验室 烟台 264006)
维生素 D3为脂溶性类固醇衍生物,是水生动物 生长所必需的营养素(黎德兵等, 2015)。水生动物自身不能合成或者合成量不能满足机体的需要,必需从食物中获取足量的维生素 D3来满足机体生理生化功能的需要(彭翔等, 2010; Yaniket al, 2016)。已有研究表明,维生素D3能够促进肠道黏膜上皮细胞Ca结合蛋白的形成,促进 Ca、P的吸收,调节体内 Ca、P平衡(李爱杰, 1996)。此外,维生素D3还参与协调提高机体的免疫(付京花等, 2006)及抗氧化能力(Martínez-Álvarezet al, 2005)。目前,有关水生动物对维生素 D3最适需求量的研究主要集中在鲤鱼(Cyprinus carpio)(张桐等, 2011),黄颡鱼(Pelteobagrus fulvidraco) (段鸣鸣等, 2014),鲈鱼(Lateolabrax japonicus)(张璐等, 2016),草鱼(Ctenopharyngodon idellus)(蒋明等, 2009)等鱼类,有关仿刺参(Apostichopus japonicus)幼参对维生素D3的最适需求量未见报道。
仿刺参具有较高保健功效及经济价值,是我国渤海和黄海水域的重要海水养殖种类(张德瑞等, 2016)。目前,维生素在仿刺参饲料中的应用研究较少,仅见维生素C(Luoet al, 2014)和维生素E(汪将, 2014)对仿刺参生长和免疫特性影响的研究。因此,本研究通过在饲料中添加不同水平的维生素D3,研究其对仿刺参幼参生长、消化酶活力及免疫能力的影响,以期为仿刺参对饲料中维生素D3的需求量提供参考。
1 材料与方法
1.1 实验设计与饲料制备
实验分为6个处理组,每个处理组3个重复,每个重复30头仿刺参[(15.43±0.14) g]。实验所用维生素D3含量为500000 IU/g(浙江新维普添加剂有限公司)。以鱼粉和发酵豆粕为蛋白源,鱼油和大豆卵磷脂为脂肪源,配制粗蛋白含量为22%,粗脂肪含量为4%的基础饲料,在基础饲料中分别添加0、250、500、1000、2000、3000 IU/kg的维生素D3,配制成6种实验饲料,命名为 D1、D2、D3、D4、D5、D6。固体原料超微粉碎过200目标准筛,按配比称重,加入新鲜鱼油及适量的蒸馏水混匀,用小型颗粒饲料挤压机制成直径为0.3 cm、厚度为0.05 cm的片状饲料,60℃烘干备用。实验饲料配方及营养组成见表1。
1.2 实验用参及实验管理
养殖实验在山东省海洋资源与环境研究院东营实验基地循环水养殖系统中进行,实验用仿刺参幼参购自山东蓬莱安源水产有限公司。挑选大小均匀、健康无病的仿刺参于养殖系统中暂养15 d,期间投喂基础饲料。待其完全适应饲养条件后,随机分为6个处理组,每个处理组3个重复,每个重复30头仿刺参,平均体重为(15.43±0.14) g,随机放养于18个圆柱形养殖桶(70 cm×80 cm)中,控制水深为60 cm,实验周期为56 d。每桶放海参养殖筐2个,内嵌波纹板20张,每隔30 d更换养殖筐 1次。养殖期间,控制水温为17~19℃,水流速为 2 L/min,盐度为 26~28,pH为7.6~8.2,溶解氧>5.0 mg/L,氨氮(NH4-N)和亚硝酸盐(NaNO2)<0.05 mg/L。每天 08:00 换水,换水量为 1/3,每天 16:00投饵1次,初始投喂量占体重的 2%,每天观察仿刺参的摄食情况及时调整投喂量,并记录水温及死亡情况。每3 d吸底1次,用虹吸法将残饵及粪便吸出,养殖实验在弱光环境下进行。
1.3 样品采集与处理
养殖实验结束后,控食48 h,统计各桶仿刺参的数量并称重,用于存活率(Survival rate, SR, %)、增重率(Weight gain rate, WGR, %)、特定生长率(Specific growth rate, SGR, %/d)及肠体比(Ratio of intestine weight to body weight, IWR, %)的计算。每桶随机取8头置于洁净的泡沫板上,用滤纸轻轻将仿刺参体表的水分吸干后分别称重。去除体腔液后,置冰盘上分离肠道和体壁。肠道去除内容物,用定性滤纸擦净后分别称重,将肠道样品和体壁放在-20℃条件下冷冻保存,待测。
1.4 测定指标与方法
1.4.1 生长指标
WGR =(Wt-W0)×100/W0;
SGR =(lnWt-lnW0)×100/d;
SR=(实验末参数/实验初参数)×100;
IWR=(Wi/Wt)×100。
式中,W0为实验初仿刺参体重,Wt为实验末仿刺参体重,d为实验天数,Wi为实验末仿刺参肠道重量。
1.4.2 饲料及体壁基本营养成分的测定 饲料及体壁水分采用105℃烘干至恒重法(GB/T6435-2014);粗蛋白采用凯氏定氮法(GB/T6432-2006);粗脂肪采用索氏抽提法(GB/T6433-2006);粗灰分采用 550℃马弗炉灼烧法(GB/T6438-2007);Ca采用乙二胺四乙酸二钠络合滴定法(GB/T6436-2002)、总磷采用分光光度法(GB/T6437-2002)。饲料能量采用燃烧法(IKA,C6000, 德国);饲料维生素D3在通标标准技术(青岛)有限公司采用高效液相色谱法-皂化提取法(GB/T 17818-2010)测定。测定步骤:称取样品进行皂化,将皂化液转移到分液漏斗中进行提取,最后将提取液进行蒸干浓缩,加入甲醇溶解,进行过滤,得到待测液,用高效液相色谱仪(Agilent 1200, 美国)检测;体壁 Mg、Fe、Mn采用浓硝酸微波消解后用电感耦合等离子体质谱仪(Agilent 7700, 美国)测定;体壁羟脯氨酸采用南京建成生物工程研究所试剂盒进行测定;体壁维生素 D3含量采用上海酶联生物科技有限公司ELISA试剂盒测定,具体测定步骤参照试剂盒说明书。

表1 实验饲料配方及营养成分(干物质%)Tab.1 Formulation and proximate composition of experimental diets (Dry matter %)
1.4.3 抗氧化酶活力的测定 取肠道样品,剪碎,加入9倍体积冰冷的生理盐水(0.9%),制成10%的匀浆,在4℃条件下,8000 r/min离心10 min,取出上清液,分装于 2 ml的离心管中,保存于-80℃冰箱,待测。
碱性磷酸酶(Alkaline phosphatase, AKP)、总超氧化物歧化酶(Total superoxide dismutase, T-SOD)、过氧化氢酶(Catalase, CAT)、丙二醛(Malondialdehyde, MDA)以及总抗氧化能力(Total antioxidant capacity, T-AOC)均采用南京建成生物工程研究所试剂盒测定,碱性磷酸酶活力单位转化为国际单位,其他酶活定义及具体测定步骤参照试剂盒说明书。
1.5 数据统计分析
采用 SPSS 17.0软件进行单因素方差分析(Oneway ANOVA),当处理之间差异显著(P<0.05)时,用Duncan’s检验进行多重比较分析。统计数据以平均值±标准误(Mean±SE)表示。
2 结果与分析
2.1 维生素D3对仿刺参幼参生长性能的影响
饲料维生素D3对仿刺参的SR无显著影响(P>0.05),随着饲料维生素D3含量的增加,WGR及SGR呈先上升后下降的趋势,均在D4组达到最高值,D1组显著低于其他组(P<0.05)。D3、D4、D5 组 IWR显著高于其他 3组(P<0.05),但 3组之间差异不显著(P>0.05)(表 2)。
以WGR为评价指标,经一元二次回归分析得出,初始体重为15.43 g的仿刺参对饲料中维生素D3的最适需求量为1587.5 IU/kg(图1)。

图1 维生素D3水平与仿刺参增重率的相关性分析Fig.1 Relationship between dietary vitamin D3 level and weight gain rate (WGR) of A.japonicus
2.2 维生素D3对仿刺参幼参体组成的影响
饲料维生素 D3显著影响了仿刺参体壁粗灰分、Ca、P、Mg、Fe及羟脯氨酸含量(P<0.05),但对水分、粗蛋白、粗脂肪及 Mn含量影响不显著(P>0.05)。随着饲料维生素 D3含量的增加,粗灰分含量呈上升趋势,D3、D4、D5组无显著性差异(P>0.05),D1、D2、D6组显著低于D4、D5组(P<0.05),与D3组无显著性差异(P>0.05);羟脯氨酸含量呈先降后升的趋势,D4组达到最低值,D1、D6组无显著性差异,显著高于其他4组(P<0.05);仿刺参体壁维生素D3沉积量与羟脯氨酸呈相同趋势,但 D4组显著高于其他组(P<0.05),D4、D5、D6 组显著高于 D1、D2 组(P<0.05),D5、D6组与D3组间无显著性差异(P>0.05)(表3)。
饲料维生素D3显著提高了仿刺参体壁Ca含量,各组显著高于D1组(P<0.05);随着饲料维生素D3含量的增加,P含量呈先上升后平稳的趋势,D1、D2组无显著性差异(P>0.05),D4、D5、D6组显著高于D1、D2 组(P<0.05),且 3组间无显著性差异(P>0.05),D3组显著高于D1组(P<0.05),与其他4组间无显著性差异(P>0.05);Mg含量呈上升趋势,D1组显著低于其他组(P<0.05);Fe含量呈先升后降趋势,D5、D6组显著低于其他组(P<0.05),D5、D6组间无显著性差异(P>0.05);Mn含量呈下降趋势,但各组间差异不显著(P>0.05)(表4)。
2.3 维生素D3对仿刺参幼参肠道抗氧化酶活力的影响
随着饲料维生素 D3含量的增加,仿刺参肠道AKP及T-SOD活力均呈先上升后下降的趋势,AKP活力在 D4组达到最高值,D1组显著低于其他各组(P<0.05);D1、D6组T-SOD活力显著低于其他各组(P<0.05),D1、D6组间无显著性差异(P>0.05),D5组达到最高值。MDA含量随着饲料维生素D3含量的增加呈下降趋势;CAT活力及T-AOC受饲料维生素D3含量的影响不显著(P>0.05)(表5)。

表2 饲料维生素D3对仿刺参幼参生长性能及形体指标的影响Tab.2 Effects of dietary vitamin D3 on growth performance and physical indices of juvenile sea cucumber A.japonicus
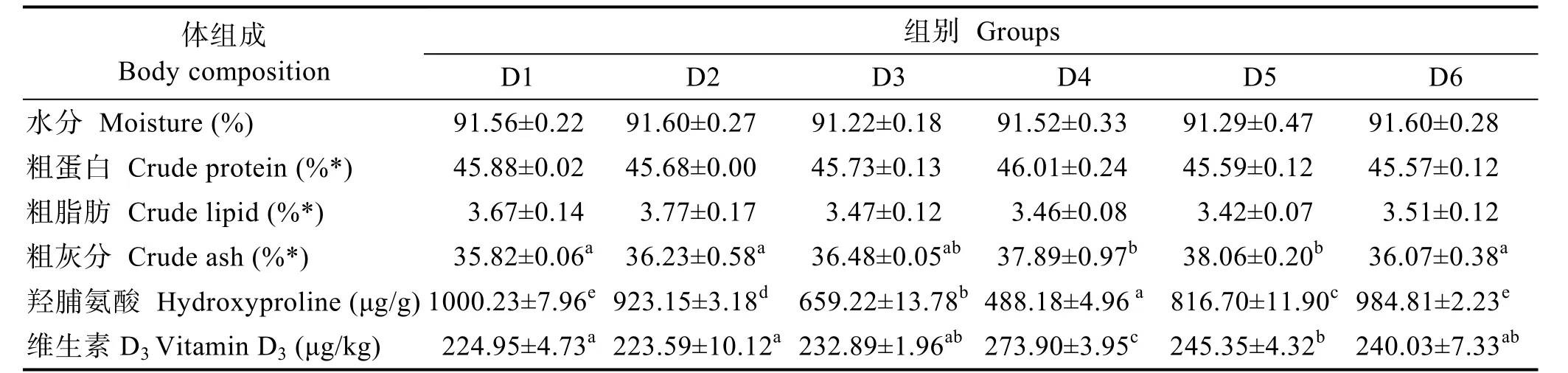
表3 饲料维生素D3对仿刺参幼参体壁基本成分的影响Tab.3 Effects of dietary vitamin D3 on body wall composition of juvenile sea cucumber A.japonicus

表4 饲料维生素D3对仿刺参体壁矿物元素含量的影响Tab.4 Effects of dietary vitamin D3 on mineral contents of the body wall of A.japonicus

表5 饲料维生素D3对仿刺参肠道抗氧化酶活力的影响Tab.5 Effects of dietary vitamin D3 on antioxidant enzyme activities of intestine of juvenile sea cucumber A. japonicus
3 讨论
3.1 饲料中添加维生素D3对仿刺参幼参生长性能的影响
关于维生素 D3促进动物生长的研究报道已有很多,维生素 D3可从激素、细胞及分子水平上影响动物的生长和 Ca结合蛋白的形成(Maalouf, 2008),适量添加可促进动物生长,但过量添加会抑制动物的生长,甚至产生毒性。本研究中,随着饲料中维生素D3含量的增加,各组仿刺参 SR没有显著性差异,WGR和SGR呈先升后降的趋势,D4组达到最高值,当饲料维生素D3含量为3000 IU/kg时,仿刺参WGR和SGR明显下降,与在中华绒螯蟹(Eriocheir sinensis)(孙新瑾, 2009)、凡纳滨对虾(Penaeus monodon)(Heet al, 1992)、皱纹盘鲍(Haliotis discus hannai) (周歧存等, 2004)研究结果一致。仿刺参体腔液中Ca含量比较丰富,适量的维生素 D3能够促进甲状腺激素的分泌,进而提高仿刺参的生长速度(张璐等, 2016);而高水平的维生素D3对维生素A和维生素E的吸收有拮抗作用,这在一定程度上会降低动物的生长速度(陈娟等, 2010)。随着饲料维生素D3含量的增加,仿刺参的IWR呈先升后降趋势,说明适量的维生素D3能够促进肠道的发育,提高仿刺参的生长性能。以WGR为评价指标时,经一元二次回归分析得出,仿刺参幼参对维生素D3的最适需求量为1587.5 IU/kg。
3.2 饲料中添加维生素D3对仿刺参幼参体成分的影响
养殖动物的体成分随配合饲料组成的不同而发生变化,包括粗蛋白、粗脂肪、水分、粗灰分等。本研究中,仿刺参体壁水分含量不受饲料维生素 D3含量的影响,这与蒋明等(2009)对草鱼的研究结果一致,表明不同含量的维生素 D3对仿刺参体壁干物质的积累程度无显著影响;仿刺参的生长性能及体壁粗蛋白含量与饲料蛋白水平有关(王庆吉等, 2014; 赵斌等,2016),而本研究各组仿刺参体壁粗蛋白含量差异不显著,表明当饲料中蛋白质含量一致时,体壁粗蛋白含量并不能真实的反映仿刺参的生长情况。随着维生素 D3含量的增加,各组仿刺参体壁粗脂肪含量无显著性差异,这与虹鳟(Oncorhynchus mykiss) (Barnettet al, 1982)及皱纹盘鲍(周歧存等, 2004)的研究结果不一致,仿刺参自身对脂肪的需求量与鱼类相比较低,因此维生素 D3对仿刺参的脂肪代谢可能影响不大。羟脯氨酸是胶原蛋白的主要成分之一,是反映胶原蛋白数量的常见指标。本研究中,随着饲料维生素D3含量的增加,仿刺参体壁中羟脯氨酸含量呈先降后升的趋势,D4组为最低值。骨骼的主要成分为骨盐(钙盐和磷酸盐)和有机基质(I型胶原),从仿刺参体壁中提取的胶原蛋白氨基酸组成与I型胶原蛋白的氨基酸组成相似(崔凤霞等, 2006),当摄食饲料中维生素 D3缺乏和过多时,会导致仿刺参体壁骨盐减少、I型胶原含量上升,从而使体壁中羟脯氨酸含量升高;仿刺参体壁中维生素D3的沉积量随着饲料维生素D3含量的增加呈先升后降的趋势,说明维生素 D3在促进动物生长的同时增加了自身在机体内的沉积量。
维生素D3对骨骼矿化以及Ca、P的沉积作用是浓度依赖型,在适宜浓度范围内,维生素 D3含量的增加能够促进骨骼矿化和Ca、P沉积,过高或过低均会导致骨骼矿化异常。本研究发现,饲料维生素 D3含量显著影响了仿刺参体壁粗灰分及Ca、P含量,当含量为 1000、2000 IU/kg时,仿刺参体壁粗灰分、Ca、P含量显著高于D1组,添加量为3000 IU/kg时,粗灰分及Ca含量呈下降趋势,但P含量趋于稳定。仿刺参生活在含Ca丰富的海水中,可以从海水中吸收Ca满足机体的生理代谢需要。饲料中适量的维生素D3能够促进矿物质在体壁中的积累,粗灰分及Ca含量上升;但过量的补充维生素 D3则抑制矿物质沉积(Graffet al, 2015),粗灰分及Ca含量下降;而海水中P含量较低,体壁中的P主要来源于饲料,因此,饲料维生素D3含量过高时,同样能够促进P的吸收;Mg在细胞代谢及骨骼发育过程中起着重要的作用,在体内,Mg与 Ca的代谢密切相关,本研究仿刺参体壁 Mg含量随饲料维生素 D3含量的增加而增加,D1组显著低于其他组,Ca与Mg结构相似,在一定范围内,维生素D3能够促进Mg的吸收。Fe是各种动物必需的矿物元素,是动物营养中最重要的微量元素之一,是生物机体生长发育不可缺少的条件(张佳明, 2007),随着维生素D3含量的增加,仿刺参体壁Fe含量呈先升后降趋势,说明机体在维生素D3促进Fe2+吸收的同时受其他阳离子的影响。Mn是骨正常形成所必需的元素,机体对Mn的吸收利用受很多因素的影响(王秋梅, 2007),本研究随着维生素D3含量的增加,各组仿刺参体壁Mn含量无显著性差异,表明机体对 Mn的吸收不受维生素 D3含量的影响,与在肉鸡上的研究结果不一致(张淑云等, 2010),可能与养殖对象的种类有关。
3.3 饲料中添加维生素D3对仿刺参幼参肠道抗氧化酶活力的影响
仿刺参缺乏特异性的免疫系统,只有体壁和体内防御机制共同组成的非特异性免疫体系(白阳等,2016)。仿刺参体内的免疫主要分为细胞免疫和体液免疫,二者之间密切相关,相辅相成。仿刺参肠道免疫及抗氧化酶活力的高低可以间接地反应机体的健康状况(常杰等, 2011)。
碱性磷酸酶(AKP)是一种含 Zn对底物专一性较低的磷酸单脂水解酶,在体内直接参与磷酸基团的转移和代谢,与机体的Ca、P代谢有关(Haussleret al,1970; Normanet al, 1970)。本研究中,随着饲料维生素D3含量的增加,仿刺参肠道AKP活力呈先上升后下降的趋势,D4组达到最高值,与斑节对虾(Penaeus monodon)研究结果一致(Shiauet al, 1994)。AKP存在于骨、肠道等组织中,在生理剂量范围内,维生素D3促进了肠道对Ca、P的吸收,AKP活力上升,当维生素D3含量过高时,抑制了肠道对Ca、P的吸收,AKP活力下降。实验结果显示,维生素 D3与 AKP活力存在良好的相关性。
抗氧化物酶系统被认为是免疫系统的一部分,是细胞抵御氧化损伤的主要武器。总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和总抗氧化能力(T-AOC)等组成的抗氧化酶系统可以清除过多的自由基,保护机体免受活性氧基团(ROS)的损伤。T-SOD和 CAT活力的高低间接地反应了机体清除氧自由基的能力。本研究中,随着饲料维生素D3含量的增加,肠道T-SOD活力呈先上升后下降的趋势,并在D5组达到最高值,表明维生素D3对T-SOD的生成有较强的诱导能力,增强机体的抗氧化能力。CAT具有重要的生理功能,在细胞内与产生 H2O2的需氧脱氢酶类同时存在,可以催化H2O2分解为H2O和O2,和SOD协同完成细胞内的抗氧化作用。本研究仿刺参肠道CAT活力受饲料中维生素D3含量影响不显著,这与在黄颡鱼(段鸣鸣等, 2014)的研究结果不一致,仿刺参是无脊椎动物,缺少脊椎动物所具有的特异性免疫器官,与SOD相比,较高含量的维生素D3才能最大限度地提高CAT活力。总抗氧化能力(T-AOC)可以反映机体的抗应激能力(Rengpipatet al, 2000),随着维生素D3含量的增加,各实验组肠道T-AOC无显著性差异,而张淑云等(2010)研究发现,随饲粮维生素D3含量的增加,肉鸡血清和肝脏中T-AOC呈上升趋势,与本研究结果不一致,这与动物种类及实验条件不同有关(Mourenteet al, 2002)。丙二醛(MDA)是脂质过氧化反应链式终止阶段产生的小分子产物,其含量可以间接反映自由基的产生情况和机体组织细胞的脂质过氧化程度(Onderciet al, 2003)。本研究,随着饲料维生素 D3含量的增加,肠道中 MDA的含量呈下降趋势,添加量为3000 IU/kg时,MDA含量最低。与在肉鸡(陈娟等, 2010)和蛋雏鸭(解俊美等, 2012)上研究结果一致,说明维生素 D3在提高仿刺参抗氧化能力方面具有一定的积极作用。
4 结论
以WGR为评价指标,经一元二次线性回归分析可知,初始体重为15.43 g的仿刺参对饲料中维生素D3的最适需求量为1587.5 IU/kg。饲料中适量的添加维生素D3能够提高仿刺参的生长性能,对仿刺参体壁体组成产生一定的影响。饲料维生素D3含量对仿刺参肠道蛋白酶、淀粉酶及脂肪酶活力无显著性影响,但是适量的维生素D3能够提高机体的抗氧化能力。
