蓝藻水华暴发期间养殖池塘浮游藻类动态变化*
2019-01-17常孟阳李晨露尚向阳王佳慧牛萌萌
常孟阳 李晨露 董 静 尚向阳 王佳慧 牛萌萌
(河南师范大学水产学院 新乡 453007)
浮游藻类是水生生态系统中重要的初级生产者,其种类、数量和生物多样性的变化与水环境密切相关,并决定着水生生态系统的结构和功能,是评价水体营养程度和水质状况的重要指标之一。很多藻类还是浮游动物和鱼类的主要食物来源和开口饵料,总之,浮游藻类是水生生态系统中重要的组成部分。近年来,随着池塘养殖密度增大,饵料投放导致 N、P含量大幅度增加,养殖池塘(尤其在夏季高温)往往大范围暴发蓝藻(Cyanobacteria)水华(宋超等, 2012a, b;Hallegreff, 1993)。蓝藻水华暴发给养殖水生态系统带来了极大威胁(包括水质理化参数改变、生物群落结构变化、高等经济动物不宜生存)(李媛等, 2015; 陈小锋等, 2014; 杨桂山等, 2010; Vasconceloset al,2001)。此外,微囊藻(Microcystissp.)还会向水体释放次级代谢产物(微囊藻毒素),微囊藻毒素(Microcystins, MCs)分布广、毒性大,具有肝脏毒性和肿瘤促进作用,水体中 MCs积累到一定含量时,就会对水生生物产生毒害作用,影响水生态环境安全和水产品质量(厉威池等, 2014; 苏雅玲等, 2013; Romoet al,2012)。蓝藻水华暴发期间,水体 MCs的含量不可忽视。因此,养殖池塘水体富营养化是当前关注的热点之一。
目前,关于水华期间藻类群落结构变化的研究在湖泊、水库等大型水体报道较多,对养殖水体研究较少。而关于蓝藻水华暴发期间,集约化养殖池塘MCs含量的监测尚未报道(王超等, 2013; Papadimitriouet al, 2012; 刘峰等, 2011; 杨柳等, 2011; 陆开宏等,2008)。夏季是池塘藻类繁殖的高峰期,鱼类生长较快,水质变化较大,此时,对池塘水质进行准确评价分析具有重要意义。对于蓝藻水华暴发期间的养殖池塘进行监测,对水体改善提供一定的理论依据(乔麟等, 2017; 李恒等, 2013; 闫家国等, 2012; Illuminatiet al, 2012; 高云霓等, 2007)。
本文通过研究蓝藻暴发期间,养殖池塘理化因子和浮游藻类动态变化,可以反映蓝藻暴发池塘生态环境状况。另外,考虑到池塘水环境对水产品质量安全的影响,本研究也进行了养殖池塘水体和藻类细胞MCs含量的测定,为暴发蓝藻的养殖池塘水质和水产品质量安全提供基础数据。
1 材料与方法
1.1 养殖池塘概况
本研究在河南师范大学养殖基地池塘进行(35°19'38.363″ N, 113° 54' 09.482″ E),面积为 200 m2的水泥池,水深为1.8~2.0 m,连续多年7~9月暴发蓝藻水华,该养殖池塘为典型成鱼池,主要养殖种类为鲤(Carassius auratus)、锦鲤(Cyprinus carpio haematopterus)、鲫鱼(Carassius auratus)、草鱼(Ctenopharyngodon idellus)以及麦穗(Pseudorasbora parva)等。
1.2 藻类采集与计数
对调查池塘进行浮游藻类水样采集并分析。浮游藻类采样水深为 0.5 m,采样1 L,立即加入15 ml鲁哥氏液固定,样品带回实验室,沉淀48 h,浓缩至50 ml。采用光学显微镜,取0.1 ml样品于计数框内,显微镜下观察计数,每份样品重复 3次,每次计数50 个视野。浮游藻类鉴定及计数参考《中国淡水藻类》(胡鸿钧等, 2006)、《中国淡水生物图谱》(韩茂森等, 1995)、《湖泊富营养化调查规范》(金相灿等, 1990)等。以藻类密度>5%浮游藻类总密度定义为优势种。
1.3 水质检测
在池塘中设置固定水质采样点。每次08:00开始采样并测定。测定水温(WT),用采水器采集0.5 m水样1 L,用孔径为0.45 μm的微孔滤膜(水系混合纤维素),抽滤水样,用于测定氨氮(-N)、硝态氮(-N)、可溶性总氮(TDN)、可溶性总磷(TDP)、正磷酸盐(SRP)等因子的测定;使用原水样进行总磷(TP)和总氮(TN)的测定。水样营养盐测定方法参考《水和废水检测分析方法》第Ⅳ版(魏复盛, 2002)。
MCs测定使用微囊藻毒素ELISA检测试剂盒,购于中国科学院水生生物研究所(武汉)。取1 L水样,用真空泵经过玻璃纤维滤膜(Whatman GF/C, 英国)过滤后分为滤液和滤膜两部分,滤膜上的藻细胞用于测定胞内毒素(Intracellular MCs),滤液用于测定胞外毒素(Extracellular MCs)。每份样品重复3次,藻细胞毒素采用冻融方法提取,主要参考囊藻毒素 ELISA检测试剂盒藻细胞样品处理方法进行。
1.4 数据计算方法
本研究所分析的相关参数及计算方法如下:浮游藻类密度计算公式(赵文, 2005)如下:
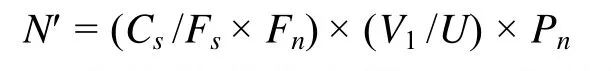
式中,N'为浮游藻类密度,Cs为计数框面积(mm2),Fn为视野数,Fs为视野面积(mm2),U为计数框体积(ml),V1为浓缩体积(ml),Pn为计数出的藻类个数。
生物量:用细胞体积法推算生物量(赵文, 2005)。
浮游藻类生物多样性:浮游藻类生物多样性采用Shannon-Wiener香农-维纳多样性指数(H')(Shannonet al, 1949)、Margalef 物种丰富度指数(dMa) (Marganefet al, 1968)、Pielou均匀度指数表示(J) (Pielouet al,1969),微囊藻优势度采用 Berger-Parker优势度指数(D)表示(潘晓洁等, 2014),其计算公式如下:
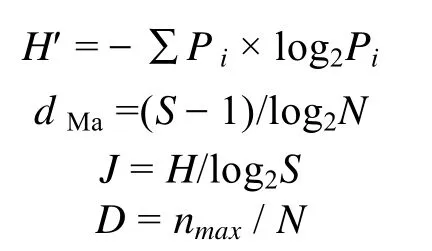
式中,N为样品中所有物种的总个体数,nmax为优势种的个体数,J为均匀度指数,S为物种数目,Pi为第i种的个体数与样品中总个体数的比值。
1.5 数据处理
数据整理和作图采用 Excel 2010软件。应用Canoco 4.5软件进行浮游植物与环境因子间的关系分析。在数据分析前进行物种数据适合的模型检测,对浮游藻类密度数据进行除趋势对应分析(Detrended correspondence analysis, DCA),根据其轴长度确定分析类型[大于4使用典范对应分析(Canonical correspondence analysis, CCA),小于 3使用冗余分析(Redundancy analysis, RDA),处于3~4二者均可]。另外,在分析过程中, 对物种变量进行lg(x+1)转换(Janet al, 2003)。
2 结果与分析
2.1 养殖池塘水体营养盐的动态变化
营养盐动态变化见图1和图2。从图1和图2可以看出,TP和TN变化不大,TP最高值出现在8月31日,为0.51 mg/L,最低值出现在8月28日,为0.32 mg/L。TN最高值出现在7月14日,为7.09 mg/L,最低值出现在8月7日,为4.18 mg/L。SRP所占比例在 7、8月上、中旬较平稳,8月下旬波动较大。-N、-N所占比例有波动,在8月中旬平均所占比例最小(图3和图4)。
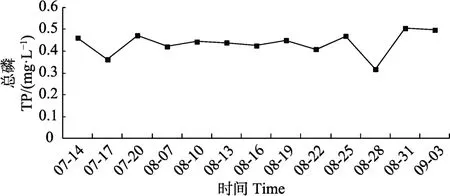
图1 养殖池塘总磷(TP)含量动态变化Fig.1 Variation of total phosphorus contents in aquaculture ponds

图2 养殖池塘总氮(TN)含量动态变化Fig.2 Variation of total nitrogen contents in aquaculture ponds
2.2 浮游藻类种类组成及分布
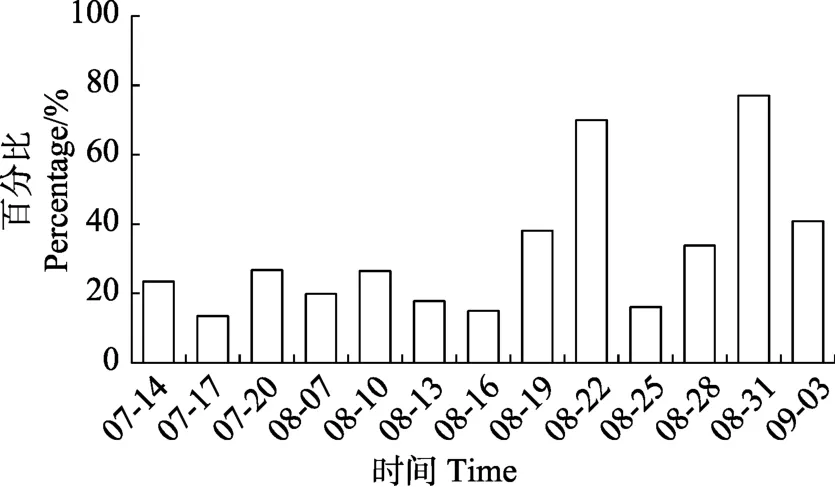
图3 养殖池塘正磷酸盐含量所占比例变化Fig.3 Variation of orthophosphate in aquaculture ponds
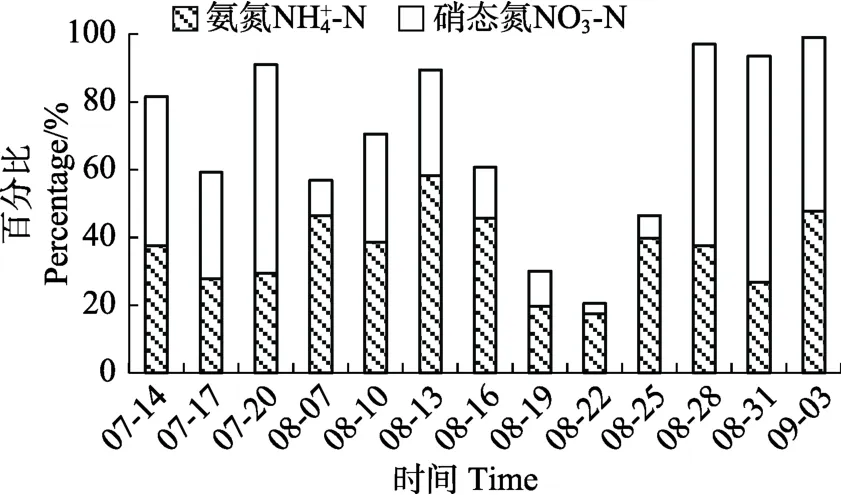
图4 养殖池塘各形态氮含量所占比例变化Fig.4 Variation of ammonia nitrogen and nitrate nitrogen in aquaculture ponds
在蓝藻暴发的 7月中旬、8月的种类组成中,7月共鉴定浮游藻类21种(属),8月共鉴定17种(属)。隶属于蓝藻门(Cyanophyta)、隐藻门(Cryptophypa)、硅藻门(Bacillariophyceae)、裸藻门(Euglenophyta)和绿藻门(Chlorophyta)(表 1)。绿藻门种类组成所占比例最大,但每种数目较少,其次是蓝藻门。7月和8月水华优势种均为微囊藻,优势度高达99%(图5)。在浮游藻类种类中有四尾栅藻(Scenedesmus quadricanda)。在调查期间,除微囊藻外数目较多,其他各藻类数量比较少,8月下旬硅藻门的小环藻(Cyclotellasp.)数目增多,蓝藻暴发期间,优势种种类单一(表2)。
2.3 浮游藻类丰度与生物量
浮游藻类丰度变化范围为(0.883~12.666)×108cells/L,最高值出现在7月20日,最低值出现在8月 28日。生物量变化范围为 9.740~70.020 mg/L,丰度和生物量出现的最高值与最低值的时间一致。生物量在7月中旬有波动,8月相对平稳,这可能与蓝藻水华暴发盛期,微囊藻在8月为优势藻种有关(图6和图7)。
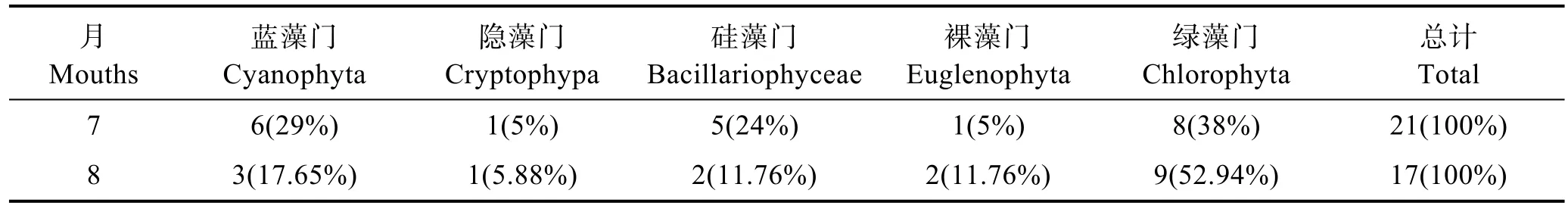
表1 养殖池塘浮游藻类种类组成Tab.1 Phytoplankton composition in aquaculture ponds

图5 养殖池塘微囊藻优势度变化Fig.5 Variation of Microcystis sp. in aquaculture ponds
2.4 浮游藻类生物多样性
从图8可以看出,浮游藻类生物多样性指数、丰富度指数、均匀度指数总体呈先下降后上升的趋势,变化范围为 0.056~1.147、0.203~0.892、0.024~0.507。在8月中旬,生物多样性最低,各门藻类生物多样性也最低,从8月下旬开始,生物多样性开始上升。在7月中旬,绿藻门生物多样性最高,其次是蓝藻门,8月中旬,各门藻类生物多样性最低,8月下旬,硅藻门生物多样性最高,其次是蓝藻门(图9)。
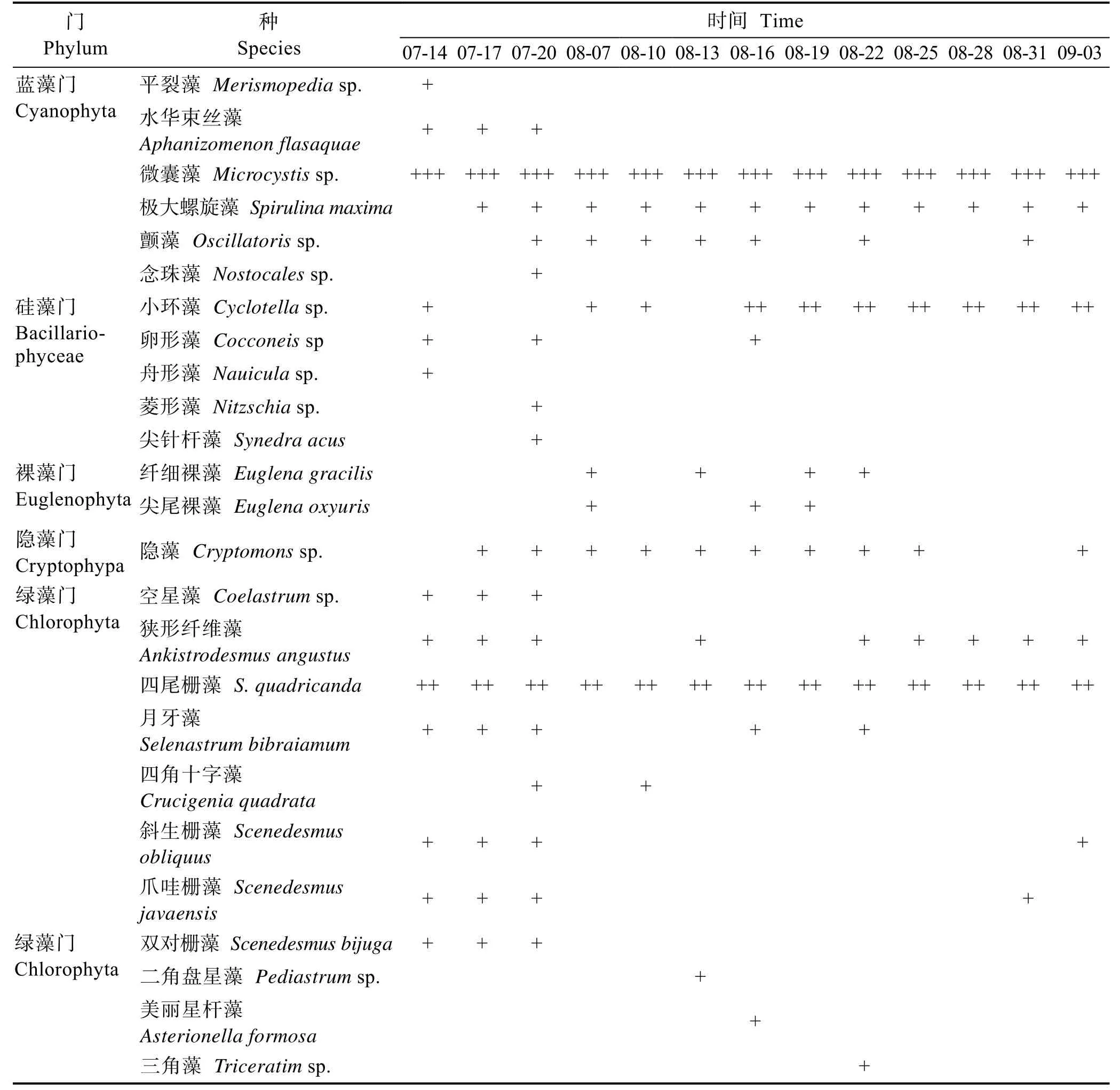
表2 养殖池塘浮游藻类种类组成Tab.2 Phytoplankton composition in aquaculture ponds
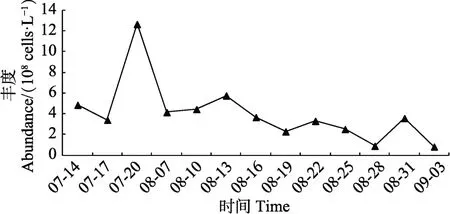
图6 养殖池塘浮游藻类丰度动态变化Fig.6 Variation of phytoplankton abundace in aquaculture ponds

图7 浮游藻类生物量动态变化Fig.7 Variation of phytoplankton biomass in aquaculture ponds

图8 养殖池塘浮游藻类多样性指数、均匀度指数和丰富度指数的变化Fig.8 Variation of biodiversity, evenness and abundance index of phytoplankton in aquaculture ponds
2.5 浮游藻类与理化因子的相关性
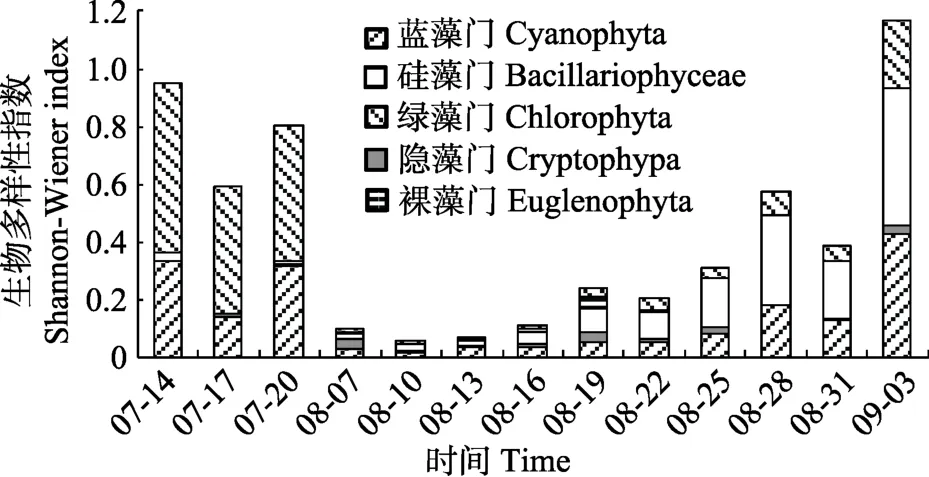
图9 养殖池塘各门藻类生物多样性动态变化Fig.9 Variation of phytoplankton biodiversity(Shannon-wienner index)in each phylum
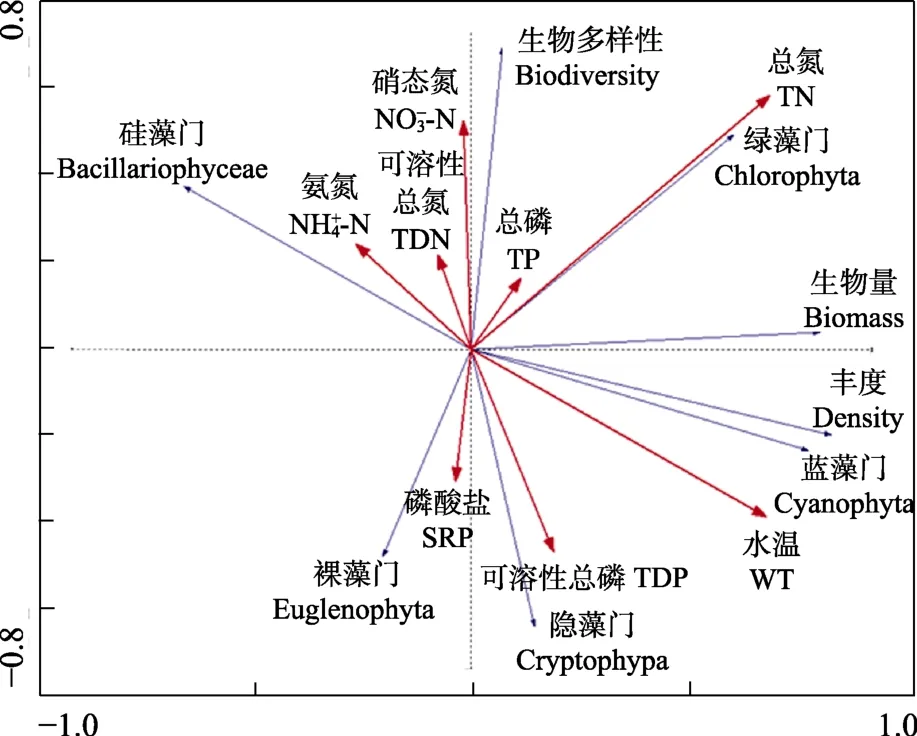
图10 浮游藻类丰度、生物量与环境因子的RDA分析Fig.10 Redundancy analysis between phytoplankton abundance, biomass and environmental variables
在蓝藻水华暴发期间,养殖池塘浮游藻类丰度和生物量高,生物多样性低。从图10可以看出,TP、TDP、TN、WT与浮游藻类丰度、生物量呈正相关,浮游藻类生物多样性与TDP、SRP、WT呈显著负相关。蓝藻门与水温、TP、TN呈正相关。硅藻门与-N、-N、TDN呈正相关;裸藻门与 SRP呈正相关,与TP、TN呈负相关;隐藻门与TDP、WT呈正相关;绿藻门与TP、TN呈正相关。
2.6 微囊藻毒素含量测定
在监测结束时,对养殖池塘MCs使用ELISA测定,通过反复对标准曲线的制作,最终选择较好的标准曲线,得出水体中MCs含量为0.040 µg/L,藻细胞中 MCs含量为 0.686 µg/L(图 11)。胞内 MCs明显高于胞外MCs含量,但无论是胞外还是胞内MCs含量均低于饮用水的安全标准(<1 µg/L)。
3 讨论与结论
3.1 浮游藻类丰度及生物多样性

图11 微囊藻毒素含量Fig.11 Contents of microcystin in aquaculture ponds
浮游藻类是养殖池塘生态系统的重要初级生产者,对维持池塘生态系统的稳定具有关键作用(石磊等, 2017; 于海波等, 2013; 刘冉等, 2013; 粟丽等,2011)。在本研究中,共鉴定出浮游藻类 25属(种),优势种为微囊藻,优势度为83.5%~99.1%,蓝藻水华暴发期间,优势种单一。本研究中,浮游藻类丰度高达 12.666×108cells/L,与前期调查的高产养殖池塘(李燕等, 2017)、鲤鱼养殖池塘浮游藻类密度达2.05×108cells/L、草鱼养殖池塘浮游藻类密度为 7.10×108cells/L相比,浮游藻类丰度明显偏高,这可能是蓝藻水华期间,微囊藻为优势种有关。同样,郑丙辉等(2011)在大宁河水华敏感期浮游植物研究中指出,7个采样点的藻细胞密度的最高值均出现在水华期。
生物多样性作为反映浮游植物群落生态特征的重要指标,不仅可以用来评价水体的污染程度,还可以从生态系统层面反映其稳定性(姜杨慧等, 2016;Padisáket al, 2006)。浮游藻类生物多样性指数、丰富度指数、均匀度指数均较低,总体呈先下降后上升的趋势,变化范围在 0.056~1.147、0.203~0.892、0.024~0.507之间,蓝藻水华暴发形成了以微囊藻占优势的藻类结构,造成浮游藻类多样性整体偏低。生物多样性在7月中旬绿藻门和蓝藻门较高,8月下旬,硅藻门和蓝藻门较高,随时间的变化使小型水体藻类多样性改变,但各门藻类整体多样性较低。通常情况下,藻类的物种多样性指数越高,其群落结构越复杂,稳定性越高(代存芳等, 2017; 陈格君等, 2013)。
综上所述,小型水体一般对环境因子的变化比较敏感,蓝藻水华的暴发造成浮游藻类的种类、密度、多样性在短时间内也会出现明显变化。
3.2 影响浮游藻类组成及多样性的因素
水温和营养盐是影响水体浮游藻类群落结构的重要因素。杨文等(2015)、陈家长等(2010)研究表明,蓝藻比较适应稳定水体,而且, 也偏好较高光照强度和高温,微囊藻最适生长温度为25~30℃。本研究在7~9月进行,水温为25~30℃,适宜微囊藻的生长。由此可见,水温对浮游藻类的生长起着重要作用。TP、TN最高值分别为0.51、7.09 mg/L,根据渔业水质标准规定,养殖池塘中TP的含量不得超过0.2 g/L,TN的含量不得超过1.0 mg/L(姜杨慧等, 2016),该池塘远远超出TP、TN标准含量。郑丙辉等(2011)研究表明,TP水平是促进蓝藻水华暴发的关键因子,不会对微囊藻的生长产生限制,蓝藻具有储P机制,能够对P进行富集。池塘为混养模式,加之饵料的投入,池塘底部有底泥,这可能是养殖池塘蓝藻水华暴发的主要原因之一。在本研究中,通过RDA分析表明,TP、TDP、TN、WT与浮游藻类丰度、生物量呈正相关,说明在蓝藻暴发水华期间,TN、TP、TDP、WT的增加使浮游藻类细胞密度和生物量增加。
蓝藻门与WT、TP、TN、TDP、SRP呈正相关,说明蓝藻一般随着营养盐和WT的不断增加,优势度也会不断增加,与刘霞等(2012)对太湖浮游藻类演替规律的调查结果相似。硅藻门与-N、-N、TDN呈正相关,裸藻门与 SRP呈正相关,与 TP、TN呈负相关;隐藻门与TDP、WT呈正相关,与郑丙辉等(2015)对大宁河水华敏感期调查硅藻门与-N呈正相关,硅藻门、裸藻门与TP呈负相关,隐藻门与WT呈正相关结论相似。绿藻门与TP、TN呈正相关,这可能与该调查池塘自身环境条件有关。
一般认为,在中营养水平水体中,生物群落结构复杂,多样性较高,而在极端贫营养或富营养水体中,物种多样性较低,这主要是由于贫营养水体中, 浮游藻类的营养较为匮乏,而在富营养水体中, 一些对污染敏感的种类消失(孙鹏飞等, 2015; Maet al, 2014;唐萍等, 2000)。营养水平对浮游藻类群落的改变按作用方向属于下行效应;浮游动物、滤食性鱼类等的影响属于上行效应。杨文等(2015)研究表明,小型水体营养水平的影响远大于浮游动物、滤食性鱼类等的影响。养殖池塘作为一种相对封闭的生态系统,由于其自净能力十分有限,常遭受更为严重的污染。整个养殖周期中,养殖池塘的理化因子不仅随着时间的推移而变化,而且,各理化因子之间也会相互影响(邵长清等, 2017; Fernándezet al, 2015; 迟爽等, 2014; 郭永坚等, 2013)。在高温季节控制营养盐已成为治理水体富营养化和水华发生的主要手段(朱荣等, 2015)。
3.3 微囊藻毒素测定
蓝藻水华暴发对水生生态系统的一个重要威胁就是MCs的释放,MCs是由水体中蓝绿藻[如铜绿微囊藻(Microcystis aeruginosa)、鱼腥藻(Anabaenasp.)等]产生的一类生物污染物。目前,已发现80余种结构极为相似的异构体,其中,MC-LR是MCs异构体中毒性最强的一种,也是我国富营养化水体中毒性较大的常见亚型(朱荣等, 2015)。MCs释放到水里,可通过化感作用与氧胁迫影响浮游藻类的群落结构,改变水生生物多样性。长期暴露于 MCs的鱼类、虾、蟹等水生动物也会受其危害,最终还可能通过食物链的生物富集危害人类健康(谢平, 2015; 金显仕等,2015; 杨晓红等, 2013)。夏季环境是养殖池塘暴发水华的敏感期,管理不善很容易暴发水华。在本研究结束时,定量分析了微囊藻毒素 MC-LR。结果表明,MCs水样中,其含量为0.040 µg/L,藻细胞中微囊藻毒素含量为0.686 µg/L。根据世界卫生组织以及相关报道,MCs含量安全范围不得超过 1.0 µg/L(刘艳红等, 2016; Sottonet al, 2014),本养殖池塘 MCs含量基本在安全范围之内。
