四氢异喹啉衍生物的合成及体外抗多子小瓜虫活性的研究*
2019-01-17姚嘉赟袁雪梅蔺凌云尹文林潘晓艺郝贵杰沈锦玉
姚嘉赟 徐 洋 袁雪梅 蔺凌云 尹文林 潘晓艺 郝贵杰 沈锦玉
(农业农村部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室浙江省淡水水产研究所 湖州 313001)
多子小瓜虫(Ichthyophthirius multifiliis),属纤毛门、寡膜纲、膜口目、凹口科、小瓜虫属(沈韫芬, 1999)。该纤毛虫体被分散排布且长短均一的纤毛,其生活史分为滋养体(Trophont)、包囊体(Tomont)和掠食体(Theront) 3个阶段(Ewing, 1992)。滋养体主要寄生在宿主体表,如鳃、皮肤、鳍和眼等的上皮组织中。在病灶处呈边缘明显的白点,故该寄生虫病也称“白点病”。滋养体在鱼类表皮或鳃上发育成熟,之后脱离鱼体并在水体中形成包囊,且经多次分裂后形成幼虫,感染性掠食体在短时间内侵染鱼体进而感染鱼体,形成一个生活史(Lomet al, 1994)。小瓜虫几乎可以感染所有淡水鱼类,其生长繁殖不需借助任何中间寄主,给世界水产养殖业造成重大经济损失(Klesiuset al, 1995; Wahliet al, 1993)。因此,小瓜虫的防治研究一直都是水产学科研究中的重点和难点。
国内外科研工作者对小瓜虫的防治药物进行了大量的研究,孔雀石绿和硝酸亚汞较为有效,但因其具有致癌作用,目前已被禁用(Rowlandet al, 2009)。甲醛(Strauset al, 2009a)、硫酸铜(Strauset al, 2009a)、过氧化氢(Lahnsteineret al, 2007),过氧乙酸(Strauset al,2009b),过碳酸钠(Heineckeet al, 2009),溴硝醇(Shinnet al, 2012; Picón-Camachoet al, 2012),高铁酸钾(Linget al, 2010)等被用于控制小瓜虫病,虽有一定的功效,但长期使用带来的是环境污染、药物残留、耐药性等一系列问题,也成为当前食品安全和水产品出口的绿色贸易壁垒问题,引起社会各界普遍关注。因此,寻找对小瓜虫病治疗行之有效的环境友好型药物是一项迫在眉睫的任务。作者利用多种技术手段从天然植物博落回(Macleaya cordata)和小果博落回(Macleaya microcarpa)中分离获得到了 3种苯菲啶异喹啉类化合物:血根碱(Yaoet al, 2010)、二氢血根碱和二氢白屈菜红碱(Yaoet al, 2011),药效结果显示,三者对小瓜虫具有较强的杀灭作用。同时,构效关系研究初步表明,其核心药效基团主要为四氢异喹啉,因此,本研究以 1-甲基-1,2,3,4-四氢异喹啉为起始原料,在2位的胺基上引入与环己甲酰氯、苯甲酰氯、噻吩甲酰氯、环己基异硫氰酸酯以及氯乙酰氯等不同基团,研究其杀虫功能,以期研制开发新型的杀虫药物。
1 材料与方法
1.1 四氢异喹啉衍生物的合成及鉴定
四氢异喹啉衍生物的合成方法参照王文龙等(2013)的方法进行。将 1-甲基-1,2,3,4-四氢异喹啉化合物溶于二甲基亚砜(DMSO)中,冰浴条件下,分别加入环己甲酰氯、苯甲酰氯、噻吩甲酰氯、乙酰氯以及氯乙酰氯后,常温条件下进行搅拌,并利用薄层层析进行追踪检测。经酸洗、碱洗以及柱层析纯化后得化合物 1~化合物 5,依次为环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮、二氢异喹啉-2(1H)-基)-苯基-甲酮、甲基-3,4-二氢异喹啉-2(1H)-基)-噻吩-2-基-甲酮、1-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-乙酮和 2-氯-1-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-乙酮,见图1。
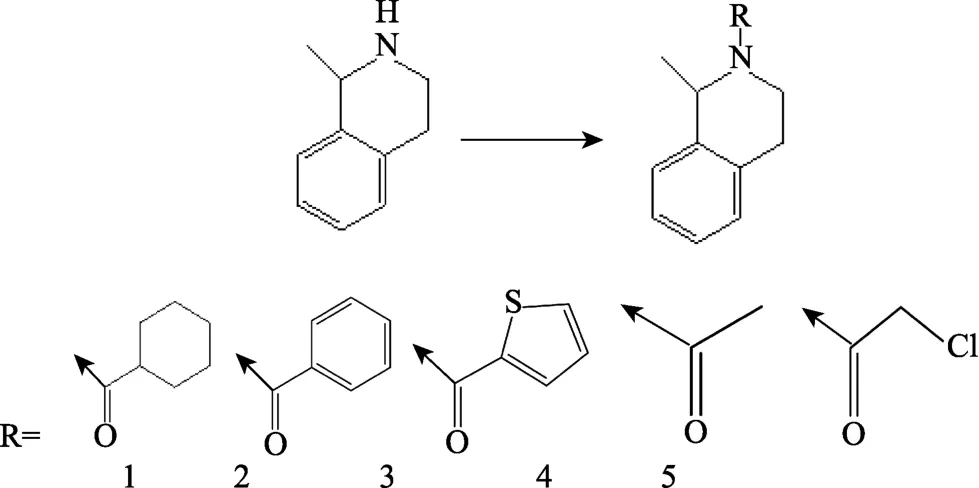
图1 1-甲基-1,2,3,4-四氢异喹啉衍生物合成过程Fig.1 Synthesis process of 1-methyl-1,2,3,4-tetrahydroisoquinoline derivatives
针对上述合成的 5种化合物,利用质谱(Waters micromas platform LCZ)、核磁氢谱、核磁碳谱(BRUKER AVIII-400型核磁共振仪)等波谱技术进行化学结构鉴定,进而确定化合物合成是否成功。
1.2 四氢异喹啉衍生物对小瓜虫的体外杀灭实验
1.2.1 虫体的收集 将严重感染小瓜虫的翘嘴红鲌(Erythroculter ilishaeformi)饲养于实验室的阶梯式养殖水槽中,在养殖水槽的底部放入大量自制的玻璃虫体收集器,待鱼体上的小瓜虫游出鱼体,进入水体底部的玻璃收集器后,收集虫体,一部分虫体放入22℃的虫体培养箱中进行培养,获取小瓜虫掠食体进行杀虫实验。另一部分放入平皿,进行体外包囊药物实验。
1.2.2 药物对小瓜虫掠食体的体外杀灭实验 用DMSO溶解合成的所有药物,进而配制成不同浓度梯度,向24孔细胞培养板中加入150 μl药物。收集小瓜虫掠食体,并放置在烧杯中进行稀释,至浓度约为200个/100 μl,待药物加入细胞培养皿后,向每个药物孔中加入50 μl虫体,并用枪头混匀。观察小瓜虫的死亡情况,并统计每个药物浓度的4 h死亡率。实验设1个空白对照组和1个DMSO对照组(前期实验表明,药物中所添加的最高浓度 DMSO对小瓜虫掠食体没有毒性)。每个药物浓度设3个重复。
1.2.3 药物对小瓜虫包囊的体外杀虫实验 按照前面的方法配制不同浓度梯度的药物,并进行杀虫预实验,初步确定药物对包囊的杀虫浓度范围,并在此基础上进行杀虫药效评价。向24孔细胞培养板中加入150 μl药物。收集小瓜虫包囊,并放置在烧杯中进行稀释,至浓度约为60个/100 μl,待药物加入细胞培养皿后,向每个药物孔中加入50 μl虫体,置于22℃恒温恒湿培养箱中,培养20~36 h后,统计各药物浓度组的包囊死亡数量和孵化的幼虫数量。实验设1个空白对照组和1个DMSO对照组(前期实验表明,药物中所添加的最高浓度 DMSO对小瓜虫包囊没有毒性)。每个药物浓度设3个重复。
1.3 环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮对翘嘴红鲌的急性毒性实验
因化合物 1 [环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮]对小瓜虫的体外杀虫效果最强,故而研究其对翘嘴红鲌的安全性。急性毒性实验按照Yao等(2010)的方法进行,实验鱼暂养7 d (其自然死亡率为0.5%)后,进行毒性预实验,初步确定药物的毒性实验浓度,按等对数间距设计7个浓度(289.0、256.0、225.0、196.0、156.0、144.0和121.0 mg/L),每个浓度组随机放置10尾实验鱼。实验控制水温为(25±1)℃,氨氮浓度<0.05 mg/L,溶解氧>6 mg/L,亚硝酸盐<0.01 mg/L。实验期间不投喂饲料,一旦有死鱼,及时捞出,每个药物浓度实验设 3个重复。根据 12、24、48和96 h的平均死亡率,利用直线内插法求出半致死浓度(LD50),其安全浓度的计算公式如下:
安全浓度=(24 h LD50×0.3)/(24 h LD50/48 h LD50)3
1.4 数据处理
用SPSS 16.0软件处理药效数据,以平均数±标准误差(Mean±SE)表示,采用方差分析进行差异显著性分析。
2 结果
2.1 四氢异喹啉衍生物对小瓜虫掠食体的杀灭作用
5种四氢异喹啉衍生物对小瓜虫幼虫的杀灭作用见图2。由图2可知,5种化合物在所测的浓度范围内对小瓜虫掠食体均具有杀灭作用。而杀虫效果最好的为化合物1,其浓度为24.0 mg/L时,在4 h即可杀灭100%幼虫,4 h的LD50为16.4 mg/L,而杀虫效果最差的为化合物4,其浓度为25.0 mg/L时,杀灭率为39.7%,4 h的LD50为30.6 mg/L。对小瓜虫掠食体的杀灭效果依次是化合物1>化合物3>化合物2>化合物5>化合物4。
体外杀虫实验结果还显示,5种四氢异喹啉衍生物对小瓜虫掠食体具有一定的细胞结构破坏作用,使用药物后,小瓜虫的纤毛不运动,胞质不流动,甚至胞膜破裂,细胞核破碎,而对照组小瓜虫体表纤毛完整,运动正常。
2.2 四氢异喹啉衍生物对小瓜虫包囊的杀灭作用
5种四氢异喹啉衍生物对小瓜虫包囊的杀灭作用见表1。由表1可知,5种化合物在所测的浓度范围内对小瓜虫的包囊均具有杀灭或抑制作用。杀虫效果最好的为化合物1,其浓度为60.0 mg/L时,可100%杀灭包囊,化合物3的效果最差,其浓度为60.0 mg/L时,包囊的死亡率为30%。5种化合物对小瓜虫包囊的杀灭效果依次是化合物1>化合物5>化合物4>化合物2>化合物3。
体外杀虫实验结果还显示,使用后药物组的包囊破裂、边界模糊,虫体不分裂,胞质不清晰,包囊不能进行分裂为幼虫。而空白对照组的包囊进行分裂,最后孵化成幼虫(图3)。
2.3 环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮对翘嘴红鲌的急性毒性实验
环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮对翘嘴红鲌的急性毒性实验结果见表2,由直线内插法计算可得,环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮对翘嘴红鲌的24 h的LD50为245.3 mg/L;48 h的LD50为234.3 mg/L;96 h的LD50为197.8 mg/L;根据公式计算可得,其安全浓度为64.1 mg/L。
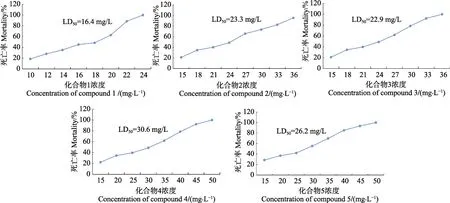
图2 5种化合物对小瓜虫掠食体的杀灭作用(4 h)Fig.2 Antiparasitic efficacy of the five synthesized compounds against I.multifiliis theronts after 4 h exposure

表1 化合物1~5对小瓜虫包囊的成活和孵化影响(6 h)Tab.1 I.multifiliis tomont survival and reproduction after 6 h exposure to the five synthesized compounds

图3 异喹啉衍生物作用小瓜虫包囊后的显微结构Fig.3 Microstructure of I.multifiliis tomont after treated with the five 1-methyl-1,2,3,4-tetrahydroisoquinoline derivatives
3 讨论
小瓜虫是危害水产养殖中的一个重要寄生虫,因其生活史中不需要中间寄主,故而只要切断其中一个生活史阶段即可达到病害防控的目的。目前,鱼体上滋养体阶段的小瓜虫因包囊外包一层膜,因此,药物很难进入将其杀死。本研究通过合成5种异喹啉类衍生物研究其对小瓜虫的掠食体和包囊杀灭作用,结果显示,5种化合物对2个生活史阶段的多子小瓜虫均有较好的杀灭作用,具有一定的开发应用前景。同时,发现化合物1对二者的杀灭作用最强,而较为有意义的发现是化合物 5对包囊的杀灭作用要强于对掠食体的杀灭作用,一般而言,包囊的杀灭难度要远远大于掠食体阶段,而化合物5则相反,故而该药物可能存在着针对包囊的作用靶点或者药效基团。前期工作中也发现,制霉菌素对小瓜虫包囊的杀灭作用也是强于掠食体阶段(Yaoet al, 2015),因此,今后可针对这2种药物进行包囊药物靶点和药效基团方面的研究。

表2 环己基-(1-甲基-3,4-二氢异喹啉-2(1H)-基)-甲酮对翘嘴红鲌的急性毒性Tab.2 Acute toxicity of cyclohexyl-(1-methyl-3,4-dihydroiso-quinoline)-ketone to E.ilishaeformis
异喹啉及其衍生物是一类重要的医药化工中间体,被广泛应用于各种重要医用药物。国内外的研究表明,异喹啉类生物碱具有抗肿瘤、抗菌、降压等多种生物活性(Navarroet al, 1999; Menget al, 2009; Huet al, 2006),Wang 等(2010)和 Yao 等(2010、2011)也获得多种具有杀指环虫和小瓜虫的异喹啉类生物碱。分析各类异喹啉类生物碱的结构可以发现,绝大部分该类化合物均存在着异喹啉或者异喹啉衍生物的基本框架结构。本研究参考王文龙等(2013)的方法以1-甲基-1,2,3,4-四氢异喹啉为起始原料,合成了 5种异喹啉类生物碱,杀小瓜虫药效结果显示,在2位的胺基上引入以含环己基的化合物 1的杀虫活性明显高于含芳香环的化合物2和化合物3,说明芳香环的引入有碍于杀虫活性的提高,该结果与王文龙等杀日本血吸虫的药效结果类似。氯乙酰基是一种重要的活性基团,异喹啉类衍生物引入氯乙酰基可形成独特的杀虫活性药效团(王文龙, 等2013),但本研究通过引入氯乙酰基其杀虫活性并未得到提升,可能是杀虫活性与氯乙酰基本身结构关系较小。故而,将来在对异喹啉类药物进行合成时需要尽量减少芳香基团和氯乙酰基等基团的引入。
