凡纳滨对虾RAS与WSSV-VP26的相互作用*
2019-01-17王中一刘庆慧
王中一 刘庆慧 黄 倢
(1.青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室中国水产科学研究院黄海水产研究所 青岛 266071;2.水产科学国家级实验教学示范中心 上海海洋大学 上海 201306)
白斑综合征病毒(White spot syndrome virus,WSSV)是养殖对虾主要的病害之一,其传播范围广、致病力强,虾群感染3~7 d的死亡率高达90%~100%,给水产养殖业造成了巨大的经济损失(黄倢等, 1995;Loet al, 1996; 马晓燕等, 2012; 何建国等, 1999)。研究表明,囊膜蛋白是介导病毒与宿主细胞发生相互作用的重要因子,在病毒侵染早期起关键作用,VP26、VP28和VP37是WSSV的主要囊膜蛋白,VP26存在于囊膜蛋白和核衣壳蛋白之间起联结作用(于力等,2008);VP28与病毒抗原性有关,在病毒入侵宿主细胞过程中起重要作用(van Hultenet al, 2000、2001);VP37是粘附蛋白,可延缓WSSV的侵染过程(Lianget al, 2005; Liuet al, 2009)。
Ras基因是在生物进化过程中第一个被鉴定出来的非常保守的原癌基因,广泛存在于从酵母菌到人类的真核细胞中,因首先发现于大鼠肉瘤病毒(Rat sarcoma,Ras)而得名(Liuet al, 1995; Winstonet al,1996; Fanet al, 1997)。其分泌的RAS蛋白是偶联细胞表面受体与胞内效应因子的信号转导子,位于细胞膜内侧,属于小G蛋白家族,能结合GTP和GDP。结合 GTP时为活性状态,能够与下游多种效应因子相互作用进行信号传递;当结合GDP时处于非活性状态,不能传递信号。所以,RAS蛋白在多种细胞跨膜受体介导的信号通路中起着分子开关的作用,在细胞增殖、分化、调亡、癌变等方面也起着非常重要的作用(Wennerberget al, 2005; Winstonet al, 1996; van der Weydenet al, 2007; Castroet al, 2005; Greenhoughet al, 2007)。目前,关于对虾小G蛋白家族的研究多集中在Rab蛋白上,Praween等(2017)研究表明,在对虾感染传染性皮下及造血组织坏死病毒(IHHNV)和WSSV时,Rab5、Rab6、Rab7三种蛋白的表达量均上调,说明三者参与了对虾的先天性免疫防御系统。
本研究通过克隆表达获得凡纳滨对虾的 RAS蛋白,利用Far-western技术在体外筛选出能与RAS蛋白相互作用的WSSV结构蛋白,并通过ELISA验证二者在数量上的相互作用关系,为深入全面地探索WSSV感染机制和防治措施奠定基础。
1 材料与方法
1.1 实验材料
WSSV结构蛋白 VP26、VP28N和 VP37,表达载体 pBAD/gⅢA由本实验室保存;TRIzol试剂、PrimeScript RT Reagent Kit with gDNA Eraser试剂盒、ExTaq酶及 DNA标准(DNA Marker DL2000)购自TaKaRa公司;E.coliTop10感受态细胞购自TIANGEN公司;氨苄青霉素(Amp+)、L-阿拉伯糖、质粒小提试剂盒购自Solarbio公司;T4 DNA连接酶、限制性内切酶NcoI、XbaI及蛋白Marker购自Thermo公司;地高辛(DIG)购自 Roche公司;胶回收试剂盒购自ZYMO公司。
1.2 实验方法
1.2.1 凡纳滨对虾 cDNA的合成 剪取凡纳滨对虾的鳃丝,加入适量 RNAiso充分研磨后,按照RNAiso试剂盒说明书提取RNA。依照PrimeScript RT Reagent Kit With gDNA Eraser试剂盒说明书将RNA反转录成cDNA。
1.2.2 凡纳滨对虾Ras编码区基因的克隆 按照GenBank上的凡纳滨对虾Ras mRNA序列,设计特异性引物(Rass:5'-TACCATGGAGATGACGGAATACACG-3';Rasa:5'-ACTCTAGATCGAACACAATGCACTT-3',划线处为NcoI和XbaI酶切位点),以凡纳滨对虾鳃的cDNA为模板,PCR扩增Ras基因序列。PCR产物经1%的琼脂糖凝胶电泳后,回收纯化。
1.2.3 重组表达载体pBAD/gⅢA-Ras的构建
PCR产物和 pBAD/gⅢA载体经NcoI和XbaI双酶切,T4 DNA连接酶连接,构建重组表达载体,转化到E.coliTop10感受态细胞中,取100 μl转化液涂布到 LB固体培养基(Amp+,50 µg/ml)上,37℃倒置培养。挑取单克隆,进行菌液PCR筛选阳性克隆,测序验证。
1.2.4 RAS生物学分析 利用在线软件ProtParam tool分析蛋白的等电点和分子量,应用 SignalP 3.0 Server预测氨基酸序列有无信号肽,利用NPS Network Protein Sequence Analysis在线软件,采用PHD方法预测RAS蛋白二级结构(王修芳等, 2016)。
1.2.5 RAS蛋白的表达 测序正确的菌液用新鲜的 LB 培养液(Amp+,100 µg/ml)培养至 OD600nm为0.5~0.6,加入诱导剂L-阿拉伯糖(终浓度为0.2 g/L),37℃诱导4 h,对照组不加诱导剂。10000 r/min离心5 min,收集菌体,PBS缓冲液(pH=7.4)重悬,用超声破碎仪超声破碎后,10000 r/min离心30 min,分别收集诱导、未诱导菌液的上清液和沉淀,SDS-PAGE分析RAS蛋白表达情况,并将蛋白条带切下,送上海复旦大学进行蛋白质谱分析。
1.2.6 Co2+柱亲和层析纯化 RAS蛋白 诱导表达的菌液沉淀用A液(含6 mol/L盐酸胍,pH=7.4)溶解后,4℃ 10000 r/min离心10 min,收集上清液,依次经0.8 μm和0.45 μm滤膜过滤。向层析柱中加入树脂,PBS缓冲液(pH=7.4)平衡洗柱,A液将紫外吸收峰洗至0,加入蛋白上清液混匀,冰浴2 h,A液洗脱至峰值为0,C液(含150 mmol/L咪唑,pH=7.4)洗脱,并收集RAS蛋白。RAS蛋白经尿素梯度复性液(4、2、1、0 mol/L)透析复性后浓缩,SDS-PAGE检测蛋白纯化效果。
1.2.7 DIG标记 RAS蛋白 将 DIG粉末溶于DMSO(1∶1000)中,与RAS蛋白充分混匀,4℃ PBS缓冲液(pH=7.4)过夜透析,以去除过量的DIG。
1.2.8 Far-western检测与RAS蛋白互作的WSSV蛋白 将WSSV的3种结构蛋白VP26、VP28N、VP37和 BSA(阴性对照)进行 15% SDS-PAGE后,转印至PVDF膜上,4℃ 5% BSA封闭过夜,PBS-T清洗后加入DIG-RAS蛋白,室温避光孵育2 h,PBS-T清洗5遍后,加入碱性磷酸酶(AP)标记的抗 DIG抗体(Anti-DIG-AP,1∶3000),室温避光孵育2 h,PBS-T清洗5遍后,用BCIP/NBT显色液避光显色。
1.2.9 ELISA检测RAS蛋白与VP26的相互作用
VP26 用 Na2CO3包被液稀释至 0.02 μg/μl,分别取50 μl稀释好的VP26加入96孔板中,BSA为阴性对照,4℃包被过夜。PBS-T清洗后,5% BSA常温封闭 2 h,PBS-T洗板 3次。加入 50 μl不同量的DIG-RAS 蛋白(0.1、1.0、2.5 μg),常温孵育 2 h,PBS-T洗板5次。加入50 μl Anti-DIG-AP(1∶5000稀释),常温孵育2 h,PBS-T洗板5次,加入50 μl PNPP显色液,直到出现明显颜色时,加入50 μl NaOH (0.3 mol/L)中止反应。酶标仪测定405 nm处的吸光值并计算P/N值。P/N计算公式:P/N=(OD405nm-OD405nm空白)/(OD405nmBSA-OD405 nm空白)。
2 实验结果
2.1 Ras基因的克隆
以凡纳滨对虾鳃的cDNA为模板,利用设计的引物扩增Ras基因,琼脂糖凝胶电泳结果见图1,扩增的片段在500~750 bp之间,与Ras基因片段(561 bp)大小相符。
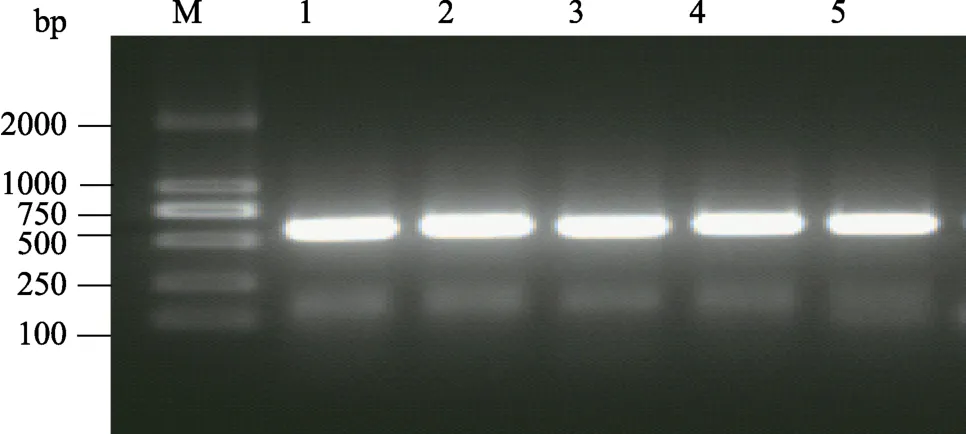
图1 Ras基因的克隆Fig.1 Amplification of Ras gene
2.2 重组表达载体pBAD/gⅢA-Ras的鉴定
T4 DNA连接酶将双酶切后的目的片段与具有相同粘性末端的 pBAD/gⅢA表达载体连接,转化到E.coliTop10细胞中,经菌液PCR鉴定阳性克隆,PCR产物电泳结果见图2,条带大小为500~750 bp,菌液测序结果经过DNAMAN软件分析,重组表达载体序列完全正确,无碱基错配和移码突变。

图2 重组表达载体PCR鉴定Fig.2 Identification of recombinant vector by PCR
2.3 RAS蛋白生物学信息
经ProtParam tool分析显示,RAS理论分子量为21.3 kDa,等电点为5.97;SignalP 3.0 Server分析显示,该蛋白无信号肽结构,NPS Network Protein Sequence Analysis预测RAS蛋白二级结构(图 3),α螺旋为40.64%,β转角为36.9%,延伸链占22.46%。
2.4 RAS蛋白的检测
分别取诱导、未诱导菌液的上清液和沉淀进行SDS-PAGE(图4),与未诱导的上清液、诱导的上清液、未诱导的沉淀相比,诱导菌液的沉淀在25 kDa左右出现一条明显加粗的蛋白条带(图 4中的红色箭头所示),将此条带进行蛋白质谱分析(表1),结果显示,该蛋白为凡纳滨对虾的RAS蛋白。

图3 RAS蛋白二级结构Fig.3 Secondary structure prediction of RAS
2.5 RAS蛋白的纯化
重组RAS蛋白带有6×His标签,可利用Co2+亲和层析法纯化。SDS-PAGE显示(图5),RAS蛋白纯度高,为单一条带,可用于下一步实验。
2.6 RAS蛋白与WSSV结构蛋白的相互作用
将VP26、VP28N和VP37进行蛋白电泳后转印至PVDF膜上,依次经过DIG-RAS蛋白和Anti-DIGAP孵育。显色结果显示,在 VP26泳道出现明显的条带(图 6中的红色箭头所示),而 VP28N、VP37和BSA泳道无条带,说明RAS蛋白只能与VP26特异性结合。
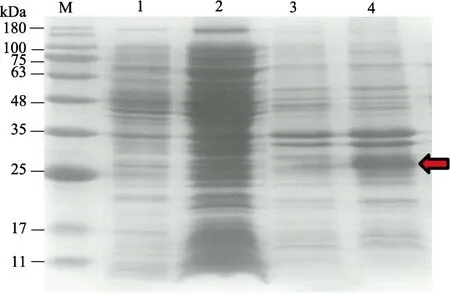
图4 RAS蛋白表达检测Fig.4 Detection of RAS protein
2.7 ELISA分析
采用ELISA方法,进一步验证VP26与RAS互作,数据分析显示P/N值远大于2(图7),且VP26与RAS蛋白的相互作用随RAS蛋白量的增加而增强,当RAS蛋白量增加至2.5 μg时,P/N值增加到16.4,说明VP26与RAS蛋白有明显的结合作用。

图5 SDS-PAGE分析纯化的RAS蛋白Fig.5 SDS-PAGE analysis of purified RAS
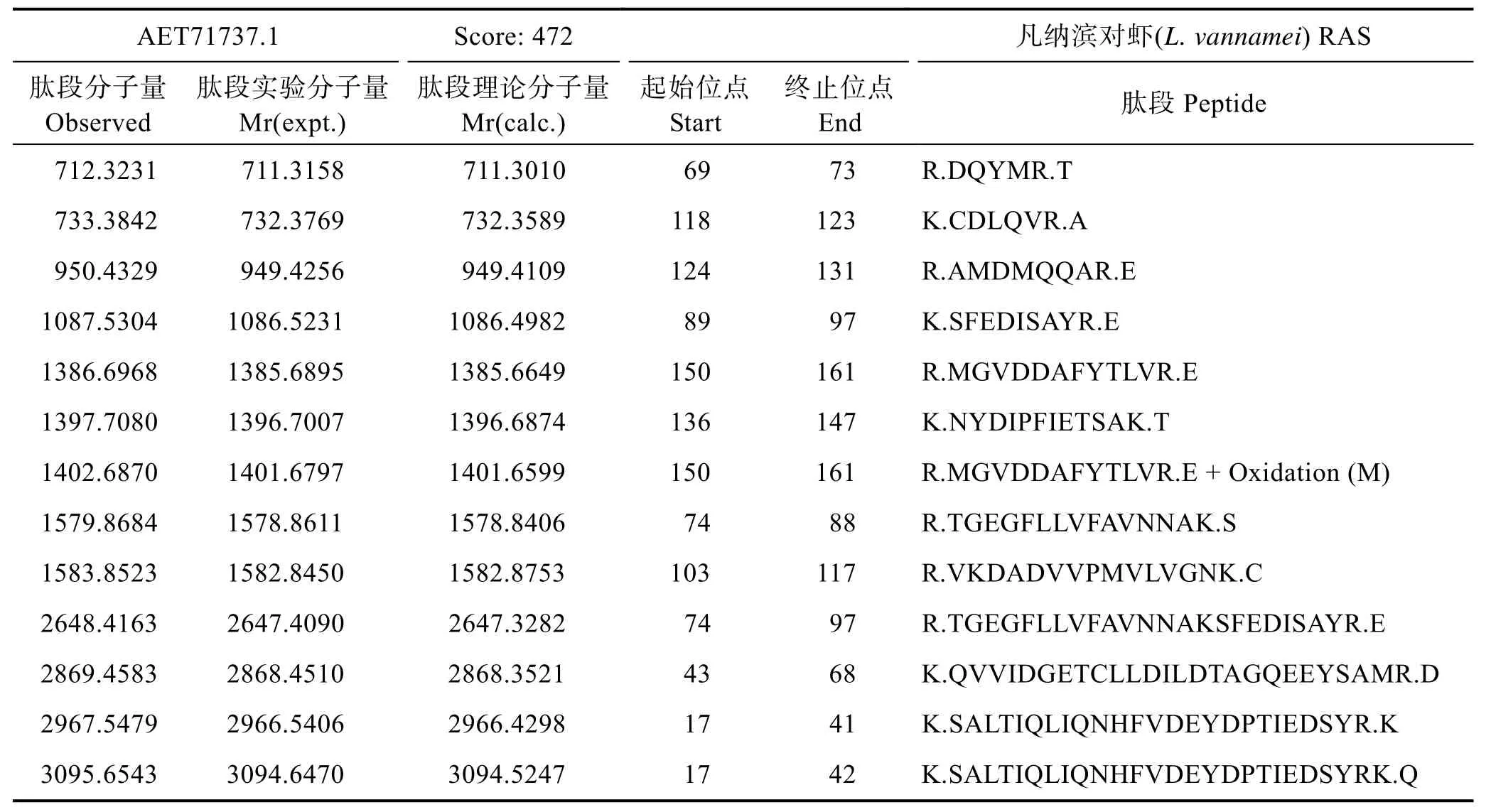
表1 RAS蛋白质谱分析结果Tab.1 Results of MS analysis of RAS

图6 Far-western分析RAS蛋白与VP26、VP28N及VP37的相互作用Fig.6 Analysis of interaction of purified recombinand RAS and VP26, VP28N, and VP37 by far-western

图7 ELISA分析RAS蛋白与VP26的相互作用Fig.7 Analysis of RAS interaction with VP26 by ELISA
3 讨论
大量研究表明,病原蛋白与宿主蛋白相互作用是诱发感染、致病的关键环节。WSSV侵染宿主细胞是一个很复杂的过程,病毒在复制过程中会与多种宿主细胞蛋白发生作用。近年来,已报道多种宿主分子(包括Rab5、Rab6、Rab7等小G蛋白)参与WSSV的侵染过程(Sritunyalucksanaet al, 2006、2013),但关于RAS蛋白与WSSV的相互作用尚不明确。
本研究根据Ras编码区序列设计引物,PCR获得Ras序列,通过原核表达和Co2+亲和层析法得到RAS蛋白,SDS-PAGE结果显示,RAS蛋白存在于诱导沉淀中,属于包涵体蛋白。以WSSV的3个主要结构蛋白 VP26、VP28N和 VP37作为研究对象,通过Far-western和 ELISA检测三者是否与凡纳滨对虾RAS蛋白相互作用。研究表明,RAS蛋白虽不能与VP28N和VP37相互作用,但能与VP26特异性结合,且二者的相互作用随着 RAS蛋白量的增加而增强。VP26是WSSV中含量较高的被膜蛋白,起连接作用(Tsaiet al, 2006),既可以与囊膜蛋白VP28结合,又可以与核衣壳蛋白VP51结合,三者可能通过形成复合体起到稳定病毒结构的作用(Changet al, 2008;Wanet al, 2008)。VP26能特异性结合斑节对虾(Penaeus monodon)血细胞,参与WSSV侵染的初始阶段(刘非等, 2006),中国明对虾(Fenneropenaeus chinensis)的 Tetraspanin-3蛋白在体外也能特异地结合VP26,参与WSSV的感染过程(关广阔等, 2015),VP26通过与日本囊对虾(Penaeus japonicus)β肌动蛋白作用,完成WSSV的入侵、运输和释放等过程(Liuet al, 2011; Xieet al, 2005; Gouinet al, 2005),说明VP26可与多个宿主分子相互作用。
RAS是细胞内信号通路中的转导因子,在信号传导途径中起着极为重要的作用,RAS与 VP28和VP37无作用,说明RAS不参与WSSV吸附宿主细胞的过程。根据研究结果可初步推测,在 WSSV侵染凡纳滨对虾细胞时,RAS蛋白通过与VP26相互作用,调控信号通路介导 WSSV进入细胞内,从而加快了 WSSV在宿主体内的传播,具体作用机制尚需深入研究。本研究结果为进一步揭示 WSSV侵染宿主细胞的信号通路和病毒-宿主相互作用机制提供了理论基础。
