淡水养殖凡纳滨对虾生长相关基因HDAC1克隆及其表达分析
2022-08-09骆永丽于忠利王文雁戴习林
骆永丽,刘 红*,于忠利,王文雁,戴习林
(1水产种质资源发掘与利用教育部重点实验室(上海海洋大学),上海 201306;2水产科学国家级实验教学示范中心(上海海洋大学),上海 201306;3上海市奉贤区水产技术推广站,上海 201400)
0 引言
【研究意义】凡纳滨对虾(Litopenaeus vanna‐mei)又称南美白对虾,养殖范围广、产量高,约占虾类总产量的85%(唐扬等,2018;李强勇等,2020)。近年来,凡纳滨对虾淡水养殖已发展成为我国水产业的一种重要养殖方式,但针对其淡水养殖生长发育及基因调控的研究相对较少(陈田聪等,2018;方振朋等,2020)。乙酰化是最早被研究的表观遗传修饰,组蛋白乙酰化是乙酰化转移酶和去乙酰化酶协同调控的一个动态过程,组蛋白去乙酰化对于真核基因表达调控具有重要意义(蒙娟等,2020;史建磊等,2020)。组蛋白去乙酰基酶1(Histone deacety‐lase 1,HDAC1)是组蛋白去乙酰化酶复合物的重要组成部分,因此,克隆凡纳滨对虾HDAC1基因,并从分子水平探究不同家系凡纳滨对虾在淡水养殖过程中的生长性能,对揭示凡纳滨对虾生长基因调控机制及筛选优良品系具有重要意义。【前人研究进展】HDAC1基因参与调节早期胚胎的发育和细胞分化等生理过程(Brunmeir et al.,2009),目前有关脊椎动物的HDAC1基因研究较多。刘峰(2005)通过研究猪HDAC1基因与生长性状相关的多态性位点,发现不同基因型对其生长和胴体性状均有遗传效应,其中HDAC1基因G等位基因具有显著提高生长的效应。Montgomery等(2007)研究发现小鼠HDAC1基因缺失或C端突变均会导致胚胎发育迟缓,甚至在妊娠11 d前死亡,故推测HDAC1基因参与小鼠的胚胎发育过程。李明杨等(2017)研究证实,HDAC1基因可作为猪生长的一个主要候选基因,或在品种选育时作为分子标记。杨颖等(2018)在南阳黄牛HDAC1基因中挖掘出与生长相关的SNP位点,为南阳黄牛分子育种提供了新的分子标记。在水产领域,李慧等(2014)通过分析HDAC1基因在牙鲆(Paralichthys olivaceus)变态前及变态阶段的表达情况,发现随着仔鱼的发育,HDAC1基因在冠状幼鳍、肠道等多种器官中的表达强度逐渐增强,在鳃组织中的表达贯穿整个变态发育期,但在变态后期表达趋势减弱,故推测HDAC1基因在牙鲆的生长过程中发挥重要作用。Ko等(2019)研究表明,在患有严重肝细胞丢失的斑马鱼中,HDAC1基因通过Sox9b基因调节肝祖细胞(LPC)向肝细胞分化,并通过Cdk8、Fbxw7和Notch3基因调节LPC向胆管上皮细胞(BEC)分化。此外,在软体动物中也有HDAC1基因的相关报道。高晓艳等(2016)成功克隆获得文蛤HDAC1基因,并在其外显子区域发现3个与文蛤生长相关的SNP位点(627A>T、924T>C和1266T>C);任付真等(2016)对泥蚶中HDAC1基因进行克隆及定量分析,发现其在多种组织中均有表达,且以足部的相对表达量最高,说明HDAC1基因对该组织生长具有重要作用。【本研究切入点】HDAC1基因与动物生长密切相关,近年来有关涡虫(张振超等,2013)和果蝇(Wang et al.,2018)等物种HDAC1基因结构和功能的研究已有报道,但鲜见针对凡纳滨对虾的相关报道。【拟解决的关键问题】选取自选家系自交后代及其他3个家系开展淡水养殖试验,分析HDAC1基因在不同淡水生长特性家系凡纳滨对虾中的表达情况,以明确HDAC1基因在对虾淡水养殖过程中的功能作用,为揭示凡纳滨对虾生长调控的分子机制提供参考依据。
1 材料与方法
1.1 试验材料
用于基因克隆及组织分布表达的凡纳滨对虾取自上海市金山区上海海洋大学基地,体长6~8 cm,体重3~4 g;解剖采集肝胰腺、胃、脑、肠道、鳃、眼柄、心脏和肌肉等组织,-80 ℃保存备用。用于淡水生长对比试验的凡纳滨对虾则是从海南空运回上海的仔虾,包括4个家系:自选家系自交后代(E4,关岛雌虾与关岛雄虾自交后代)及3个其他杂交后代(E1,厄瓜多尔野生雌虾与引进雄虾杂交后代;E2,厄瓜多尔野生雄虾与引进雌虾杂交后代;E3,关岛雌虾与厄瓜多尔野生雄虾杂交后代),在上海市金山区上海海洋大学基地淡化养殖7 d后选择体长规格一致的个体放入水泥池中养殖。
1.2 试验方法
1.2.1 总RNA提取及cDNA合成 采用Total RNA Extractor试剂盒(TaKaRa)提取凡纳滨对虾上述组织样品的总RNA,以ND-2000核酸蛋白检测仪检测总RNA浓度和OD值,以1.0%琼脂糖凝胶电泳检测其完整性。按SMARTer RACE 5'/3' Kit试剂盒(Taka‐Ra)说明反转录合成cDNA,-20 ℃保存备用。
1.2.2 凡纳滨对虾HADC1基因cDNA全长及内含子克隆 利用DNAMAN对本课题组前期研究获得的凡纳滨对虾转录组中类似HDAC1基因的Unigenes与GenBank 预测的凡纳滨对虾HDAC1基因序列(XM_027358592.1)进行比对,基于保守区域设计引物(表1),以合成的cDNA第一链为模板进行PCR扩增。根据获得的保守片段设计特异性引物5'-RACE和3'-RACE,扩增HDAC1基因RACE片段(图1),最后用DNAMAN对测序结果进行拼接,以获得HDAC1基因cDNA全长。利用NCBI在线工具预测HDAC1基因内含子,并根据HDAC1基因cDNA全长序列设计4对引物(表1)进行内含子序列克隆。所有引物均委托苏州金唯智生物科技有限公司合成,稀释成10 μmol/L备用。PCR反应体系50.0 μL:2×TaqPCR Mix 25.0 μL,上、下游引物各2.5 μL,cDNA模板2.0 μL,ddH2O 18.0 μL。扩增程序:95 ℃变性5 min;95 ℃30 s,退火30 s,72 ℃延伸时间为1 kb/min;72 ℃终延伸10 min。退火温度和延伸时间见表2。PCR扩增产物经1.5%琼脂糖凝胶电泳检测合格后,以琼脂糖凝胶回收试剂盒[天根生物科技(北京)有限公司]进行胶回收,回收产物克隆至pMD19-T载体上,菌液直接送至生工生物工程(上海)股份有限公司测序。

表2 PCR扩增退火温度及延伸时间Table 2 Annealing temperature and extension time of PCR amplification
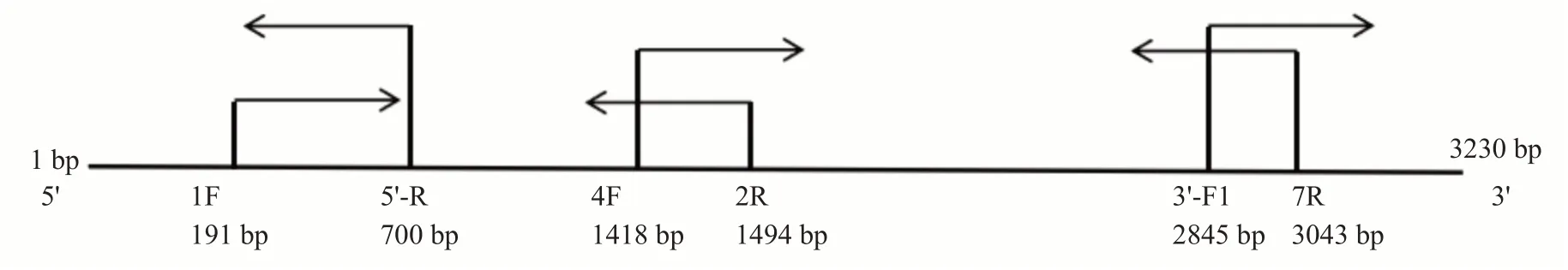
图1 凡纳滨对虾HDAC1基因RACE克隆示意图Fig.1 RACE cloning diagram of HDAC1 gene in L.vannamei

表1 凡纳滨对虾HDAC1基因克隆及表达分析的扩增引物Table 1 Amplified primers for cloning and expression analysis of HDAC1 gene in L.vannamei
1.2.3 凡纳滨对虾HADC1基因序列分析 将PCR扩增产物测序结果去除接头后拼接获得cDNA全长,利用在线生物信息学分析软件(表3)对凡纳滨对虾HDAC1基因序列及其编码蛋白进行预测分析。

表3 生物信息学分析软件Table 3 Bioinformatics analysis software
1.2.4 凡纳滨对虾HDAC1基因组织表达分析 采用SYBR Green ProTaqHS qPCR Kit(艾克瑞生物科技有限公司)进行实时荧光定量PCR检测,以凡纳滨对虾18S rRNA为内参基因,设3次重复。实时荧光定量PCR反应体系20.0 μL:SYBR 10.0 μL,上、下游引物各0.4 μL,cDNA模板0.2 μL,ddH2O 9.0 μL。扩增程序:95 ℃预变性30 s;95 ℃5 s,60 ℃30 s,进行40个循环。采用2−△△Ct法换算HDAC1基因相对表达量,并以SPSS 20.0进行单因素分析(One-way ANOVA),利用Excel 2016制图。
1.2.5 生长对比试验及HDAC1基因表达分析 4个家系凡纳滨对虾仔虾在3.5 m×7.0 m的水泥池中养殖70 d。每个家系群体设3个重复,每个水泥池投放1300尾仔虾。每日分别于7:00、13:00和18:00时准确称量投喂饲料,投喂量为对虾体重的5%~10%;24 h连续充气增氧。从下池开始每隔10 d从每个水泥池中随机取至少30尾虾测量体长和体重,在养殖40、50和70 d时对4个家系群体的凡纳滨对虾进行解剖,采集肠道组织,并选择养殖70 d时各家系群体中的大虾(体长8~11 cm,体重6~12 g)和小虾(体长5~8 cm,体重2~6 g),解剖采集其肠道组织,液氮速冻后-80 ℃保存,用于HDAC1基因表达分析。
养殖试验结束后记录各养殖池凡纳滨对虾的总摄食量(FI,g),并计算存活率(RS,%)、日增重率、体长日增率、特定生长率(SGR)及饲料转化率(FCR)。计算公式如下:
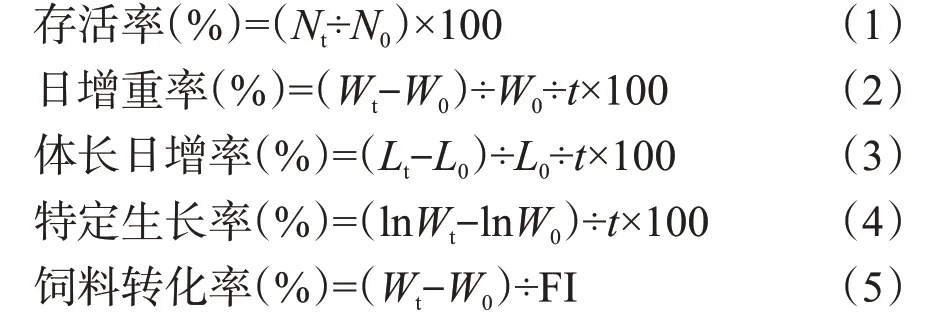
式中:Nt、N0分别为试验终末对虾数量和试验初始对虾数量,Wt、W0分别为试验终末对虾平均体重和试验初始对虾平均体重,t为养殖天数,Lt、L0分别为试验终末对虾平均体长和试验初始对虾平均体长,FI为总摄食量。
2 结果与分析
2.1 凡纳滨对虾HDAC1基因cDNA全长测序结果
根据本课题组前期构建转录组数据中的HDAC1基因转录本,通过RACE克隆获得4个基因片段,长度分别为700、1323、1625和385 bp(图2),拼接后最终获得HDAC1基因cDNA全长3230 bp,包括67 bp的5'非编码区(5'-UTR)、1711 bp 的3'非编码区(3'-UTR)及1452 bp的开放阅读框(ORF),共编码483个氨基酸残基(图3)。凡纳滨对虾HDAC1基因cDNA序列3'-UTR有加尾信号AATAAA和poly(A)尾。

图2 凡纳滨对虾HDAC1基因RACE扩增电泳结果Fig.2 RACE amplification electrophoresis of HDAC1 gene in L.vannamei
使用ExPASy预测得知,HDAC1蛋白分子量为54640.22 Da,理论等电点(pI)为5.59,属于稳定的亲水性蛋白;InterPro预测结果表明,HDAC1蛋白具有1个Histone deacetylase 1结构域(28~317 aa);HDAC1蛋白无跨膜结构,定位于细胞核、线粒体、溶酶体的百分比分别为60%、10%和10%,由此推测HDAC1蛋白主要位于细胞核中;使用SOPMA和SWISS-MODEL分别预测凡纳滨对虾HDAC1蛋白的二、三级结构,结果发现其二级结构(图4)中α-螺旋占33.54%、β-转角占7.45%、β-折叠占15.12%、无规则卷曲占43.89%,三级结构建模(图5)也显示凡纳滨对虾HDAC1蛋白主要由α-螺旋和无规则卷曲构成。同源模板与凡纳滨对虾HDAC1 氨基酸序列的相似性为84.92%,GMQE为0.69,QMEAN为-0.31,说明凡纳滨对虾HDAC1蛋白与模板蛋白匹配度较高。
图4 凡纳滨对虾HDAC1蛋白二级结构预测结果Fig.4 Prediction of the secondary structure of the HDAC1 protein in L.vannamei

图5 凡纳滨对虾HDAC1蛋白三级结构预测结果Fig.5 Prediction of the tertiary structure of the HDAC1 protein in L.vannamei
2.2 HDAC1氨基酸序列同源比对分析及系统发育进化树构建
HDAC1氨基酸多序列比对分析结果显示,凡纳滨对虾与斑节对虾(Penaeus monodon)、大型溞(Daphnia magna)、按蚊(Anopheles albimanus)、果蝇(Drosophila melanogaster)、欧洲大扇贝(Pecten maximus)、小鼠(Mus musculus)、人类(Homo sapiens)的HDAC1氨基酸序列相似性分别为99.79%、88.26%、77.89%、72.28%、82.10%、77.89%和78.31%,说明HDAC1氨基酸序列在不同物种间具有高度保守性。利用MEGA X的邻接法(Neighbor-joining,NJ)构建凡纳滨对虾和其他物种的HDAC1氨基酸序列系统发育进化树,结果(图6)发现凡纳滨对虾与斑节对虾的亲缘关系最近,其次是大型溞。

图6 基于HDAC1氨基酸序列相似性构建的系统发育进化树Fig.6 Phylogenetic tree constructed based on similarity of HDAC1 amino acid sequence
2.3 凡纳滨对虾HDAC1基因DNA序列分析结果
通过RACE克隆获得4个基因片段(图7),长度分别是645、607、1082和492 bp,拼接后最终获得凡纳滨对虾HDAC1基因DNA序列总长4692 bp,包含8个外显子和7个内含子,与预测的HDAC1基因DNA序列结果相符,在内含子区仅有个别碱基不同,均符合内含子GT-AG剪接规则。最长的内含子长度为542 bp,其他内含子长度则在100~300 bp。
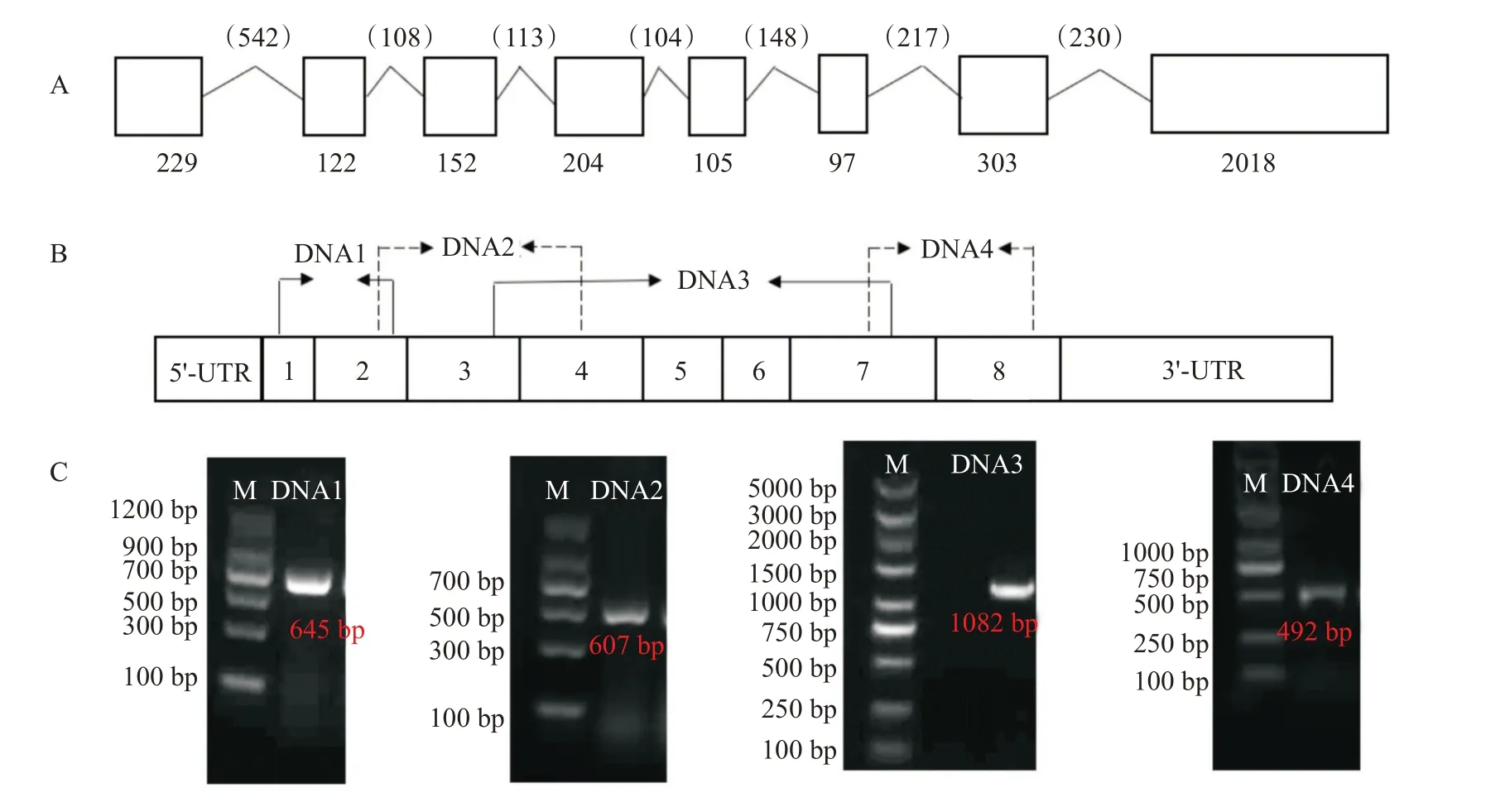
图7 凡纳滨对虾HDAC1基因DNA序列RACE克隆示意图及扩增产物电泳结果Fig.7 RACE cloning diagram and amplified product electrophoresis of DNA sequence of HDAC1 gene in L.vannamei
2.4 凡纳滨对虾HDAC1基因组织表达分析结果
采用实时荧光定量PCR检测HDAC1基因在凡纳滨对虾不同组织中的表达情况,结果显示,凡纳滨对虾HDAC1基因在肠道中的相对表达量最高(图8),显著高于在其他组织中的相对表达量(P<0.05,下同),凡纳滨对虾HDAC1基因在不同组织中的相对表达量排序为肠道>脑组织>眼柄>胃>心脏>鳃组织>肝胰腺>肌肉。
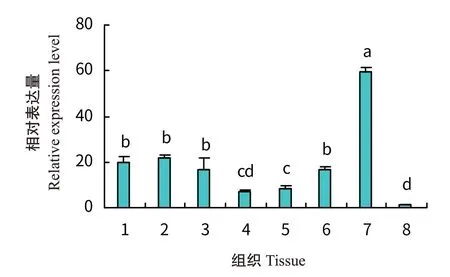
图8 凡纳滨对虾HDAC1基因在不同组织中的相对表达量Fig.8 Relative expression of HDAC1 gene in different tissues of L.vannamei
2.5 凡纳滨对虾生长对比试验及其肠道HDAC1基因表达差异
由表4可知,4个家系群体中以E3的终末体长、终末体重、日增重率、体长日增长率及特定生长率最低,均显著低于其他3个家系,而饲料转化率显著高于其他3个家系;E4的生长效果最优,其终末体长、终末体重、日增重率、体长日增长率及特定生长率均显著高于其他3个家系。4个家系群体凡纳滨对虾的生长性能排序为E4>E1>E2>E3。
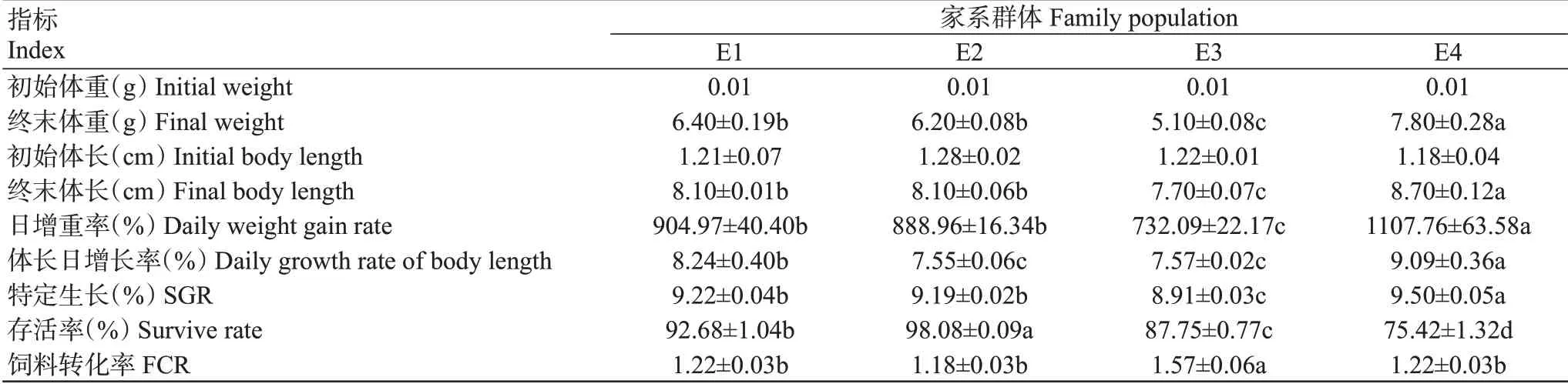
表4 不同家系凡纳滨对虾淡水养殖70 d后的生长指标比较Table 4 Growth index comparison of different families of L.vannamei cultured in freshwater for 70 days
利用实时荧光定量PCR检测HDAC1基因在不同家系凡纳滨对虾肠道中的表达情况,结果(图9)显示,养殖40 d时E4的体重最重,HDAC1基因在E4肠道中的相对表达量也最高,且显著高于其他3个家系;养殖50 d时也是以E4的体重最重及肠道中HDAC1基因相对表达量最高,二者均显著高于其他3个家系群体;至养殖70 d时,HDAC1基因在不同家系群体大虾中的相对表达量高于对应家系群体中的小虾。无论是大虾还是小虾,均以E3的体重最轻、E4的体重最重,肠道中的HDAC1基因相对表达量也表现为E3最低、E4最高,且2个家系群体的差异达显著水平。
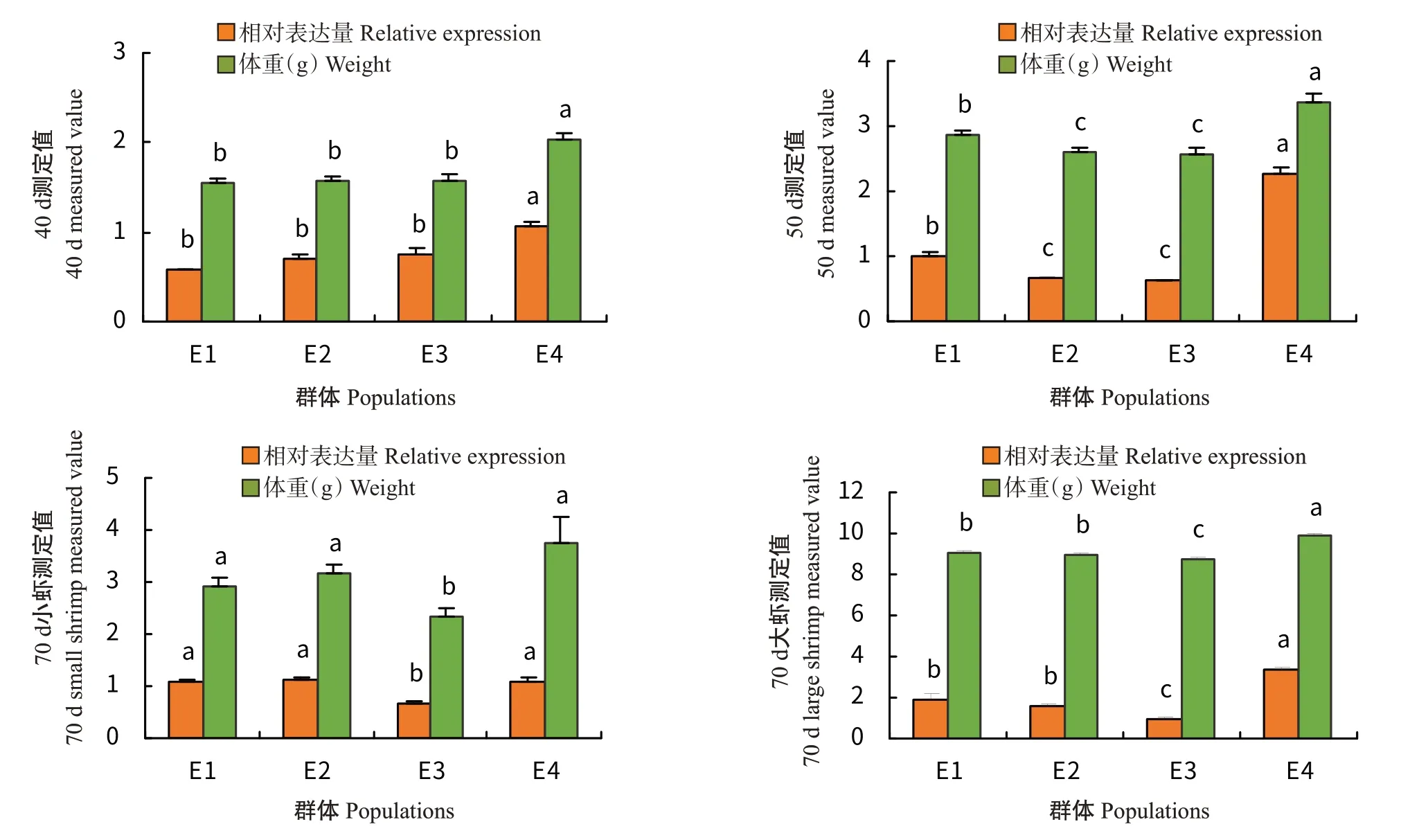
图9 不同家系群体凡纳滨对虾的体重及肠道中HDAC1基因相对表达量差异Fig.9 Weight of L.vannamei and relative expression of HDAC1 gene in the intestinal of different family populations of L.vannamei
3 讨论
凡纳滨对虾是我国对虾养殖产业中的主要养殖种类之一,但自白斑综合征(WSSV)在国内首次暴发以来,凡纳滨对虾养殖产业受到重创(张宗锋,2012)。随后,对虾养殖业又受到对虾桃拉综合症病毒(TSV)、传染性皮下及造血组织坏死病毒(IHH‐NV)和高致病性副溶血弧菌等病原微生物的影响,致使我国对虾的养殖产量大幅度下降(熊建华等,2011)。我国亲虾的来源严重依赖于从国外进口良种,对凡纳滨对虾后代的自主培育力度不够,迫切需要解决对虾种苗生产中存活率低、抗逆性差及生长周期长等关键问题(戴耀达等,2018)。目前,针对凡纳滨对虾淡水养殖的研究主要集中在养殖模式及疾病防控方面。樊慧敏等(2019)对凡纳滨对虾淡水养殖模式下甲壳溃疡症的致病原因及防控措施进行探究,发现气单胞菌是甲壳溃疡症的主要致病因素,并提出利用菌毒克进行消毒、内服恩诺沙星及调控虾池水质和虾肠肝健康的防控措施。徐婷婷等(2019)对明光市潘集镇利用女山湖水土塘成功养殖凡纳滨对虾的技术进行总结,为内陆水域凡纳滨对虾养殖提供了参考。Fan等(2019)通过对比分析淡水和海水养殖环境中凡纳滨对虾肠道和沉积物的微生物群落结构,发现对虾肠道和沉积物中的细菌组成基本相同,但细菌群落相对丰度存在明显差异。为选育出能替代进口种虾,且适应上海养殖气候和淡水养殖条件下能快速生长的凡纳滨对虾群体,本研究对4个家系群体进行70 d的淡水(盐度1‰)养殖试验,结果显示E4具有较优的生长性能,而E1(厄瓜多尔野生雄虾与引进雌虾杂交后代)和E2(引进雄虾与厄瓜多尔野生雌虾杂交后代)的生长性能相近,可能是由于E1和E2为相同2个群体正反杂交的后代。
Kelly等(2013)通过将HDACs与酵母蛋白Rpd3进行同源比对分析,可分为四大类共18个亚型,目前研究较多的是I类的HDAC1基因。本研究克隆获得凡纳滨对虾HDAC1基因cDNA序列全长3230 bp,共编码483个氨基酸残基,与NCBI上预测的序列相比多出13个氨基酸残基。凡纳滨对虾HDAC1蛋白具有1个保守结构域,推测该结构域在调控组蛋白去乙酰化过程中发挥关键作用。Qiu等(2006)研究发现,HDAC1有6个赖氨酸残基发生乙酰化,其中,2个赖氨酸的乙酰化(K218和K220)位于催化核心结构域附近,其他4个赖氨酸(K432、K438、K439和K441)位于C端区域。C端区域的缺失极大降低去乙酰化酶活性,因此该区域被认为是调控域。组蛋白去乙酰化酶活性降低主要是通过HDAC1乙酰化减弱其活性,并通过与HDAC1的二聚化反式抑制HDAC2活性(Kim et al.,2020)。HDAC1活性还可通过磷酸化进行调节,HDAC1被酪蛋白激酶II磷酸化的同时被丝裂原活化蛋白激酶磷酸酶-3(MKP-3)去磷酸化。这些位点的磷酸化对于组蛋白去乙酰化酶活性及HDAC1与辅抑制物复合物相互作用至关重要,磷酸酶处理并未显著影响体内的HDAC1活性。HDAC1磷酸化在G1阶段增加,在S/G2后期则显著降低(Kim et al.,2020),但目前尚未明确磷酸化的增加是否与细胞周期中HDAC1水平的增加有关,其他次要位点的磷酸化是否影响HDAC1功能也有待进一步阐明。凡纳滨对虾HDAC1蛋白三级结构中β-折叠处于平行排列,可能具有维持蛋白结构稳定的作用(张宁,2010)。
目前,已通过高通量测序技术获得凡纳滨对虾基因组序列,且分析发现内含子占基因组序列的绝大部分,但针对非编码区内含子序列及其功能的研究较少。本研究结果表明,HDAC1基因在凡纳滨对虾各组织中均有表达,且以肠道中的相对表达量最高,表明该基因可能参与凡纳滨对虾肠上皮细胞的分化过程。Tou等(2004)对哺乳动物HDAC1基因在控制器官发生过程中肠上皮分化中的作用进行研究,结果发现HDAC1基因参与调节哺乳动物肠上皮细胞分化。HDAC1基因在凡纳滨对虾脑组织中的相对表达量也较高,与HDAC1基因在果蝇(Das and Bhadra,2020)、斑马鱼(Kiyooka et al.,2020)的中枢神经系统及大脑发育过程中高表达的结论一致。此外,Lu等(2017)研究表明心脏中的HDAC1基因能促使骨髓间充质干细胞定向分化为心肌细胞;Kim等(2017)、陆颖等(2020)在哺乳动物和斑马鱼中发现HDAC1基因调节视网膜的发育。本研究结果显示,HDAC1基因在凡纳滨对虾心脏中也有较高的表达水平,故推测该基因在促进凡纳滨对虾生长发育方面发挥重要作用。
本研究是依据4个家系群体凡纳滨对虾的生长状态进行采样,以检验各时间点不同家系群体凡纳滨对虾在体长和体重方面是否存在显著差异。在养殖60 d时,4个家系群体的体长、体重显著差异分析结果与养殖40 d时的分析结果一致,而在养殖40、50和70 d时,4个家系群体凡纳滨对虾的体长、体重显著差异分析结果并不一致,因此只选择养殖40、50和70 d的4个家系群体凡纳滨对虾进行HDAC1基因表达分析。为进一步探究HDAC1基因是否参与凡纳滨对虾的生长过程,于养殖70 d时通过实时荧光定量PCR检测分析各家系群体中小虾、大虾肠道的HDAC1基因相对表达量,结果显示无论是大虾还是小虾,生长慢的群体中HDAC1基因相对表达量较低,生长快的群体中HDAC1基因相对表达量较高,即HDAC1基因相对表达量与凡纳滨对虾的生长速度成正比。
4 结论
凡纳滨对虾HDAC1基因在各组织中均有表达,以肠道中的相对表达量最高,且HDAC1基因相对表达量与凡纳滨对虾的生长速度成正比,故推测其参与凡纳滨对虾的生长调节过程。
