亚硝态氮慢性胁迫对凡纳滨对虾体成分和糖代谢的影响*
2020-11-03单洪伟李忠帅
肖 威 单洪伟 马 甡 李忠帅
(中国海洋大学 海水养殖教育部重点实验室 青岛 266003)
凡纳滨对虾(Litopenaeus vannamei)是我国主要甲壳动物养殖品种之一。2018 年,全国养殖产量为176 万t,为国内甲壳动物养殖总量的34.2% (国家统计局, 2019)。凡纳滨对虾高密度养殖期间,大量饲料的投入和粪便的排出,使水体中含氮废物含量不断提高(寇红岩等, 2014; Wang et al, 2019),其在亚硝化细菌的作用下很快转化成亚硝态氮,但能将亚硝态氮降解的硝化细菌却生长速度缓慢,最终导致水体中的亚硝态氮大量积累(姚艳玲等, 2018),在养殖后期,水中的亚硝态氮含量达到20 mg/L (Tseng et al, 2004)。水体中高浓度的NO2–会与Cl–以及其他阴离子争夺对虾鳃上的吸收位点(寇红岩等, 2014; Wang et al, 2016),通过血液运输在对虾体内各部分不断积累,一部分NO2–还会在对虾体内转化成NO3–、尿素和谷氨酸(Tsng et al, 2004)。
亚硝态氮(NO2–-N)胁迫会降低虾类血蓝蛋白载氧能力,是高浓度NO2–-N 对虾类产生毒性的主要原因(寇红岩等, 2014)。急性NO2–-N 胁迫会降低虾类的存活率(Lin et al, 2003; 寇红岩等, 2014),破坏虾类血细胞(郭慧等, 2015)、肝胰腺和鳃等组织结构(吕晓燕等,2010),降低虾类机体免疫力(Wang et al, 2004),增加虾类对病菌的易感性(黄翔鹄等, 2006; 葛红星等,2014),破坏虾类的正常代谢(Jiang et al, 2014)。研究表明,虾类长期生活在低浓度NO2–-N 环境中,有利于摄食能转化为生长能(朱其建等, 2014),并且在一定范围内,盐度越高,虾类对NO2–-N 耐受能力提高(Sowers et al, 2004; Furtado et al, 2016)。规格为10 cm的凡纳滨对虾在盐度17 和31 的海水中,NO2–-N 安全浓度分别为4.0 和8.9 mg/L(黄翔鹄等, 2006)。但目前关于NO2–-N 慢性胁迫对虾类影响的资料较少。
Ulaje 等(2019)研究表明,凡纳滨对虾应对环境胁迫会加快糖类的动员和储存。本研究关注凡纳滨对虾在NO2–-N 慢性胁迫下的存活率、生长情况、体成分、糖酵解和无氧代谢途径的变化,以期为凡纳滨对虾健康养殖提供参考。
1 材料与方法
1.1 实验用虾
实验所用的凡纳滨对虾购自山东省威海文登泰裕水产良种繁育有限公司。凡纳滨对虾初始体长为(5.71±0.38) cm,初始体重为(2.03±0.33) g,购回后驯养7 d。驯养期间,水温为26℃,盐度为29。每天定时投喂3 次人工配合饲料(主要成分:水分8.31%、粗蛋白43.50%、粗脂肪6.94%、灰分12.19%)。
1.2 实验设计与管理
通过预实验得知凡纳滨对虾96 h 半致死浓度(96 h-LC50)为150 mg/L NO2–-N,以该浓度的20%为慢性胁迫实验最高浓度组,等比例设计4 个浓度组:NO2–-N 浓度分别为0 (对照组)、8 mg/L(N8 组)、15 mg/L(N15 组)和30 mg/L(N30 组),进行持续36 d的NO2–-N 慢性胁迫实验。每个处理设6 个平行,其中,3 个平行用于取样,3 个平行用于记录摄食量和存活率。
实验在50 cm× 35 cm×35 cm 的玻璃水缸中进行,水体积为50 L,每个水缸(20 尾虾)为1 个平行实验。实验持续36 d,每天换水1/2~2/3,通过添加10 g/L NO2–-N 母液保持各组胁迫浓度。实验期间,各组实测NO2–-N 浓度分别为0~0.15(对照组)、7.31~8.12(N8 组)、14.13~15.45(N15 组)和28.92~32.23 mg/L(N30 组)。
实验期间,温度为26℃~27℃,pH 7.1~7.5,盐度为29,总氨氮≤0.70 mg/L,非离子氨≤0.03 mg/L,溶解氧≥5.95 mg/L。每天07:00、14:00 和22:00 投喂人工配合饲料,饱食投喂。
在投喂饲料前10 min,虹吸去除各组水体中的粪便,投喂1 h 后,虹吸收集各组剩余饲料于250 目筛绢中,用0.5 mol/L 的甲酸铵冲洗,再放入70℃烘箱中烘干至恒重。通过预实验测量出该饲料的含水量和在水中1 h 的溶失率,残饵量由饲料的溶失率和含水量校正得到(林继辉等, 2004)。每尾虾单日摄食量为投饵量和残饵量之差除以缸中生存对虾数量得出。
1.3 生长相关指标计算
式中,W0为凡纳滨对虾初始体重(g);Wt为凡纳滨对虾终末体重(g);T 为实验时间(d);N0为凡纳滨对虾的放养数量;Nt为凡纳滨对虾终末数量;F 为每只虾36 d 的总摄食量(g)。
1.4 对虾样品采集与分析
第1、3、6、12、24 和36 天随机从各组取6 尾凡纳滨对虾,用一次性注射器从凡纳滨对虾腹血窦处按血淋巴与抗凝剂(450 mmol/L NaCl, 10 mmol/L KCl,10 mmol/L Na2-EDTA, 10 mmol/L HEPES, pH 7.3)体积比为1∶3 的比例抽血(Vargas-Albores et al, 1993),抽出的血淋巴立即离心(4000 r/min, 10 min),取上清液,经液氮快速冷却后,放入–80℃超低温冰箱保存待测。取对虾肝胰腺和肌肉,同样经液氮快速冷却后放入–80℃超低温冰箱保存待测。第36 天,随机从各组取3 尾对虾,测量对虾全虾体成分。
凡纳滨对虾血糖、肝糖原、肌糖原含量;肝胰腺与肌肉中己糖激酶(HK)活性和丙酮酸激酶(PK)活性;肝胰腺中的乳酸含量和乳酸脱氢酶(LDH)活性测定均使用南京建成公司试剂盒,操作按照说明书进行。
全虾样品在105℃烘干至恒重来测定水分,粗蛋白采用凯氏定氮法测量,粗脂肪采用氯仿–甲醇抽提法测量,灰分采用550℃马弗炉灰化法测量。
1.5 数据处理
实验数据均采用平均数±标准差(Mean±SD)表示。分析之前测试数据的正态性(Shapiro-Wilk test)和方差齐性(Levene’s test),若数据不具有方差齐性,则对数据进行lg 转化并进一步测试。采用Tukey 多重比较检验对符合正态分布和方差齐性的数据进行单因素方差分析(One-way ANOVA)。对于不符合正态分布及lg 转化后仍不具有方差齐性的数据采用非参数检验,并通过Kruskal-Wallis 测试进行显著性差异分析。P<0.05 表示各组数据差异显著。
2 结果
2.1 亚硝态氮慢性胁迫对凡纳滨对虾生长和成活率的影响
NO2–-N 慢性胁迫对凡纳滨对虾存活率、生长和摄食的影响见表1。从表1 可以看出,凡纳滨对虾的存活率随着NO2–-N 浓度升高而降低,且N30 组显著低于对照组(P<0.05)。各组的终末体重、特定生长率和相对增重率均随着 NO2–-N 浓度上升而显著下降(P<0.05),其中,N15 组和N30 组之间没有显著差异(P>0.05),N30 组的特定生长率和相对增重率分别仅为对照组的48.55%和29.68%。日摄食率和饲料转化率随着NO2–-N 浓度上升而下降,其中,N30 组的日摄食率是对照组日摄食率的66.20%。
2.2 亚硝态氮慢性胁迫对凡纳滨对虾体成分的影响
NO2–-N 慢性胁迫对凡纳滨对虾体成分的影响见表2。从表2 可以看出,凡纳滨对虾的水分和对虾干重的粗蛋白含量随着NO2–-N 浓度上升而上升,但各组之间没有显著差异(P>0.05);N30 组的粗脂肪含量显著低于对照组(P<0.05);各胁迫组灰分均与对照组无显著差异(P>0.05)。

表2 亚硝态氮慢性胁迫对凡纳滨对虾体组分的影响Tab.2 Effects of chronic nitrite nitrogen stress on body composition of L. vannamei
2.3 亚硝态氮慢性胁迫对凡纳滨对虾的糖代谢途径关键酶活力和物质含量的影响
NO2–-N 慢性胁迫对凡纳滨对虾血糖影响见图1。从图1 可以看出,第1 天,胁迫组的血糖浓度出现了下降的趋势;第12 天,N15 组的血糖浓度显著高于对照组(P<0.05);第24 天,N8 组的血糖浓度显著高于对照组(P<0.05),说明N8 和N15 组血糖浓度在胁迫期间呈先下降再上升的趋势,但最终在36 d 再次下降至显著低于对照组(P<0.05)。而在胁迫期间,N30组的血糖浓度一直显著低于对照组(P<0.05)。
NO2–-N 慢性胁迫对凡纳滨对虾的肝胰腺和肌肉中糖原含量的影响见图2 和图3。第1 天,各组间的肝胰腺中糖原含量保持相对稳定,各组之间没有显著差异(P>0.05);第3 天,N8 组肝胰腺中糖原含量显著高于对照组(P<0.05);第6 天,N15 与N30 组的肝胰腺中糖原含量显著高于对照组(P<0.05);第36 天时,胁迫组的肝胰腺中糖原含量显著低于对照组(P<0.05),说明胁迫组肝胰腺中糖原含量的变化趋势与N8 组和N15 组的血糖含量变化趋势相同。而在实验期间,胁迫组对虾肌肉中糖原含量始终显著低于对照组(P<0.05)。

图1 亚硝态氮慢性胁迫期间凡纳滨对虾血糖浓度的变化Fig.1 Changes of blood glucose concentration of L. vannamei during chronic nitrite stress
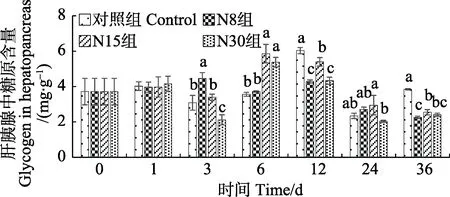
图2 亚硝态氮慢性胁迫期间凡纳滨对虾肝胰腺中糖原含量的变化Fig.2 Changes of glycogen in hepatopancreas of L. vannamei during chronic nitrite stress

图3 亚硝态氮慢性胁迫期间凡纳滨对虾肌肉中糖原含量的变化Fig.3 Changes of glycogen in muscle of L. vannamei during chronic nitrite stress
NO2–-N 慢性胁迫对凡纳滨对虾的肝胰腺己糖激酶活力影响见图4。第6 天后,N8 组和N15 组的己糖激酶活力与对照组相比无显著差异(P>0.05),但N30 组的己糖激酶活力一直高于对照组,且其肝胰腺中的己糖激酶活力在第 36 天时显著高于对照组(P<0.05)。NO2–-N 慢性胁迫对凡纳滨对虾的肝胰腺丙酮酸激酶活力影响见图5。从图5 可以看出,第1 天,胁迫组肝胰腺丙酮酸激酶活力显著高于对照组(P<0.05);第6 天后,其活力随NO2–-N 浓度升高而升高,且N30 组的丙酮酸激酶活力始终显著高于对照组(P<0.05)。

图4 亚硝态氮慢性胁迫期间凡纳滨对虾肝胰腺己糖激酶活力的变化Fig.4 Changes of HK activity in hepatopancreas of L. vannamei during chronic nitrite stress

图5 亚硝态氮慢性胁迫期间凡纳滨对虾肝胰腺丙酮酸激酶活力的变化Fig.5 Changes of PK activity in hepatopancreas of L. vannamei during chronic nitrite stress
NO2–-N 慢性胁迫对凡纳滨对虾的肌肉己糖激酶活力影响见图6。胁迫组肌肉中的己糖激酶活力先升高后降低,但除了胁迫开始的第1 天,胁迫组的己糖激酶活力均低于对照组,且在实验期间各组之间无显著差异(P>0.05)。NO2–-N 慢性胁迫对凡纳滨对虾的肌肉丙酮酸激酶活力影响见图7。NO2–-N 胁迫使肌肉中的丙酮酸激酶活力提高,最终在第36 天胁迫组都高于对照组。
NO2–-N 慢性胁迫对凡纳滨对虾的肝胰腺乳酸脱氢酶活力影响见图8。从图8 可以看出,肝胰腺乳酸脱氢酶活力呈先上升后下降的趋势。第1 天,各组肝胰腺中乳酸脱氢酶活力无显著差异(P>0.05),随时间的延长,胁迫组肝胰腺的乳酸脱氢酶活力提高,且N30 组的乳酸脱氢酶活力显著高于对照组(P<0.05)。第24 天后,胁迫组肝胰腺的乳酸脱氢酶活力下降,且在36 d 时,各组无显著差异(P>0.05)。NO2–-N 慢性胁迫对凡纳滨对虾的肝胰腺中乳酸含量影响见图9。NO2–-N 胁迫会提高凡纳滨对虾肝胰腺中的乳酸含量,N30 组肝胰腺中乳酸含量显著高于对照组(P<0.05),但在36 d 时,各组的乳酸含量无显著差异(P>0.05)。

图6 亚硝态氮慢性胁迫期间凡纳滨对虾肌肉己糖激酶活力的变化Fig.6 Changes of HK activity in muscle of L. vannamei during chronic nitrite stress
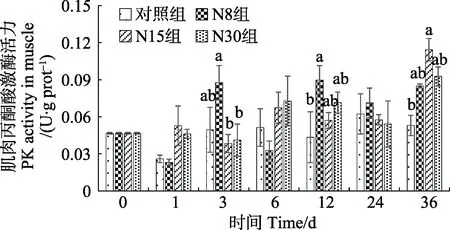
图7 亚硝态氮慢性胁迫期间凡纳滨对虾肌肉丙酮酸激酶活力的变化Fig.7 Changes of PK activity in muscle of L. vannamei during chronic nitrite stress

图8 亚硝态氮慢性胁迫期间凡纳滨对虾肝胰腺乳酸脱氢酶活力的变化Fig.8 Changes of LDH activity in hepatopancreas of L. vannamei during chronic nitrite stress

图9 亚硝态氮慢性胁迫期间凡纳滨对虾肝胰腺乳酸含量的变化Fig.9 Changes of lactic acid content in hepatopancreas of L. vannamei during chronic nitrite stress
3 讨论
3.1 亚硝态氮慢性胁迫对凡纳滨对虾存活和生长的影响
水体中NO2–-N 通过鳃丝进入对虾体内,且随着时间的延长在机体内各部位积累,影响对虾的代谢,最终降低对虾的存活率(Li et al, 2019)。在NO2–-N 慢性胁迫期间,凡纳滨对虾活动减少,摄食率随着NO2–-N 浓度上升而显著下降,在36 d 后,对虾的生长指标和存活率均随着NO2–-N 浓度上升而显著下降。提示NO2–-N 慢性胁迫会显著降低对虾的存活率和生长速度,且降低程度与NO2–-N 水平呈正相关。
3.2 亚硝态氮慢性胁迫对凡纳滨对虾体成分的影响
在环境胁迫下,虾类体内代谢加强,某些营养物质会耗竭或者合成受阻(于赫男, 2007; 鞠波, 2014)。为了满足NO2–-N 急性胁迫引起的虾类对能量需求的增长,日本沼虾(Macrobrachium nipponense)对氨基酸的利用可能比体内的脂质代谢起到更重要的作用(Jiang et al, 2014);同时,凡纳滨对虾在慢性氨氮胁迫中,粗脂肪含量随着胁迫浓度升高而下降,但粗蛋白含量却随着胁迫浓度升高而升高(曾庆婷等, 2016)。本研究发现,在NO2–-N 慢性胁迫下,随着NO2–-N 胁迫浓度增大,凡纳滨对虾粗蛋白含量几乎没有发生变化,但对虾的粗脂肪含量显著下降,提示凡纳滨对虾对脂质的利用在应对NO2–-N 慢性胁迫中起重要作用。
3.3 亚硝态氮慢性胁迫对凡纳滨对虾糖代谢的影响
在适宜的生长环境中,动物的血糖浓度处于相对稳定的状态,而当动物遭遇环境胁迫时,机体会迅速将糖原分解为葡萄糖以满足其对营养物质和能量需求(李莉, 2011)。在NO2–-N 慢性胁迫前期,胁迫组的凡纳滨对虾肌肉中糖原迅速降低以支持体内的代谢需求,而在中期,胁迫组的血糖和肝胰腺中糖原含量却存在提高的现象。研究发现,处于长期饥饿中的日本囊对虾(Penaeus japonicus)(Hong et al, 2009)和处于被农药敌百虫污染环境中的罗氏沼虾(Macrobrachium rosenbergii)(Chang et al, 2006)的血糖与肝胰腺中的糖原含量也出现上升的情况,且最终含量低于对照组,本研究存在相似现象。推测是因为对虾肌肉中糖原的分解转运和体内糖原异生途径的增强,使血糖和肝糖原在 NO2–-N 慢性胁迫中保持稳定与提高。在NO2–-N 急性胁迫下,甲壳动物的血糖含量在实验期间始终高于对照组(Hong et al, 2009; Jiang et al, 2014;Li et al, 2019)。但本研究发现,在NO2–-N 慢性胁迫中,凡纳滨对虾体内的血糖和糖原含量最终均低于对照组,提示在NO2–-N 慢性胁迫下,虾类体内的糖原含量和血糖含量持续被消耗,最终已经不能满足体内对能量增长的需求。
NO2–-N 会使凡纳滨对虾的血蓝蛋白转变为脱氧血蓝蛋白和变性血蓝蛋白,导致凡纳滨对虾血淋巴载氧能力下降,使对虾处于缺氧的状态(寇红岩等, 2014;Wang et al, 2019),而当对虾处于缺氧状态和抵抗环境胁迫时,就会增强细胞质中的糖酵解途径得到丙酮酸,最终获得更多能量来满足机体需求(郭彪等, 2008;李英等, 2012; 贾旭颖等, 2014; Wang et al, 2016; Shan et al, 2019)。己糖激酶和丙酮酸激酶都是糖酵解反应中重要的限制酶,而肌肉和肝胰腺是甲壳动物进行糖酵解的主要场所(郭彪等, 2008; 戴超等, 2014)。本研究表明,在NO2–-N 慢性胁迫下,凡纳滨对虾肝胰腺中的糖酵解途径增强,而肌肉中的糖酵解途径因为己糖激酶活力的降低而被抑制。在非离子氨慢性胁迫中,凡纳滨对虾肌肉中的己糖激酶和丙酮酸激酶也出现下降的现象(贾旭颖等, 2014),提示在NO2–-N 慢性胁迫中,凡纳滨对虾可能通过加强肝胰腺中的糖酵解途径来获得更多的能量,而肌肉并不作为主要的糖代谢场所。但在慢性胁迫的后期,血糖和肝胰腺中糖原的含量已经消耗殆尽,肝胰腺中的糖酵解途径无法产生足够的能量与物质来满足凡纳滨对虾体内代谢,此时,源于脂类代谢供能则可能起到一定作用。
乳酸脱氢酶是生物体内的无氧代谢标志酶,乳酸脱氢酶能将丙酮酸反应成乳酸,并获得少量的能量(贾旭颖等, 2014; 连春盎等, 2017)。在亚硝态急性氮胁迫下,甲壳动物体内的乳酸脱氢酶活力和乳酸含量在胁迫期间始终显著高于对照组(Hong et al, 2009;Jiang et al, 2014)。本研究中,胁迫组的乳酸脱氢酶先上升后下降,最终在养殖实验36 d 结束时,各组的乳酸脱氢酶活力没有显著性差别,同时,各组肝胰腺中的乳酸含量有相同的趋势,表明NO2–-N 胁迫会在短期内加强凡纳滨对虾的无氧呼吸,但随着NO2–-N胁迫时间的延长,肝胰腺中的乳酸脱氢酶活力受到抑制,无氧呼吸减弱,产生的乳酸减少。以上研究结果表明,在NO2–-N 慢性胁迫前期,对虾通过加强体内无氧代谢途径以应对胁迫效应;而在胁迫后期,对虾无氧代谢供能减弱,其应对胁迫效应的供能途径可能发生改变。关于NO2–-N 慢性胁迫对对虾能量代谢途径的影响及其机制,还需进一步研究。
4 结论
NO2–-N 慢性胁迫会降低凡纳滨对虾的生长率和存活率。为了应对NO2–-N 胁迫,凡纳滨对虾会加强体内糖的无氧代谢途径来获取能量,应对胁迫效应。然而,在长期NO2–-N 胁迫下,对虾体内的血糖含量和糖原含量均被消耗殆尽,糖代谢已经不能为对虾应对胁迫效应提供充足的能量,同时,根据粗脂肪含量变化,表明凡纳滨对虾通过脂类代谢供能在应对NO2–-N 慢性胁迫过程中起到重要作用。
