SDF-1/CXCR4轴调控BMSCs定向分化修复大鼠急性脊髓损伤的研究
2019-01-16王志勇
何 宁,曾 云,王志勇,韩 珩,唐 冰,熊 敏
0 引言
急性脊髓损伤是指中枢神经系统受到严重创伤,主要临床表现为大小便完全失禁、运动功能完全丧失、患者的知觉丧失等。其发病机制主要是因为脊髓出现急性损伤使患者丧失大量的脊髓神经元,进而导致失去对脊髓的修复能力。并且神经元大量坏死也会产生空洞与胶质瘢痕,这些都会对轴突生长造成一定阻碍。因此,急性脊髓损伤在临床治疗中是非常棘手的问题[1]。骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSCs)是临床中最早发现的、在临床中比较常用的间充质干细胞,其不仅具有强大的增殖能力,而且具有多向分化潜能,BMSCs已成为软骨组织工程中重要的种子细胞[2]。在此次研究中,笔者对急性脊髓损伤模型大鼠移植SDF-1/CXCR4轴调控后定向分化的BMSCs进行研究,观察急性脊髓损伤模型大鼠的修复情况,以评价SDF-1(Stromal cell-derived factor-1,基质细胞衍生因子-1)/CXCR4(CXC chemo-kine receptor 4,CXC趋化因子受体4)轴对BMSCs的调控效果及定向分化后的BMSCs对急性脊髓损伤模型大鼠的治疗效果,分析其临床应用的合理性,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年雄性SD大鼠60只,由湖北省实验动物中心提供,大鼠体重(221.34±21.41) g。
1.1.2 所需试剂 骨髓间充质干细胞液体培养基(购自北京达科为生物技术有限公司);CXCR4阻断剂AMD3100(购自美国Ab Mole公司);RNA提取试剂盒(购自北京博凌科为生物技术有限公司);RT-PCR试剂盒(购自北京博迈德生物技术有限公司);SDS-PAGE 凝胶电泳试剂盒(购自上海生工生物有限公司);反转录试剂盒(购自德国Thermo scientific公司);胎牛血清(购自浙江碧云天生物技术有限公司);Ficoll液(购自大连Takara生物有限公司);Rabbit Anti-SDF-1 antibody、Rabbit Anti- CXCR4 antibody、HRP标记羊抗兔二抗均购自Abcam公司;其他试剂为分析纯试剂。
1.1.3 主要仪器 Thermo ScientificTM8000细胞培养箱(购自德国Thermo有限公司);BHC-1360ⅡA/B3型生物安全柜(购自北京东联哈尔仪器制造有限公司);LegendTMXT/XF台式高速冷冻离心机(购自德国Thermo有限公司);ECLIPSE Ti型倒置显微镜(购自日本尼康公司);DZY-E5电转仪与DYY-6C型高压电泳仪(购自北京六一仪器厂);凝胶成像分析仪(购自苏净安泰公司);Nicolet多功能电生理仪(购自美国Nicolet公司);BD FACSVerse流式细胞仪(购自美国BD公司)。
1.2 方法
1.2.1 分组情况 随机将60只SD大鼠分为3组,分别为移植组、正常对照组和调控移植组,每组20只。所有大鼠构建急性脊髓损伤模型,移植组大鼠进行BMSCs移植,调控移植组大鼠移植SDF-1/CXCR4轴调控后的BMSCs。
1.2.2 大鼠急性脊髓损伤模型建立 借鉴文献[3]的研究方法,本文构建了大鼠的急性脊髓损伤模型,同时,大鼠损伤术后1 d运动功能评分为0分,表明模型构建成功,在构建急性脊髓损伤大鼠模型后第9天,对移植组和调控移植组大鼠运动功能评分<9的大鼠进行移植。
1.2.3 骨髓间充质干细胞制备、培养及鉴定 将BALB/c小鼠以颈椎脱臼法处死,在生物安全柜中取小鼠双侧股骨,使用剪刀将股骨骨髓腔剪开,使用培养基冲洗骨髓腔,使用移液器缓慢吹打混匀为细胞悬液,加入至Ficoll液上层,密度梯度离心后收集单个核细胞,加入含有10%胎牛血清的BMSCs液体培养基,在37 ℃恒温培养箱中培养,5% CO2条件下培养,细胞至80%~90%丰度(3~5 d),进行细胞传代。使用BD流式细胞仪对BMSCs进行鉴定,对BMSCs表面标志物CD29、CD34、CD45、CD90进行鉴定。
1.2.4 骨髓间充质干细胞SDF-1/CXCR4轴调控 在传代至第5代时,向一组BMSCs中加入CXCR4阻断剂AMD3100作用48 h,然后将原培养基弃去,加入PBS溶液冲洗3次,加入新的含有10%胎牛血清的BMSCs液体培养基。
1.2.5 骨髓间充质干细胞定向分化后移植 移植前确定各组大鼠运动功能评分,移植组和调控移植组运动功能评分<9的大鼠分别为13、15只。将两组符合要求的大鼠固定在脑脊髓立体定位仪上,暴露损伤区域,对照组大鼠同样选择与损伤模型同样区域,将5×105个BMSCs加入至5 μl的氯化钠溶液(0.9%)中,利用微注射系统把细胞悬液注射到大鼠脊髓损伤中心部位的空洞中,注射深度为1 mm,注射速度为1 μl/min,对照组大鼠注射5 μl的 0.9%氯化钠溶液。三组大鼠在移植前及移植后,每天均按照10 mg/kg剂量皮下注射环孢素A进行免疫抑制治疗。
1.2.6 运动功能评分 对各组大鼠建模前及移植BMSCs后6周、12周分别进行运动功能评分,评分总分为21分,主要观察各组大鼠后肢的运动、躯干位置及稳定性、步态、协调性,爪的置放,足趾间隙及尾的位置,以显示脊髓损伤后大鼠后肢运动功能恢复情况。三组所有大鼠均由同一实验人员观察、记录。
1.2.7 运动诱发电位的检测 采用Nicolet 多功能电生理仪在各组大鼠建模前及移植BMSCs后6周、12周,分别对运动诱发电位进行检测,无菌环境中切开大鼠的背部皮肤,将刺激电极插入到T5-6椎间隙。将参考电极插入到棘旁肌,在后肢腓肠肌插入两根记录电极,以强度5 mA、频率1 Hz的单方波脉冲刺激大鼠椎间隙。最终评价指标为损失上下方的波幅差值与潜伏期差值,损失上下方的运动诱发电位差值越小,说明具有更好的传导功能[4]。
1.2.8 RT-PCR检测SDF-1及CXCR4 mRNA的表达 在生物安全柜中将大鼠海马组织剥离,使用RNA提取试剂盒提取总RNA,使用反转录试剂盒对获得的RNA进行反转录,然后选GAPDH为内参,利用RT-PCR检测BMSCs中SDF-1及CXCR4的表达情况。
1.2.9 Western blot检测SDF-1、CXCR4蛋白表达 加入裂解液后,提取大鼠海马组织总蛋白,采用Western blot 检测SDF-1及CXCR4的蛋白表达情况,首先进行SDS-PAGE凝胶电泳,切下有目的条带的凝胶后,电转移至PVDF膜上,封闭后加入一抗作用8 h,冲洗后加入二抗作用2 h。冲洗后使用显色试剂盒进行显色。采用Bandscan软件对获得的图片进行灰度值分析,以评价SDF-1、CXCR4蛋白表达水平。
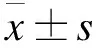
2 结果
2.1 BMSCs鉴定情况 采用BD流式细胞仪对获得的BMSCs表面标志物进行鉴定,结果显示,CD34、CD45为阴性,而CD29、CD90的阳性率>95%,见图1。
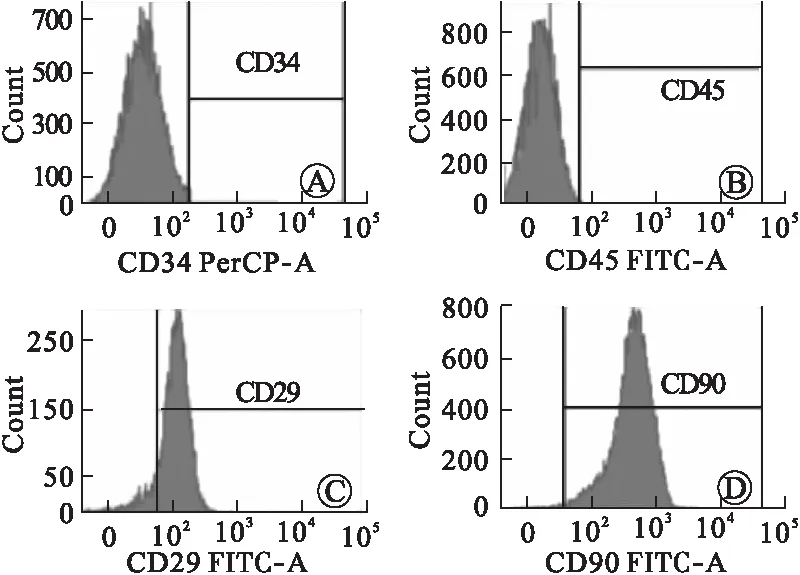
图1 BMSCs流式细胞术鉴定情况
2.2 SDF-1、CXCR4 mRNA的表达情况 采用RT-PCR对三组移植前及移植后6周、12周大鼠海马组织中SDF-1、CXCR4 mRNA的表达情况进行检测,结果显示,三组大鼠移植前SDF-1、CXCR4 mRNA的表达量比较差异无统计学意义(P>0.05),在移植SDF-1/CXCR4轴调控的BMSCs后,调控移植组大鼠SDF-1、CXCR4 mRNA的表达量明显下降,而移植组大鼠在移植BMSCs后,SDF-1、CXCR4 mRNA的表达量无明显下降,其中调控移植组大鼠在移植SDF-1/CXCR4轴调控的BMSCs移植6周、12周后,SDF-1、CXCR4 mRNA的表达量与对照组比较差异有统计学意义(P<0.05),见图2。
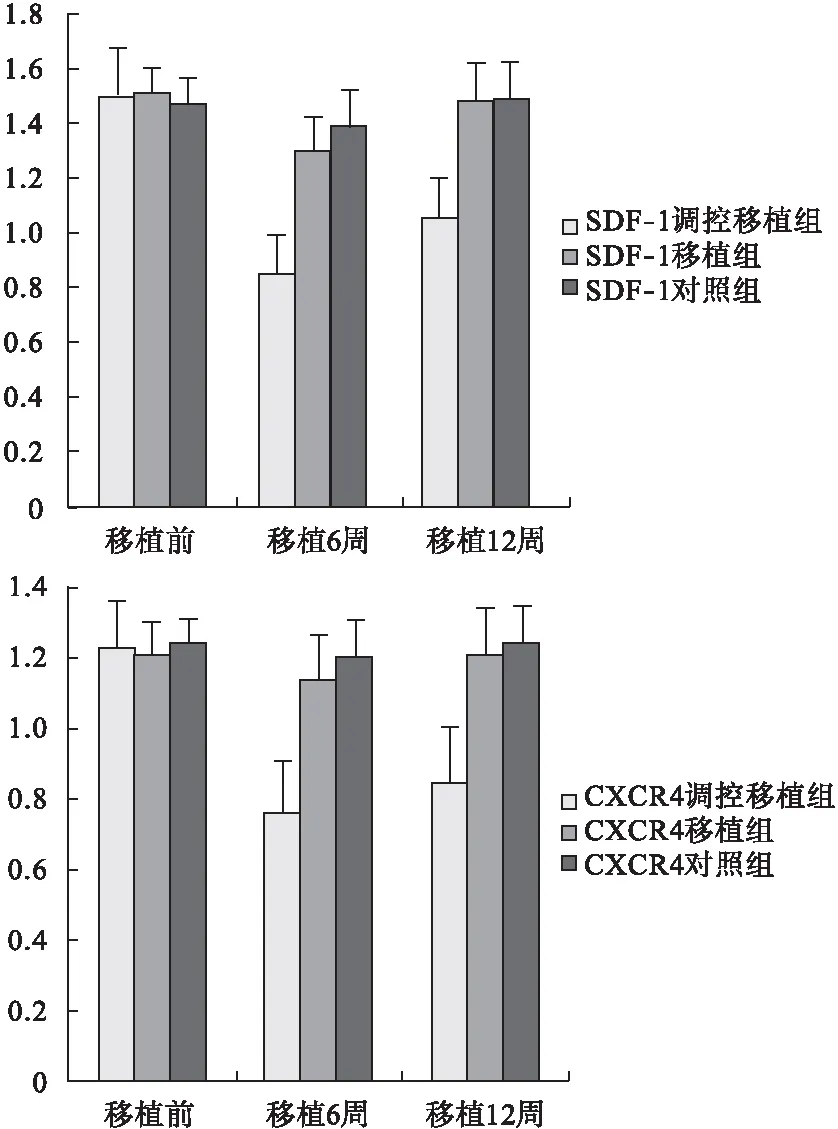
图2 SDF-1、CXCR4 mRNA的表达情况
2.3 SDF-1、CXCR4蛋白的表达情况 采用Western blot对三组移植前、移植后6周、12周大鼠海马组织中SDF-1、CXCR4蛋白的表达情况进行检测,结果显示,三组大鼠移植前SDF-1、CXCR4 蛋白的表达量比较差异无统计学意义(P>0.05),调控移植组大鼠在移植SDF-1/CXCR4轴调控的BMSCs后,SDF-1、CXCR4 蛋白的表达量明显下降,而移植组大鼠在移植BMSCs后,SDF-1、CXCR4 蛋白的表达量未明显下降,其中调控移植组大鼠在移植SDF-1/CXCR4轴调控的BMSCs后6周、12周,SDF-1、CXCR4蛋白的表达量与对照组比较差异有统计学意义(P<0.05),见图3。

图3 SDF-1、CXCR4蛋白的表达情况
2.4 运动功能评分情况 移植前,调控移植组、移植组大鼠运动功能评分与对照组比较差异有统计学意义(P<0.05)。移植后,调控移植组、移植组大鼠运动功能评分明显升高(P<0.05),但仍低于对照组,差异有统计学意义(P<0.05),调控移植组大鼠运动功能评分高于移植组(P<0.05),见表1。
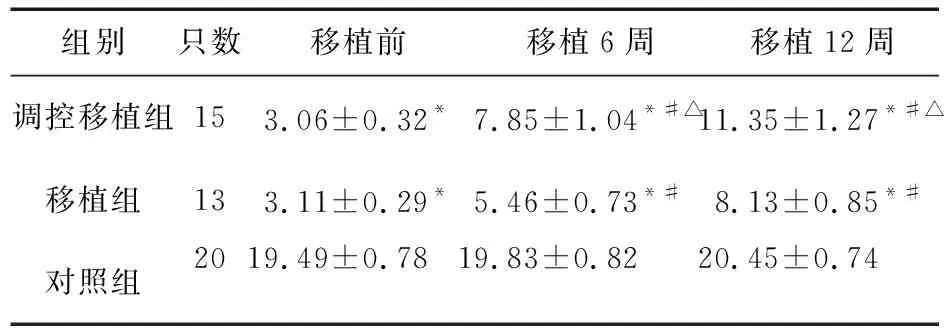
表1 三组大鼠运动功能评分情况
注:与对照组比较,*P<0.05;与移植前比较,#P<0.05;与移植组比较,△P<0.05
2.5 运动诱发电位情况 移植前,调控移植组、移植组大鼠诱发电位潜伏期差值与对照组比较差异无统计学意义(P>0.05)。移植后,调控移植组、移植组大鼠诱发电位潜伏期差值升高(P<0.05),且高于对照组(P<0.05),调控移植组大鼠诱发电位潜伏期差值高于移植组(P<0.05)。见表2。
对三组大鼠移植前、移植后诱发电位波幅差值情况进行统计。结果显示,移植前,调控移植组、移植组大鼠诱发电位波幅差值与对照组比较差异无统计学意义(P>0.05)。移植后,调控移植组大鼠移植后诱发电位波幅差值升高(P<0.05),且调控移植组大鼠诱发电位波幅差值高于对照组、移植组(P<0.05),见表3。
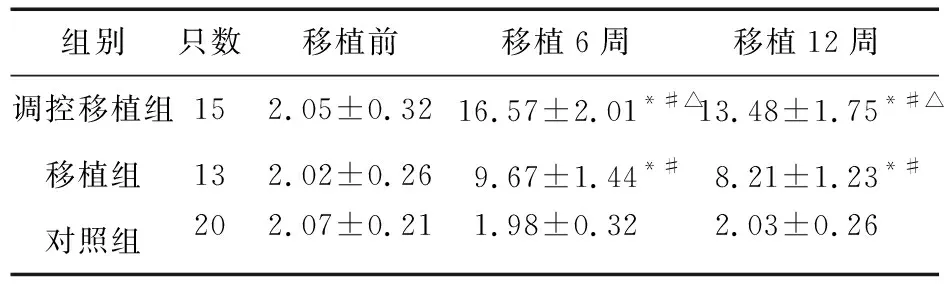
表2 三组大鼠诱发电位潜伏期差值情况
注:与对照组比较,*P<0.05;与移植前比较,#P<0.05;与移植组比较,△P<0.05
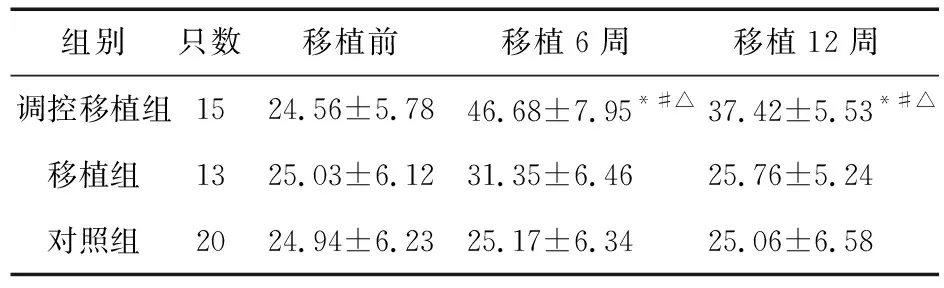
表3 三组大鼠诱发电位波幅差值情况
注:与对照组比较,*P<0.05;与移植前比较,#P<0.05;与移植组比较,△P<0.05
3 讨论
急性脊髓损伤的致残率与死亡率很高,对患者的生活质量产生了很大的影响[5]。现代医学研究认为,引起急性脊髓损伤肢体功能性障碍的主要原因之一是继发性损伤,其机制主要包括血栓的形成、血管痉挛、水肿、微循环障碍、自由基的形成以及兴奋性氨基酸生成等[6-8]。
目前,很多研究者认为,MSCs移植能否修复脑损伤与SDF-1及CXCR4轴存在密切关系[9]。CXCR4、SDF-1在细胞核多种组织中均存在,人体内SDF-1、CXCR4摘除会导致胃肠道、小鼠小脑及造血系统发育出现异常而引起胚胎在早期死亡[10]。在MSCs诱导分化为成骨细胞时,阻断CXCR4、SDF-1信号能够抑制骨形成蛋白2的诱导[11]。因此,在干细胞的迁移过程中,CXCR4、SDF-1具有重要作用,其在干细胞分化、组织器官再生方面都起到了明显作用。
人体的神经细胞死亡需要正常的神经元进行替代,运动神经元、中间神经元及其他脊髓神经元都是如此[12]。传统的医学理论认为,神经细胞出现死亡就无法进行再生,患者在治疗过程中主要以化疗、抗炎及保护细胞为主,主要是最大可能地保护残存的细胞组织,阻止细胞损伤的扩大,阻止病情的进一步发展。而干细胞或前体细胞的治疗则可以重建中枢神经系统的结构和功能[13]。
间充质干细胞在适宜环境中能够分化成神经外胚层与中胚层细胞,即间充质干细胞具有可再生性。研究者将MSCs注射到新出生小鼠的侧脑室,研究结果显示,整个小脑与前脑都出现MSCs 迁移,海马与纹状体中,MSCs呈现为GFAP,已分化成星形胶质细胞;而在嗅球、嗅觉小岛、小脑内颗粒层存在大量MSCs,不仅表达为巢蛋白(Nestein),还会表达神经细胞的特异性表面标记NSE、特异性核蛋白及神经元中丝蛋白,分化成神经细胞[14]。相关研究表明,通过移植rMSCs,能够对大鼠缺氧缺血性脑损伤的恢复起到促进作用。因此,对于神经系统疾病,可以利用MSCs替代原来受损或功能缺陷的神经组织进行治疗[15]。
研究结果显示,SDF-1/CXCR4轴在组织器官再生、干细胞分化中的作用不可低估,在 MSCs诱导分化为成骨细胞时,SDF-1借助细胞内MAPK与Smad信号通路对 BMP2 表达起到促进作用,同时诱导MSCs分化为成骨细胞。并且,SDF-1在人体神经系统的发育过程中具有不可替代的作用,在神经元生长、增殖等方面,CXCR4与SDF-1信号通路发挥明显作用,在神经元分化、MSCs增殖及轴突过程中发挥明显作用。然而,从当前研究成果来看,在MSCs分化与增殖过程中,SDF-1/CXCR4 轴的作用机制还不能完全确定[16]。
本研究表明,采用CXCR4阻断剂对BMSCs进行SDF-1/CXCR4 轴调控后可以促进BMSCs定向分化,在移植至急性脊髓损伤模型大鼠后,可以明显提高急性脊髓损伤模型大鼠运动功能评分及运动诱发电位情况,调控SDF-1/CXCR4轴后的BMSCs对急性脊髓损伤模型大鼠具有更好的修复效果,而SDF-1/CXCR4轴调控对BMSCs定向分化发挥重要的促进作用。
