B7-1、B7-2单抗对狼疮肾炎小鼠模型的免疫干预及机制研究
2019-01-16韩莲花沈立军邱玉华
韩莲花,沈立军,朱 莹,邱玉华
0 引言
系统性红斑狼疮(Systemic lupus erythematosus,SLE)属于临床上育龄女性发病率高于男性的自身免疫性疾病。SLE患者的免疫系统处于高度活跃状态,尤其是B淋巴细胞功能异常,体内产生多种自身抗体,自身抗原抗体结合而成的免疫复合物在机体的器官和组织沉积。这些免疫复合物的沉积可能造成各个脏器和组织发生不可逆的功能破坏和丧失,包括血管、皮肤、关节、心肺、肾脏等。SLE的具体发病机制尚未明确,与环境、内分泌等多方面因素有关。SLE的治疗主要以糖皮质激素、免疫抑制剂为主。但长期使用这些药存在多种不良反应,给患者带来了各种严重的并发症。因此,如何寻找有效、不良反应少的新的治疗方法一直是SLE的研究热点[1]。
B7分子是表达在抗原递呈细胞(APC),包括B淋巴细胞、树突状细胞、单核巨噬细胞等细胞表面的协同刺激分子,主要包括B7-1(CD80)及B7-2(CD86)。B7-1和B7-2分子都是跨膜糖蛋白,属于免疫球蛋白超家族成员,两者氨基酸序列有25%的同源性[2]。B7分子主要是和表达在T细胞表面的CD28/CTLA-4结合产生相应的作用,与CD28结合刺激T淋巴细胞活化,促进特异性T细胞的增殖、特异性细胞因子的分泌;而与CTLA-4结合则转导抑制性信号,终止T细胞活化[3]。机体在T细胞免疫应答中,如果缺乏B7/CD28共刺激信号,T 细胞可能进入无反应状态、免疫耐受,甚至是发生细胞凋亡。多项研究表明,B7/CD28 共刺激信号通路的过度活化与多种自身免疫性相关疾病的发生发展密切相关,如SLE 患者的细胞表面存在过度表达的B7-1和B7-2分子[4-5]。
1 材料与方法
1.1 主要材料 B7-1鼠源性单克隆抗体4E5、B7-2鼠源性单克隆抗体1D1均由本实验室研制。6~8周龄体重25~30 g的雌性BALB/c小鼠20只,雄性C57BL/J6小鼠10只(上海斯莱克实验动物中心)。ANA(抗核抗体),anti-dsDNA(抗双链DNA抗体)检测试剂盒(北京和杰创新生物有限公司);FITC羊抗小鼠IgG(cell signaling公司);尿蛋白(Albustix)检测试纸(美国Bayer公司)。荧光显微镜(日本OLYMPUS公司),低速离心机(Eppendorf公司),倒置显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1 cGVHD狼疮样小鼠模型的建立 雄性C57BL/J6×雌性BALB/c杂交F1代小鼠,取60只雌性F1代小鼠分成4组:正常对照组,模型组,B7-1干预组,B7-2干预组。模型建立方法参考本实验室相关试验[6]。B7-1干预组、B7-2干预组在淋巴细胞注射后的第1、3、5、8、15、30、60天,分别通过尾静脉注射B7-1单抗、B7-2单抗,每只小鼠注射抗体量为8 mg/kg,模型组在相同时间注射等剂量的小鼠Ig同型对照。
1.2.2 血清dsDNA、ANA的检测 各组实验小鼠每周眼眶采血1次,收集血清用于检测dsDNA、ANA。血清用PBS 1∶100稀释,dsDNA采用间接免疫荧光法检测:每个血清标本20 μl与抗原片室温避光孵育30 min,洗涤后加入抗dsDNA的荧光二抗20 μl,室温孵育30 min后,再次洗涤,封片后荧光显微镜下观察。抗dsDNA 抗体阳性时表现为均质或环状荧光,荧光为一大一小成对出现,阴性时四膜虫虫体内无荧光。ANA的检测通过HEp-2细胞片完成,将待测血清,阳性对照和阴性对照20 μl加到抗原片上,湿盒室温孵育30 min。然后浸泡至洗片缸内清洗,清洗后每孔滴加20 μl FITC-羊抗鼠抗体,湿盒室温孵育30 min。再浸泡清洗,最后滴加封片剂封片。荧光显微镜下观察结果。
1.2.3 实验小鼠尿蛋白的检测 各组实验小鼠每隔2周的清晨刺激留尿,将小鼠的新鲜尿液滴加到尿蛋白检测试纸的反应显色区。放置1 min后,显色区颜色发生改变,根据显色区颜色深浅和标准色带对比来判断蛋白尿的严重程度,根据标准色带将蛋白尿分为阴性(-)和5个阳性(±、+、++、+++、++++)级别。
1.2.4 实验小鼠肾脏组织HE染色 各组实验小鼠观察至12周全部处死,取出两侧肾脏,将其中一侧放于福尔马林中固定,切片,贴片,脱蜡,水化,HE染色,染色后再脱水,透明,最后用中性树胶封片,封片完置于病理显微镜下,观察肾脏组织肾小球形态的改变。
1.2.5 实验小鼠肾脏超微结构的改变 将实验小鼠的肾脏取出后,迅速切成立体小块(约1 mm×1 mm×1 mm),然后立即投入2.5%戊二醛固定液固定1 h,固定完用PBS漂洗3次,再放入1%锇酸固定液中固定1 h。浸泡入梯度丙酮进行脱水,每次10 min。将组织块包埋在多孔橡胶模板中,放入烤箱烘干至形成包埋块。对包埋好的组织进行切片,切好的组织片在醋酸铀溶液中染色2 h,封好的切片置于透射电镜下观察。
1.2.6 实验小鼠肾脏免疫复合物沉积情况 将肾脏组织放入4%多聚甲醛固定6 h,20%蔗糖组织沉底,OTC包埋冰冻组织块,切片,贴片,纯丙酮处理后风干。PBS洗涤3次后BSA室温封闭1 h,滴加FITC直标羊抗小鼠IgG避光4 ℃孵育过夜,第2天用PBS洗涤2次,样本上滴加防淬灭剂后封片,最后置样本于荧光显微镜下,观察沉积在肾脏组织的免疫复合物情况。
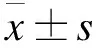
2 结果
2.1 血清dsDNA、ANA的表达变化 模型组小鼠第2周就能检测到dsDNA的表达,第4周能检测到ANA的表达。B7-1干预组第4周能检测到dsDNA的表达,第6周能检测到ANA的表达。B7-2干预组第6周能检测到dsDNA的表达,第8周能检测到ANA的表达。抗体滴度都低于模型组。见图1、图2。
2.2 尿蛋白的变化情况 在第8周,模型组有小鼠检测到阳性蛋白尿的发生,数量为50%,到第12周,所有模型组小鼠都检测到了蛋白尿(++~++++)。第12周,B7-1干预组和B7-2干预组小鼠也都检测到阳性蛋白尿,B7-1干预组有50%的小鼠检测到蛋白尿,尿蛋白含量+~++。B7-2干预组有40%的小鼠检测剂蛋白尿,尿蛋白含量+~++。见表1。

表1 12周各组小鼠尿蛋白程度
注:*与模型组比较,P<0.05
2.3 肾脏病理结构改变 模型组的肾脏组织切片可见组织结构发生较大的改变,基本结构破坏严重,肾小球内可见大量的炎性细胞浸润,肾小球的体积大于对照组,内皮细胞和系膜基质都发生不同程度的增生,从而导致肾小球囊腔发生狭窄甚至闭塞。B7-1干预组肾小球内有少许炎性细胞,肾小球体积轻微增大,毛细血管腔和肾小球囊腔未变窄。B7-2干预组肾小球内也有少许炎性细胞,肾小球体积轻微增大,毛细血管腔和肾小球囊腔结构未发生变窄情况,两组干预组的肾脏结构基本未发生破坏,病理改变较小。见图3。
2.4 肾脏超微结构改变 电子显微镜下可见,对照组肾小球超微结构正常,上皮细胞足突结构明显,基底膜厚度均匀。模型组上皮细胞足突消失,在脏层上皮和基底膜之间存在大量的驼峰状电子致密物,基底膜发生节段性增厚。B7-1干预组的脏层上皮和基底膜之间也发现少量电子致密物,基底膜厚度均匀,未见明显增厚部位。B7-2干预组脏层上皮和基底膜之间可见少量电子致密物,基底膜也未见明显增厚部位。见图4。
2.5 肾脏免疫复合物沉积 模型组小鼠的样本上可见多处颗粒状或线性的荧光,荧光能大致显示肾小球轮廓,主要聚集在肾小球毛细血管襻位置,提示有免疫复合物在肾小球部位沉积。B7-1干预组样本上也可见少量颗粒状荧光,但荧光的分布和强度都较模型组减弱。B7-2干预组也可见少量颗粒状荧光,荧光的分布和强度也明显弱于模型组。见图5。
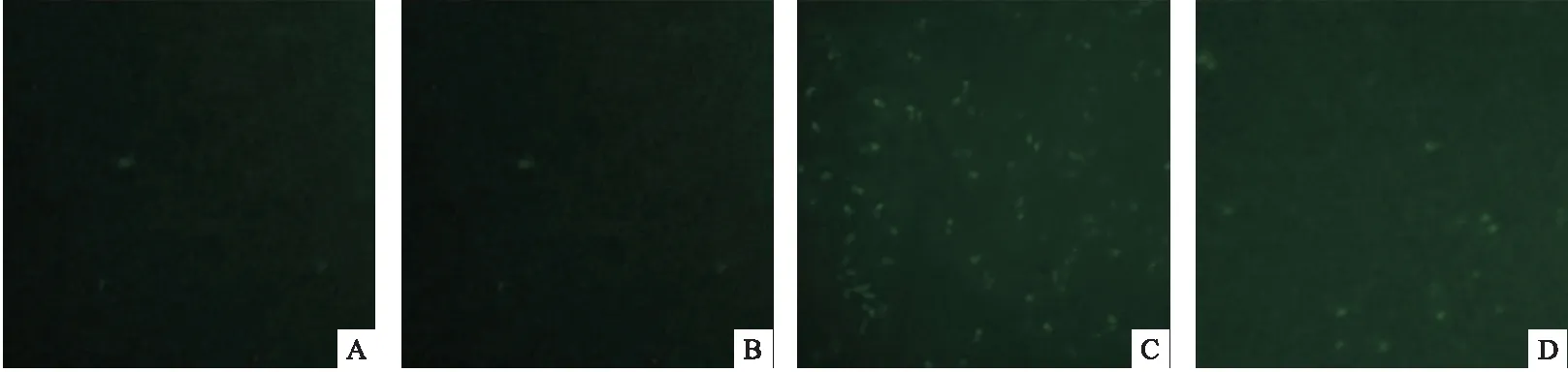
图1 各组小鼠12周时血清dsDNA的表达(400×)
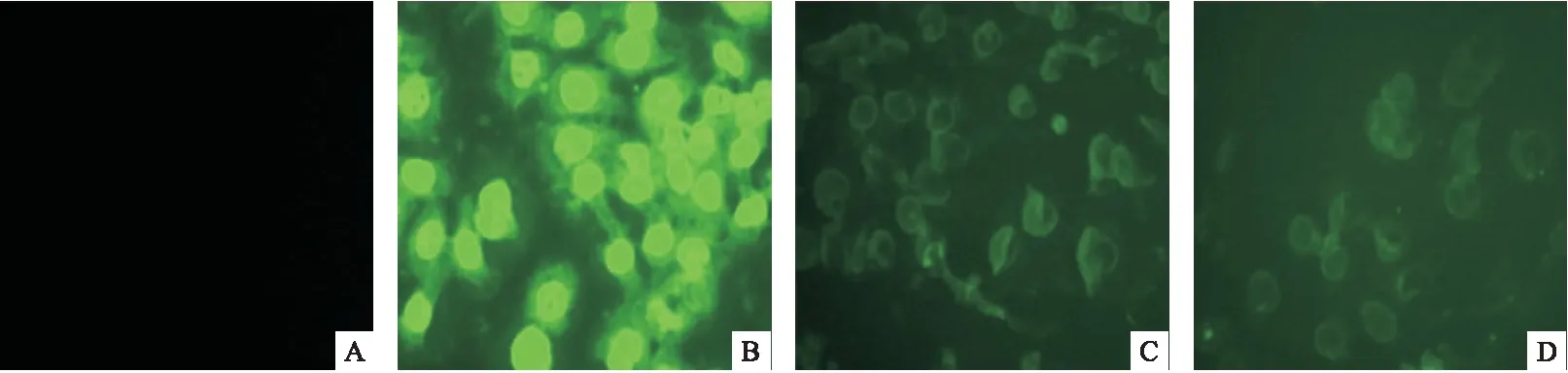
图2 各组小鼠12周时血清ANA的表达(400×)

图3 各组小鼠肾脏组织HE染色(400×)
图4 各组小鼠肾脏组织电镜下超微结构改变
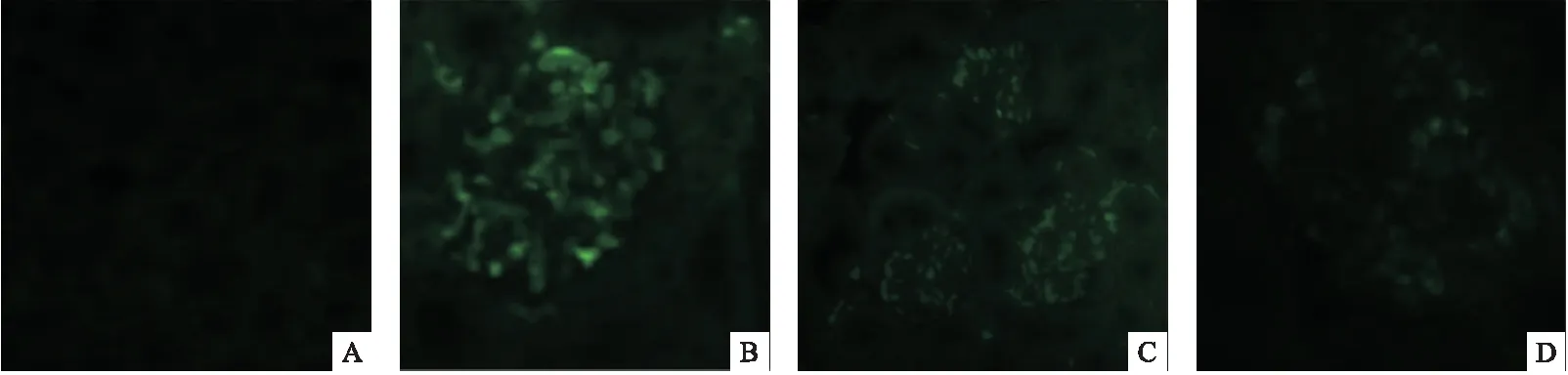
图5 各组小鼠肾脏免疫复合物沉积(400×)
3 讨论
机体在发生正常的免疫应答中,T淋巴细胞需要经过活化、增殖、分化才能发挥生物学效应,而生物学效应的发挥需要两个必要信号的参与:抗原肽-MHC复合体与T细胞受体结合的特异性信号和APC表面协同刺激分子与其受体结合的非特异性信号[7]。
B7分子是目前T细胞活化众多协同刺激分子中最重要的分子之一,主要与T细胞表面的CD28、CTLA-4结合,从而影响免疫应答过程细胞的分化[8-9]。B7和T细胞表面受体结合主要诱导CD4+T细胞向Th1细胞分化(分泌细胞因子IL-4、IL-5、IL-10等),以及CD8+T细胞向CTL分化;B7-2则主要诱导CD4+T细胞向Th2细胞分化以及分泌细胞因子IFN-γ、IL-2等[10]。
SLE患者细胞表面B7-1 和 B7-2分子均过度表达,不管是在静息还是活化的B细胞表面,SLE患者B7-2分子的表达都比正常人明显增多,而B7-1在静息B细胞上的表达和正常人没有显著差异,只在活化的B细胞上表达比正常人明显增多。Takasaki等[11]报道,B7-1和B7-2分子的过度表达不仅仅发生在B细胞表面,在CD3+T细胞表面的表达也增加。在SLE患者皮肤的皮损区、表皮和真皮上的APC细胞上也过度表达了B7-1和B7-2 分子。然而,应用激素治疗后,皮损区APC细胞上的B7-1和B7-2分子的mRNA和蛋白的表达都减弱甚至消失[12]。
B7-CD28信号通路参与了SLE的发生发展,并发挥重要作用。通过B7-1和B7-2的单抗来调控B7-CD28信号通路,改变T细胞的反应性,可以减轻SLE模型的过度免疫活化状态,减少自身抗体的产生,甚至可能消除SLE模型所发生的组织学变化[13-14]。Finck等[15]通过给NZB/NZW F1(B/W) SLE模型鼠注射了B7-1和B7-2的拮抗剂CTLA-4Ig,从而阻断了模型鼠自身抗体anti-dsDNA的产生,减轻了肾小球和肾间质病变,改善了肾炎症状。在 B7-1 和 B7-2 双敲除的 MLR-Fas/lpr模型小鼠中,小鼠的多种细胞因子如IFN-γ 及 IL-12 表达量均下降,自身抗体滴度也明显减少,SLE的各种症状得到缓解,蛋白尿消失,肾脏的病理损害减轻[16]。
本次研究对模型组小鼠分别使用B7-1、B7-2单克隆抗体进行干预治疗,在自身抗体、肾脏病理改变、蛋白尿的产生、肾小球免疫复合物沉积方面与模型组小鼠比较,都得到了一定程度的改善。同时,B7-1干预组、B7-2干预组治疗的结果并不完全相同。在自身抗体方面,B7-2抗体治疗组对自身抗体的抑制作用优于B7-1干预组。可能是因为B7-2主要参与Th2介导免疫抗体的产生,而SLE疾病正是由于出现了T细胞的异常分化,出现了过多的Th2细胞,从而辅助了抗体生成细胞的激活和增殖,使自身抗体异常分泌,自身抗体和自身抗原结合物造成了很多关节和组织的破坏[17-18]。
SLE患者的抗原提呈细胞表面高度表达B7-2,可能是患者的抗体生成细胞发生了过度激活和增殖,从而产生自身抗体的始动因素之一。因此,B7-2干预组对抗体生成细胞起到了特异性的抑制作用,因此延缓和减少了自身抗体的产生。自身抗体和抗原形成的免疫复合物会在全身各个部位沉积,肾脏是受损害最严重的器官,狼疮性肾炎是SLE患者最常发生和最严重的并发症,甚至是很多患者死亡的主要原因。B7-2治疗组通过减少自身抗体的产生减轻了肾脏病理损伤,延缓了小鼠狼疮性肾炎的发生发展。
B7-1干预和B7-2干预都降低了机体的早期免疫应答,减轻了肾脏的病理损伤。B7-2干预能更特异性地减少自身抗体的产生,因此对模型小鼠肾炎的发生发展有更好的延缓作用。阻断B7-CD28通路在一定程度上抑制了狼疮样肾炎小鼠的异常细胞免疫应答,可在一定程度上防治和改善疾病病情。关于SLE和其他自身免疫性疾病的研究还在进行中,通过减弱或阻断协同刺激分子介导机体免疫应答所必需的非特异性信号通路的治疗方法有望为SLE等自身免疫性疾病提供高效低毒的生物疗法。
