miR-10b和BDNF对山羊卵巢颗粒细胞活性的影响
2019-01-16魏金销谭旭信郭宏文郭利亚张晓建安小鹏曹斌云白跃宇
魏金销,张 月,方 芳,谭旭信,郭宏文,郭利亚,张晓建,安小鹏,曹斌云,白跃宇,,5*
(1.河南省种牛遗传性能测定中心,河南 郑州 450046;2.西北农林科技大学 动物科技学院,陕西 杨凌 712100;3.河南省畜产品质量监测检验中心,河南 郑州 450008;4.河南科技学院,河南 新乡 453003;5.河南省动物卫生监督所,河南 郑州 450008)
卵巢作为雌性动物的重要繁殖器官,能够直接决定繁殖性能的高低。在卵泡发育过程中,卵母细胞体积不断增大并逐步发育成熟,伴随这一过程的还有围绕它周围的颗粒细胞的增殖和分化。卵巢颗粒细胞是卵巢中的一种重要体细胞,它的生长发育受错综复杂的细胞信号系统调控,在促性腺激素等的调控下对卵泡发育有重要影响。目前研究表明许多卵巢外和卵巢内的因子参与了这一卵泡发育调控过程,如脑源性神经营养因子(brain-derived neuotrophic factor, BDNF)等[12]。
成熟的MicroRNAs (miRNAs)是一类长约20~24 nt的非编码单链RNA分子,主要通过转录后的调控方式抑制或促进基因表达[1]。miRNAs的作用机制主要有3种,即翻译起始抑制[2]、翻译起始后抑制[3-5]和靶mRNA降解[6-7]。在动物中,miRNAs结合位点通常位于靶mRNA的3'UTR区[8-9]。miRNAs主要通过与靶基因mRNA的3'UTR区不完全配对结合,调控许多生物学过程。大量研究表明miRNAs对动物卵巢、输卵管、子宫等与繁殖相关的组织器官的生长发育具有重要调节作用[10-11]。
继神经生长因子(nerve growth factor,NGF)发现后,Barde等[12]从猪脑中分离纯化到了第二种神经营养因子,即脑源性神经营养因子(BDNF)。BDNF与NGF、神经营养素-3 (neurotroph-3, NT-3)、NT4/5、NT-6和NT-7等同属于神经生长因子家族,又称神经营养素 (Neurotrophins, NTs)[13]。众所周知,BDNF调节感觉神经元、小脑神经元及髓前角运动神经元的存活和分化,对神经元的生长、分化和存活具有重要作用[14]。最近的研究表明,BDNF也在心血管、免疫、内分泌和生殖系统等非神经系统表达,BDNF及其受体在各发育时期的卵泡中也被发现,说明BDNF对除神经细胞以外的细胞也具有作用[15]。
越来越多的研究证明BDNF有助于卵泡发育,如促进卵泡颗粒细胞的增殖以及原始卵泡的生长,维持间质细胞的活性,诱导促卵泡素受体(FSHR)的产生[16]。BDNF及其受体酪氨酸蛋白激酶B(TrkB)可能是联系卵泡形成时卵母细胞与卵泡颗粒细胞的一种信号分子。Ojeda等[17]利用基因敲除方法研究BDNF对大鼠卵泡发育的影响,首次证明了BDNF及TrkB表达于人初级卵泡和次级卵泡的颗粒细胞,说明BDNF在早期卵泡的生成和发育中具有重要作用。生物信息学分析发现,miR-10b通过转录后的调控方式调节BDNF基因的表达,进而调节卵巢内颗粒细胞和卵母细胞的生长、分化以及细胞间的相互作用而影响早期卵泡的发育。
本研究拟从建立的多羔(3~5只)和单羔奶山羊发情期卵巢组织差异表达microRNA文库中筛选出差异表达显著的miR-10b,并利用生物信息学和实时定量PCR等技术研究miR-10b对BDNF的表达和卵巢颗粒细胞活性的影响,为提高奶山羊产羔率提供试验依据和理论基础。
1 材料与方法
1.1 质粒与细胞
本试验所用的奶山羊卵巢颗粒细胞采自杨凌屠宰场,新鲜屠宰的奶山羊卵巢组织浸入PBS中,在2 h之内带回试验室处理。pRL-TK载体由实验室保存,pGL3-Control载体购自美国Promega公司,pMDTM19-T Vector购自天根生化科技(北京)有限公司。
1.2 试剂及仪器
PCR试剂(Biotake公司)、miR-10b mimics和miR-10b control(广州锐博生物科技有限公司)、双荧光素酶检测试剂盒(美国Promega公司)、DMEM/F12、Opti-MEM○RI、胎牛血清(Gibco公司)、脑源性神经营养因子(BDNF)(PeppoTECH公司)、二甲基亚砜 (DMSO)、胰蛋白酶(Hyclone公司)、LipofectamineTM2000、青-链霉素、Real Time PCR试剂盒(上海Invitrogen公司)、一抗Rabbit Anti-FSHR(北京博奥森公司)、SABC-cy3兔免疫组化试剂盒(武汉博士德公司)、核酸染料(百泰克(北京)生物技术有限公司)、反转录试剂盒(PrimeScript RT Master Mix)、miRNA反转录试剂盒、SYBR Premix Ex TaqTMⅡ、T4 DNA连接酶、RNA提取试剂(RNAiso Plus)、XbaⅠ内切酶(Takara公司)、普通质粒小提试剂盒、琼脂糖凝胶回收试剂盒、E.coliDH5α感受态细胞、蛋白胨、酵母提取物、IPTG和X-gal和琼脂粉(Agar)(生工生物工程(上海)有限公司)、DNA marker(康为世纪生化科技有限公司)、琼脂糖(美国HydraGene公司)。
主要仪器有PCR扩增仪(96 Well,ABI公司)、实时定量仪(Bio-rad公司)、CO2培养箱(Thermo forma)、倒置显微镜(Nikon)、多标记微孔板检测仪(PerkinElmer)、常温高速离心机(Eppendorf)、低温冷冻离心机(Beckman)、凝胶成像仪(百晶生物)、稳压稳流电泳仪(北京六一)、恒温培养振荡器(SUNKUN公司)。
1.3 试验方法
1.3.1 miR-10b的差异表达与靶基因的预测 差异表达miRNAs文库和实时定量PCR验证由杭州联川生物技术有限公司完成。利用Targetscan(http://www.targetscan.org/index.html)、RNAhybrid (http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/)、Mirnaviewe (http://cbio.mskcc.org/cgi-bin/mirnaviewer/mirnaviewer.pl)和Pictar (http://pictar.mdc-berlin.de/cgi-bin/new)等在线预测软件对小鼠miR-10b靶基因进行预测。
由表6可知,饲喂复方阿胶浆药渣对驴心脏指数、肝脏指数、肺脏指数、脾脏指数、肾脏指数、胰脏指数及肠指数均没有显著影响(P>0.05);但驴胃指数显著低于对照组(P<0.05);脾脏指数和肝脏指数均有明显增加趋势(0.05<P<0.1)。
1.3.2BDNF3'UTR片段的克隆与BDNF3'UTR荧光素酶报告基因载体的构建 根据GenBank中牛BDNFmRNA全序列( GenBank号: NM_001046607) ,应用Primer Premier 5.0设计引物,通过PCR扩增BDNF3 'UTR全长,引物由上海生工生物工程股份有限公司合成,引物序列见表1。反应体系:2×Taq MasterMix 7.5 μL,靶基因上、下游引物各0.5 μL,cDNA 50 ng,DNAase-free dH2O到15 μL。反应条件:95 ℃预变性5 min;35个循环(94 ℃ 35 s,56 ℃ 30 s,72 ℃ 45 s);72 ℃延伸10 min。取2 μL回收的PCR产物和1 μL pMDTM19-T Vector按照说明书与5 μl Solution Ⅰ和2 μL dH2O混成10 μL体系。16 ℃连接30 min后,将连接产物转化涂板。37 ℃培养14 h后,挑取单克隆摇菌,通过菌液PCR鉴定并送至上海生工生物工程有限公司测序,测序结果用DNAstar软件和Blast(http://www.ncbi.nlm.nih.gov/blast/Blast)分析,验证片段的正确性。
利用XbaⅠ内切酶分别对提取得到的pGL3-control载体和pMD 19-3'UTR进行酶切。酶切体系:1 μLXbaⅠ、2 μL 0.1% BSA、2 μL 10×M Buffer、1 μL DNA和9 μL ddH2O,37 ℃恒温酶切3 h,胶回收。分别取10 μL目的片段、2 μL报告质粒回收产物、1 μL T4 DNA Ligase、2 μL 10×T4 DNA Ligase Buffer和ddH2O混成20 μL体系,16 ℃连接30 min。将连接产物转化涂板,PCR、测序鉴定阳性克隆。
1.3.3 细胞培养及转染 用含10% 胎牛血清的DMEM高糖生长培养基在37 ℃、 5% CO2的条件培养奶山羊卵巢颗粒细胞。及时检查细胞贴壁和生长情况,每24 h更换培养液。将GCs以5×105的接种量接种至24孔细胞培养板中,每孔中加入不含抗生素的培养液,转染时的细胞密度达到50%。 按照lipofectamineTM2000说明书,用50 μL不含血清培养基Opti-MEM○RⅠ分别稀释pGL3-BDNF 3'UTR、pRL-TK、miRNA mimics/NC和脂质体,混匀静置5 min后,将二者混匀,静置 20 min后,将转染混合物均匀滴加到细胞中,4~6 h后换生长培养基。将培养板置于37 ℃的CO2培养箱中培养24~96 h。
1.3.4 总RNA提取及实时定量PCR 吸去培养基后用PBS洗去死细胞;每10 cm生长的培养细胞加入1 mL RNAiso Plus,静置5 min;吸至1.5 mL的离心管;加入RNAiso Plus 1/5体积量的氯仿,剧烈振荡15 s,静置15 min;4 ℃、 12 000 r/min离心15 min;吸取上层水相转移至新的1.5 mL离心管,加入等体积异丙醇,静置10 min;4 ℃、12 000 r/min离心10 min,弃上清;加入75%的乙醇1 mL,4 ℃、12 000 r/min离心5 min去乙醇;用RNAase-free溶解RNA,测定浓度,-80 ℃ 保存。 microRNA特异性反转录:10 μL 2 × miRNA Reaction Buffer Mix、2 μL 0.1% BSA、2 μL miRNA PrimeScript Enzyme Mix、1 μL Total RNA和5 μL RNase-Free H2O混合进行特异性反转录。基因反转录依照说明书操作。反应条件为95 ℃ 60 min;85 ℃ 5 s。实时定量PCR分析:microRNA的反应以U6为内参,反应条件为95 ℃ 10 min;40个循环(95 ℃ 5 s;60 ℃ 30 s);溶解曲线设置为55 ℃到95 ℃。BDNF基因以β-actin为内参,反应条件为95 ℃ 10 min;40个循环 (95 ℃ 5 s;60℃ 30 s;72℃ 15 s);溶解曲线设置为55 ℃到95 ℃。实时定量引物见表2。

表1 BDNF基因 3 'UTR克隆的引物信息
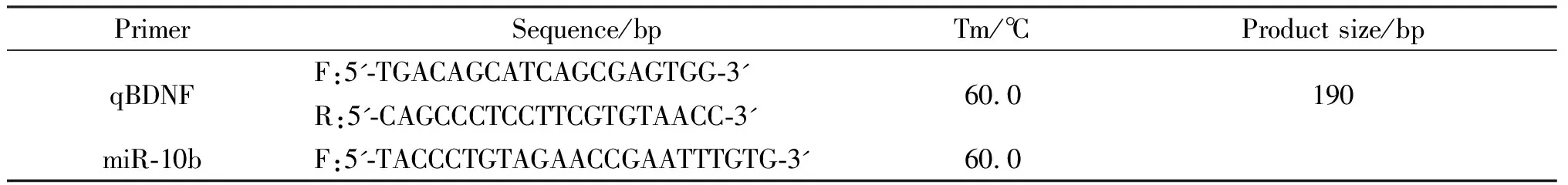
表2 实时定量PCR的引物信息
1.3.5 荧光素酶活性检测 GCs细胞转染24 h后,吸去培养基,用PBS清洗,加入100 μL 1×Passive Lysis Buffer,室温摇床上孵育15 min充分裂解细胞;吸取细胞裂解液至酶标板,分别先后加入100 μL荧光素酶测试试剂Ⅱ (LARⅡ)和 Stop&Glo试剂,并立即检测海肾荧光素酶的活性,测量时,使用1~2 s延迟和5~10 s读数。海肾荧光与萤火虫荧光比值即为相对荧光素酶活性。
1.3.5 颗粒细胞活性试验(MTT) 将GCs以1×105的接种量接种至96孔细胞培养板中,每孔中加入不含抗生素的培养液,转染时的细胞密度达到50%。转染miRNA的培养板里第1组为空白对照,第2~6组转染miR-10b mimics,浓度分别为10、30、50和100 nmol/L,转染BDNF因子的培养板里第1组为空白对照,第2~6组培养液中分别添加BDNF因子浓度为10、20、40、60 μg/L的培养液继续培养,分别于24 h、48 h、72 h处理细胞,并检测吸光值。每孔加MTT溶液(5 mg/mL)20 μL,放入培养箱继续培养,4 h后终止培养,吸去上清液,每孔加入150 μL二甲基亚砜(DMSO),震荡10 min使结晶物充分溶解,在490 nm波长处测定吸光值。计算公式:相对细胞活性=(转染组OD值/空白对照组OD值)×100%。
1.4 统计分析
采用SPSS 13.0对数据进行分析,结果用平均数±标准差表示。单因素方差分析不同处理组的差异(BDNFmRNA的表达量,miR-10b表达量,荧光素酶表达量,细胞活性率),t检验,P<0.05表示差异显著。
2 结果与分析
2.1 miR-10b的差异表达
2.2 miRNA靶基因生物信息学预测结果与BDNF 3'UTR的 RCR扩增
随机选取3组扩增得到的样品,进行1.5%琼脂糖凝胶电泳检测,结果如图2所示,扩增条带清晰,大小符合目的片段。将测序结果进行Blast比对,比对结果表明克隆正确。
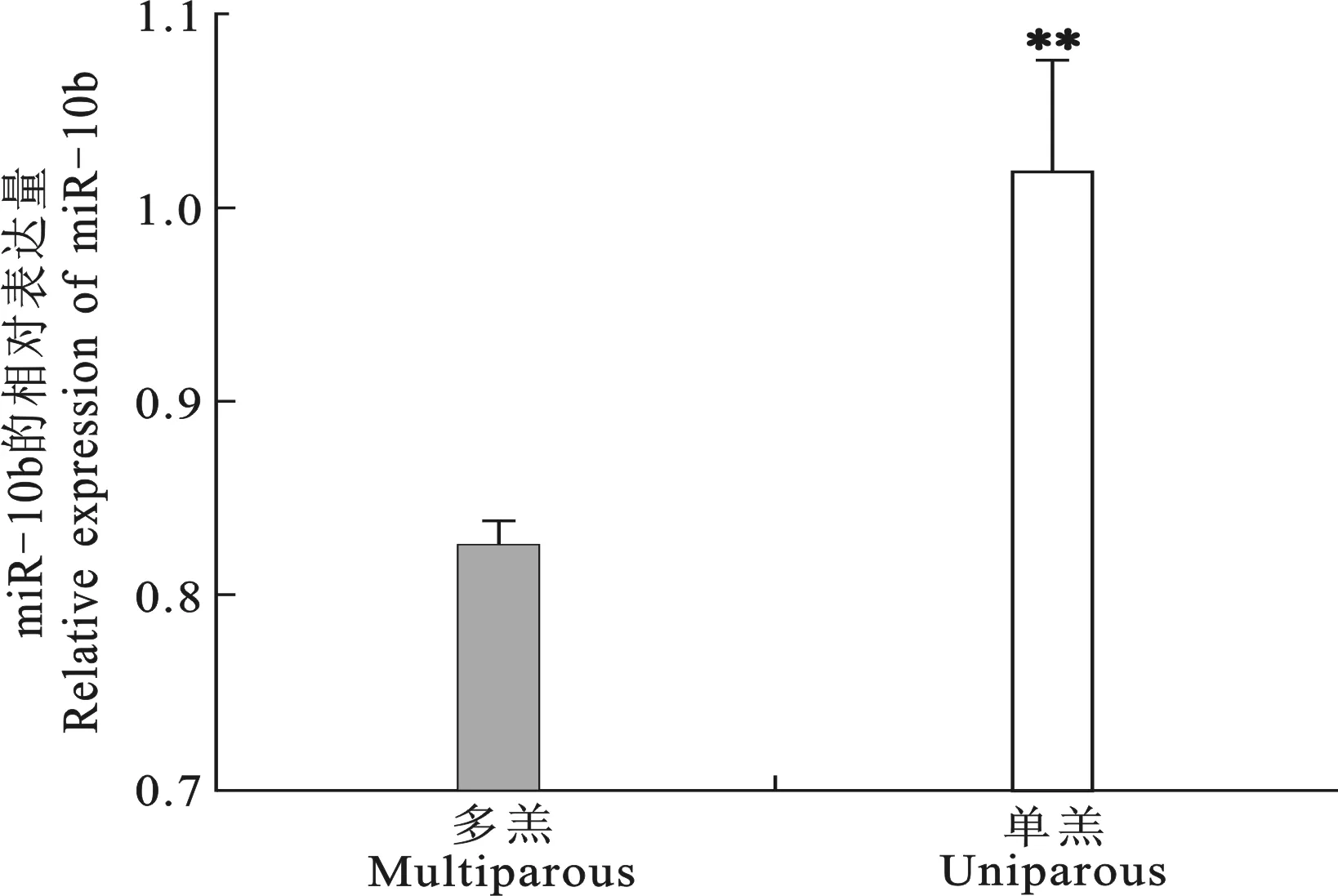
图1 miR-10b在多羔和单羔奶山羊卵巢组织中的差异表达
*P<0.05,**P<0.01。下图同
Fig.1 Differential expression of miR-10b in polytocous and monotocous dairy goats
*P<0.05,**P<0.01.The same below

图2 BDNF基因3'UTR区PCR扩增结果1~3. PCR产物;M. MarkerⅠ
2.3 pGL3-BDNF 3'UTR载体酶切鉴定结果
将重组载体进行酶切鉴定,得到两个片段,其中小片段大小为257 bp,符合预期结果,而对照组单酶切结果只有一个片段(图3)。重组载体测序结果进行Blast比对,结果说明载体构建成功。
2.4 荧光素酶活性检测
经过SPSS软件分析可知,共转染pGL3-BDNF
3'UTR和miR-10b mimics,荧光素酶相对表达量极显著低于空白对照组,转染pGL3-BDNF 3'UTR和miR-10b mimics control,荧光素酶表达量与空白对照没有显著差异(图4),结果说明miR-10b可能作用于重组载体3'UTR区,即miR-10b作用于靶基因BDNF的3'UTR,导致荧光素酶表达量显著下降。初步确定BDNF为miR-10b的靶基因。

图3重组载体酶切鉴定
1.对照;2.重组载体;M1.DNA Marker Ⅲ;M2.250 bp Ladder
Fig.3 Enzyme digestion analysis on the recombination vector
1. Control;2. Recombination vector;M1. DNA Marker Ⅲ; M2. 250 bp Ladder
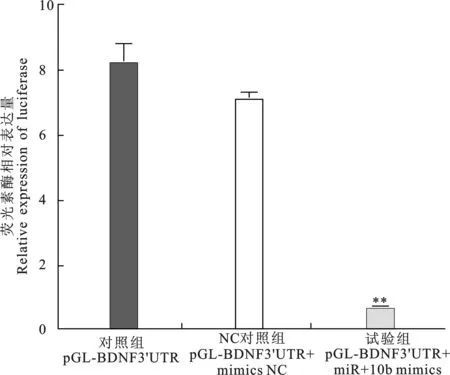
图4荧光素酶相对表达量
Fig.4 Relative expression of luciferase
2.5 实时定量PCR检测靶基因mRNA表达水平
实时定量PCR结果显示,转染miR-10b mimics后在颗粒细胞中检测到miR-10b表达量是对照组的约40倍,说明颗粒细胞中miR-10b表达水平很高(图5a);由图5b可见, 转染miR-10b mimics后BDNFmRNA表达量及显著低于对照组(P<0.01)。由此可以说明,高水平的miR-10b抑制了BDNF的表达,可能是通过降解BDNFmRNA而实现该过程。
2.6 miR-10b对颗粒细胞活性的影响
向颗粒细胞中转染miR-10b mimics后细胞的相对活性见图6。培养24 h后,miR-10b mimics处理组与对照组细胞相对活性没有显著变化;培养48 和72 h后,所有50、100 nmol/L处理组细胞的相对活性极显著(P<0.01)或显著(P<0.05)低于对照组。过表达miR-10b可以抑制颗粒细胞的活性,转染浓度为100 nmol/L。

图5 实时定量PCR结果a. miR-10b的相对表达量;b. BDNF的相对表达量

图6 miR-10b对颗粒细胞活性的影响A. Control; B, C, D, E.10, 30, 50, 100 nmol/L
2.7 BDNF因子对颗粒细胞活性的影响
由图7知,培养24 h后,20 μg/L以上BDNF因子处理组细胞的相对活性显著高于对照组(P<0.05);培养48 h后,所有BDNF因子处理组细胞的相对活性均显著高于对照组(P<0.05);培养72 h后,BDNF因子处理组与对照组相比没有显著变化(P>0.05)。
2.8 BDNF因子和miR-10b对颗粒细胞活性的影响
根据前两个试验结果,加入外源性BDNF因子(20 μg/L)的同时转染miR-10b mimics(100 nM),分别在24 h、48 h和72 h后测定吸光值,计算细胞的相对活性。由图8可知,培养24 h和48 h后,BDNF因子处理组细胞的相对活性显著高于对照组(P<0.05),而高水平的miR-10b抵消了BDNF因子对颗粒细胞活性的促进作用;培养72 h后,BDNF处理组细胞的相对活性与对照组相比没有显著提高,说明BDNF对颗粒细胞活性的促进有时间效应。以上结果表明,高水平的miR-10b可抑制BDNF促进颗粒细胞活性的作用,结合实时定量PCR结果可知,miR-10b可能通过调节BDNF基因的表达抑制颗粒细胞的活性。
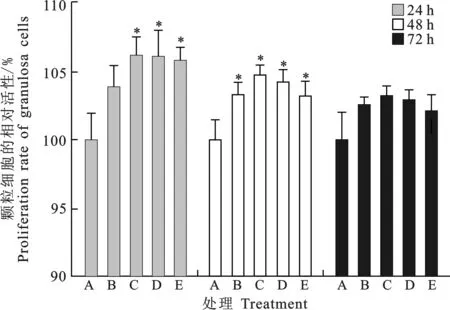
图7 BDNF因子对颗粒细胞活性的影响A. Control; B, C, D, E. 10, 20, 40, 60 μg/L
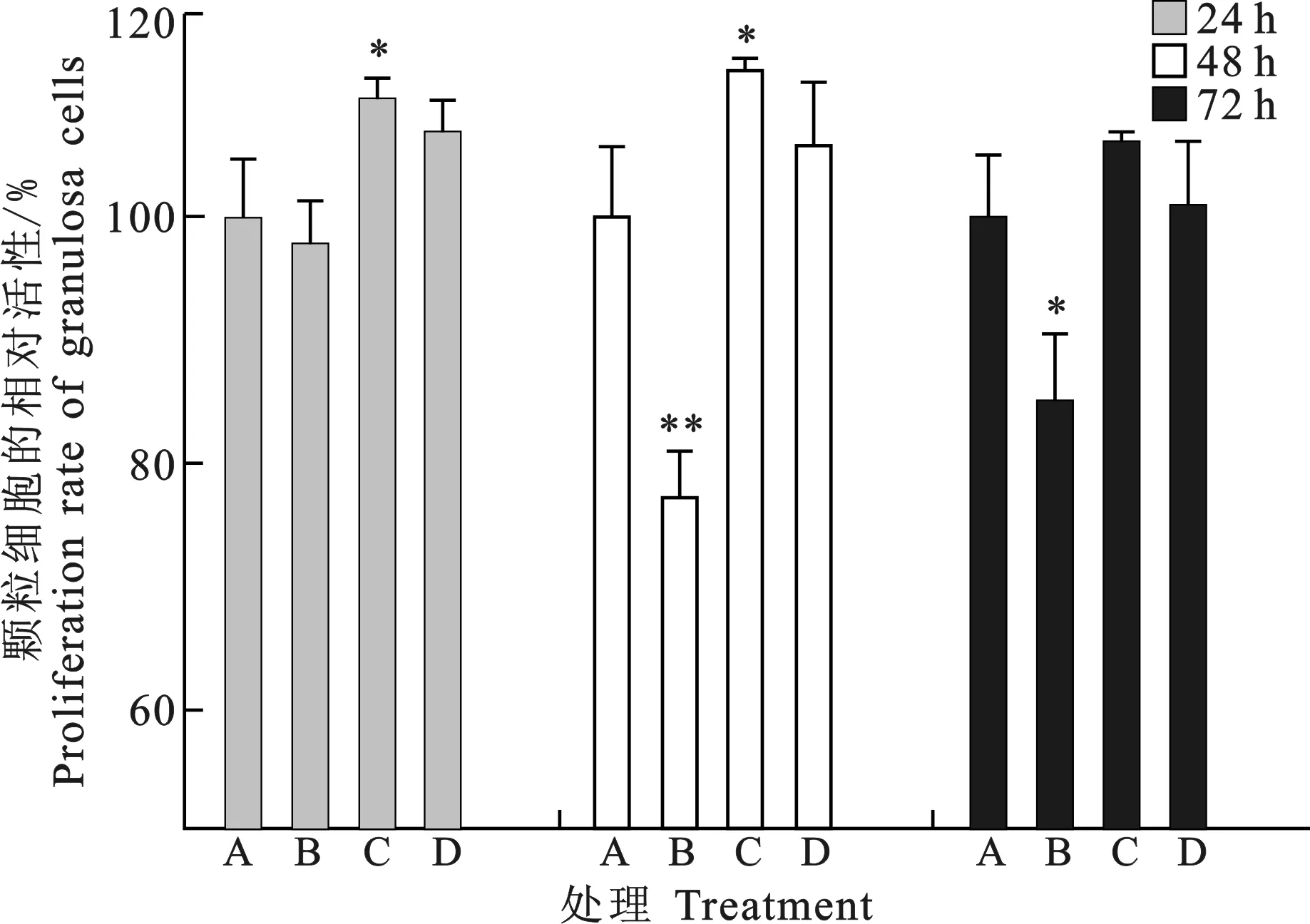
图8 颗粒细胞的相对活性A. Control; B. miR-10b; C.BNDF; D. BNDF+miR-10b
3 讨 论
颗粒细胞的增殖、分化是卵泡发育中的一项重要过程,卵巢发育关键基因促卵泡素受体(Follicle Stimulating Hormone Receptor,FSHR)就是在颗粒细胞中表达的[18]。颗粒细胞还能合成很多活性肽,如抑制素(Inhibin)[19]、激活素(activin)[20]、卵泡抑素(follistatin)[21],这些蛋白不仅可以调节FSH的释放,还可以作为调节因子直接参与卵泡发育过程。在排卵过程中,颗粒细胞可以介导调节促黄体生成素(LH)的分泌,从而调控排卵过程[22]。在卵泡闭锁现象出现时,颗粒细胞也承担着必不可少的作用。有学者发现,颗粒细胞的凋亡可以直接导致卵泡闭锁[23]。如果发育中的卵泡周围的颗粒细胞有10%以上出现了凋亡,那么这个卵泡可能正在或者已经闭锁,而卵泡发生闭锁之后,就不能正常发育。
颗粒细胞与卵泡发育有着紧密的联系。然而,颗粒细胞究竟如何调节卵泡发育的机制还不是很清楚,仍需要学者们去研究探索。所以,研究颗粒细胞活性的调控机理,对促进卵泡发育、抑制卵泡闭锁等生物学过程具有重要意义。很多研究证明神经生长因子家族成员能够调节卵巢和生殖细胞的发育,如促进卵泡颗粒细胞的活性,加快初级卵泡的发育,促进初级卵泡中颗粒细胞的扩散等[24]。越来越多的研究证明,BDNF在生殖系统中具有重要作用。Dissen等[16]证实,BDNF有助于卵泡的发育,如促进卵泡颗粒细胞的活性以及原始卵泡的生长。BDNF及其受体TrkB可能作为联系卵泡形成时卵母细胞与卵泡颗粒细胞的一种信号分子。Ojeda等[17]首次证明了BDNF及其受体TrkB表达于人初级卵泡和次级卵泡的颗粒细胞中,推测BDNF及其受体TrkB在人卵泡发育早期就参与了卵泡发育的调控。Harel[25]研究发现,BDNF和TrkB在人卵母细胞和卵丘细胞都有表达,说明BDNF可能通过调节卵巢内颗粒细胞和卵母细胞的生长、分化以及细胞间的相互作用而影响早期卵泡的发育的。目前很多研究者主要研究miR-10b在肿瘤组织或癌细胞中的功能作用,有关miR-10b参与调控卵巢细胞活性的报道非常少。本试验初次研究miR-10b及其靶基因BDNF在卵巢颗粒细胞中的表达以及对体外培养的颗粒细胞活性的调控作用。
易康乐等[26]用BDNF因子处理体外培养的牛卵巢颗粒细胞发现,培养液中加入20 μg/L的BDNF因子可显著促进颗粒细胞增殖。本试验中观察到,在培养液中添加适宜浓度(20μg/L、40μg/L和60μg/L)的BDNF因子可以促进奶山羊卵巢颗粒细胞的活性,表明BDNF是重要的卵泡调节因子。然而,过表达miR-10b则会抑制颗粒细胞活性,表明miR-10b也具有重要的卵泡调节作用。在培养液中添加适宜浓度的BDNF因子的同时过表达miR-10b,颗粒细胞活性没有明显的变化,结合miR-10b靶基因验证结果,推测高水平的miR-10b抑制了BDNF因子对颗粒细胞活性的促进作用。
本研究结果显示,miR-10b是通过抑制BDNF基因的表达实现对卵巢颗粒细胞活性的抑制作用,与易康乐等[26]研究结果相符,而miR-10b作为调节BDNF基因的重要分子为研究奶山羊育种提供了新思路。本试验结果为进一步研究miR-10b在卵泡发育中的功能和作用机理提供了试验依据,对于提高奶山羊的产羔率具有重要意义。
4 结 论
miR-10b在单羔奶山羊卵巢组织中的相对表达量显著高于多羔奶山羊卵巢组织中的相对表达量。荧光素酶报告载体和实时定量PCR验证BDNF是miR-10b的靶基因。通过添加外源性BDNF因子可显著促进卵巢颗粒细胞的活性,而高水平的miR-10b则显著抑制了BDNF因子对颗粒细胞活性的促进作用。
