成都市市售即食食品中克罗诺杆菌的分离鉴定及药敏检测
2019-01-16罗梦幽贺苏皖白凤岚曾宝锋代义闯唐俊妮
罗梦幽,贺苏皖,白凤岚,曾宝锋,代义闯,唐俊妮
(西南民族大学生命科学与技术学院,四川 成都 610041)
克罗诺杆菌原名阪崎肠杆菌,属于肠杆科,是一种革兰氏阴性无芽孢杆菌[1].克罗诺杆菌属于婴儿配方乳粉中的A类致病菌,会导致脑膜炎、坏死性小肠结肠炎以及新生儿败血症[2-3].尽管使用抗生素治疗可以康复,但会伴随严重的神经系统后遗症、发育障碍等症状,死亡率高达50~80%[4].
克罗诺杆菌属的来源非常广泛,存在于环境、植物以及各种食品中.其中,婴儿配方奶粉是新生儿感染克罗诺杆菌的主要途径.Iversen[5]等调查了82种婴儿配方奶粉和404种其他食品中克罗诺杆菌和其他肠杆菌科细菌的存在情况,结果发现在婴儿配方奶粉、干酪产品中均检出克罗诺杆菌,未检出沙门氏菌和其它肠杆菌,说明传统控制沙门氏菌和其它肠杆菌的方法并不能有效控制克罗诺杆菌,且克罗诺杆菌在食品中来源十分广泛.该菌已被国际食品微生物标准委员会列入“对特定人群产生严重的生命危害、或产生慢性后遗症”的微生物,与肉毒梭菌的A、B型毒素、单核细胞增生李斯特菌等具有同等的危害[6].
克罗诺杆菌致病性与其侵袭性毒素有关,其产生的外膜蛋白A(OmpA)是主要的毒力因子,以往使用的分子检测靶点基因主要包括ompA和16S rRNA等[7-9].由于16S rRNA的特异性不强且多样性不丰富,很难将待鉴定的微生物精确到种的水平[10-11].曲春波[9]利用编码DNA促旋酶B亚基(拓扑异构酶型Ⅱ)的一个功能保守的看家基因gyrB检测克罗诺杆菌属菌株具有很好的特异性,并证实gyrB基因可作为克罗诺杆菌属菌株一个新的分子识别标记[12].另外,近年来随着克罗诺杆菌耐药性的报道不断增加,有关该菌的耐药性问题也越来越引起重视[13-16].
因此,本研究针对成都市武侯区市售食品中克罗诺杆菌的分布及污染进行初步调查,同时对克罗诺杆菌分离菌株进行药敏检测,为治疗克罗诺杆菌引起的相关疾病提供参考.
1 材料与方法
1.1 培养基、试剂
胰蛋白胨大豆琼脂培养基(TSA)、阪崎克罗诺杆菌显色培养基(DFI)、胰蛋白胨大豆肉汤(TSB)(杭州微生物试剂有限公司);Mueller-Hinton琼脂(MHA)、缓冲蛋白胨水(BPW缓冲液)、改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素(mLST-Vm)(青岛高科园海博生物技术有限公司);REGULARAGAROSEG-10琼脂糖BIOWEST公司;GELVIEW核酸染料、DL2000 Marker、PCR 引物、25 mmol/L MgCl2、dNTP、Taq DNA聚合酶(北京擎科新业生物技术有限公司);各种药片(赛默飞世尔科技(中国)有限公司).
1.2 仪器与设备
WD800B型微波炉(顺德市格兰仕微波炉电器有限公司);5804R型Eppendorf冷冻离心机(Eppendorf中国有限公司);PTC-200 PCR仪、Universal Hood II型凝胶成像仪(Bio-Rad公司);SW-CJ-2FD洁净工作台(苏净集团苏州安泰空气技术有限公司);UV-6100分光光度计(上海美普达仪器有限公司);GHP-9080水式恒温培养箱(上海齐欣科学仪器有限公司);HZQ-F160全温振荡培养箱(江苏省太仓市实验设备厂);AKHL-III-24艾柯超纯水机(台湾艾柯)(成都康宁实验专用纯水设备);MLS-3020电热自动灭菌锅(日本SANYO公司);DYY-6C型电泳仪(北京六一仪器厂).
1.3 实验方法
1.3.1 食品样本采集
从成都武侯区周边超市、农贸市场和路边食品摊店等采集不同种类的即食食品共计100份(样品种类及其数量详见图1).当日采集的样品立即送入实验室进行细菌分离培养和鉴定,采样时间为2015年7月至2015年11月.
1.3.2 克罗诺杆菌的分离与纯化
所有的样品均在无菌条件下进行处理.按照GB 4789.40-2016进行检验[17].取检样5 g加入BPW稀释液45 mL,37℃下震荡培养18 h;取1 mL上述菌悬液加入改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素(mLST-Vm,10 μg/mL),置于恒温培养箱中 44 ℃,24 h恒温培养;将上述菌悬液接种至DFI显色培养基,36℃培养22~26 h,疑似菌落在显色培养基上呈圆形、蓝绿色菌落形态;每板挑取1~3个疑似菌落接种至TSA琼脂平板25℃下培养48 h;将在显色平板上呈蓝绿色且能在TSA平板上能生成黄色的疑似菌株进一步纯化培养和进行分子鉴定.
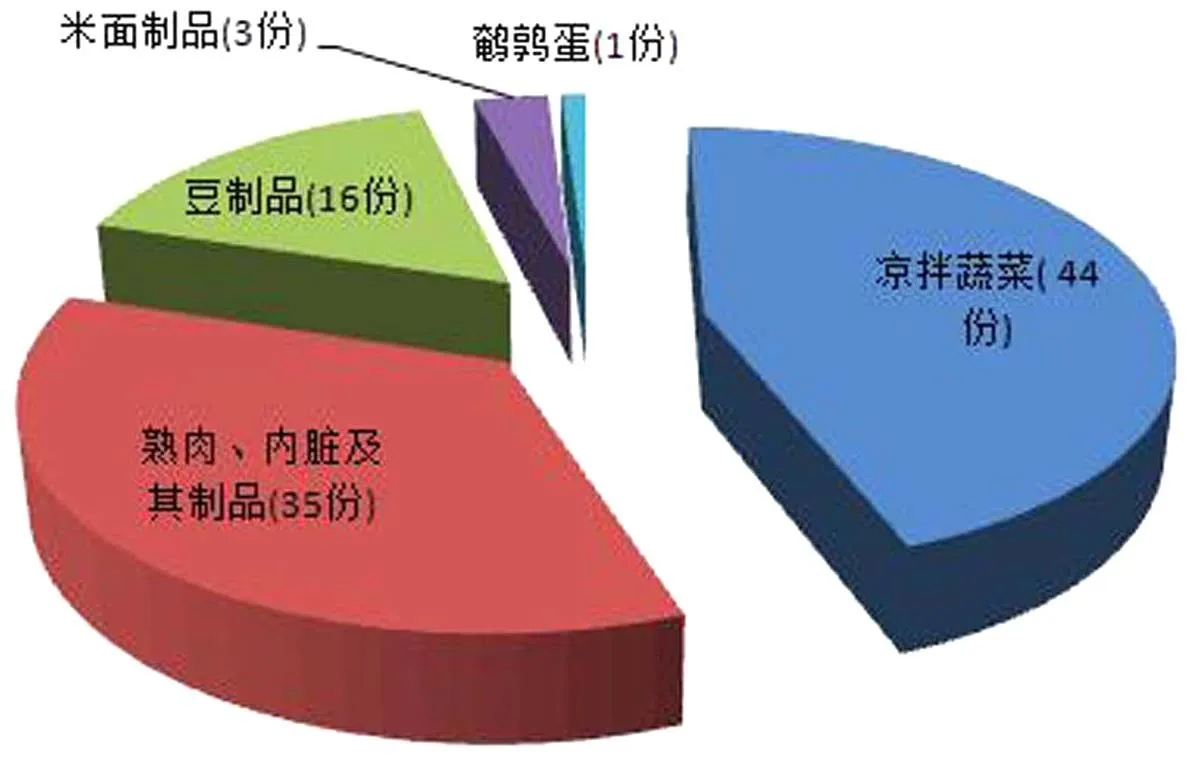
图1 采集的食品种类及数量Fig.1 The type and numbers of food samples
1.3.3 克罗诺杆菌的16S rDNA测序鉴定及gyrB基因检测
将纯化后的菌株接种至TSB肉汤中,37℃培养16~18 h,用微波加热法[18]提取分离菌株的DNA,以细菌通用引物16S rDNA及看家基因gyrB引物对其进行PCR扩增.检测基因的引物序列、扩增片段长度及退火温度见表1.PCR反应总体系为20 μL,上下游引物各 0.5 μL,DNA 模版 1 μL,10 × PCR buffer(Mg2+free)2 μL,,25 mM 的 Mg Cl21.6 μL,dNTP Mixture 1.2 μL,Taq 酶 0.2 μL,剩下由无菌去离子水补齐.PCR反应条件:95℃预变性5 min;95℃变性40 s,55 ℃退火50 s,72 ℃延伸40 s,35 个循环;72 ℃延伸10 min.取4.5 μL反应产物进行1%琼脂糖电泳,并于凝胶成像系统下观察记录结果.将扩增的16S rDNA产物送至成都擎科生物公司进行测序比对.

表1 本研究所用引物序列Table 1 The primers used in this study
1.3.4 克罗诺杆菌药敏检测
根据美国临床和实验室标准协会(Clinical and laboratory standards institute,CLSI)推荐的K-B纸片扩散法进行操作,从TSA琼脂培养基上挑取单菌落至无菌生理盐水中调整为0.5麦氏浊度的菌悬液,用无菌棉签蘸取适量菌悬液均匀涂于MH琼脂表面,接种15 min内用镊子将药敏试纸片放置在已接种的MH平板上,每个平板放置4个试纸片.将平板置于35℃的恒温培养箱中孵育16~18 h后取出,用直尺测量抑菌环直径.试验结果按照CLSI的相关标准进行判定.共选择了12大类16种抗生素,具体见表2.
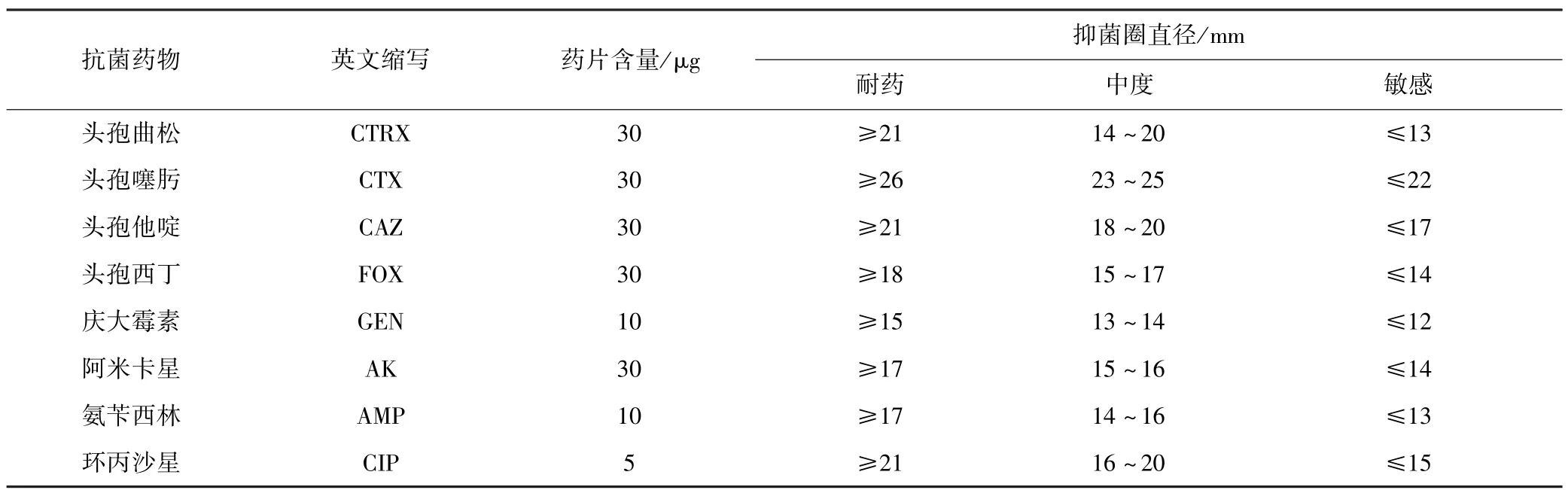
表2 抗菌药物种类及药敏结果判断标准Table 2 The antibacterial drugs and the drug sensitivity evaluation criteria

(续表2)
1.3.5 数据分析
药敏实验平行重复3次,结果以平均值±SD表示,使用软件SPSS 19.0统计分析,P<0.05为差异有统计学意义.
2 结果与分析
2.1 克罗诺杆菌的分离、纯化与鉴定结果
依据GB4789.40-2016《食品微生物学检验阪崎肠杆菌检验》对各类食品中的克罗诺杆菌进行分离.挑选显色平板上呈蓝绿色且能在TSA平板上能生成黄色的菌株.纯化的菌落在DFI显色培养基上的形态特征见图2,通过形态学鉴定得到32株克罗诺杆菌疑似分离菌株.将分离菌株进行16S rDNA通用引物PCR扩增见图3,16S rDNA测序比对证实32株分离菌株均为克罗诺杆菌属.进一步利用管家基因gyrB对32株克罗诺分离菌株进行检测,部分检测结果见图4,所有32株分离菌株均检测出gyrB基因,从另一个侧面证实管家基因gyrB对克罗诺杆菌检测具有较好的特异性.
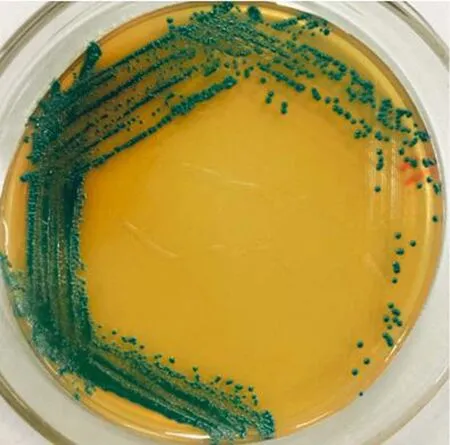
图2 分离菌株在DFI显色培养基上的菌落形态Fig.2 The colony morphology of Cronobacter spp.on DFI medium
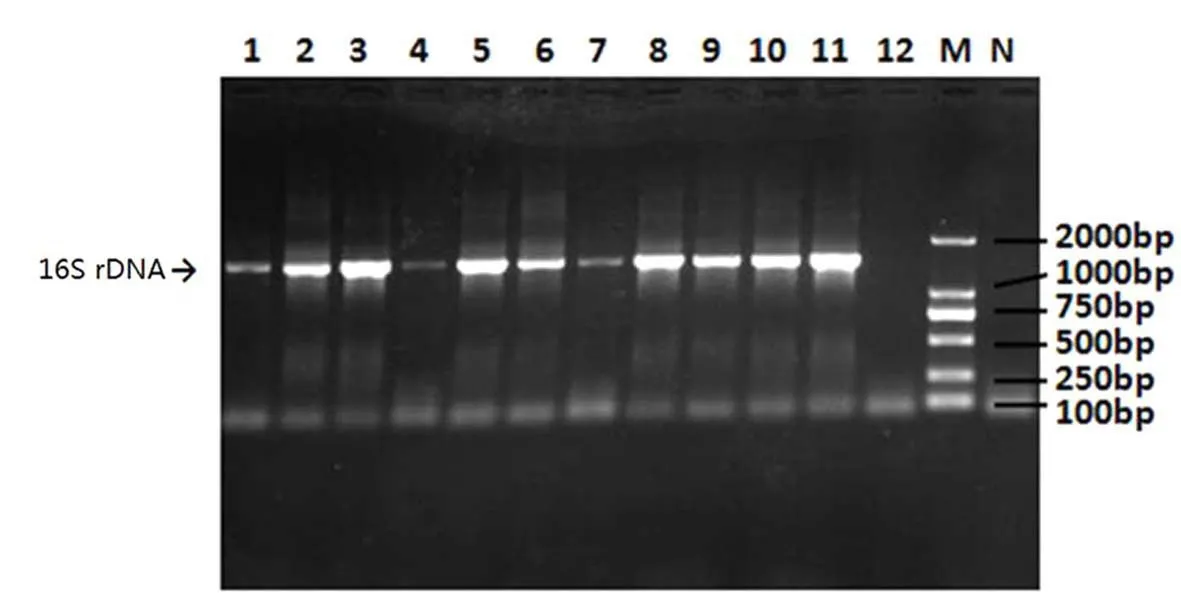
图3 16S rDNA基因检测结果Fig.3 The PCR results for 16S rDNA gene in Cronobacter spp.isolates

图4 菌株的gyrB基因检测结果Fig.4 The PCR results of gyrB gene in Cronobacter spp.isolates
通过上述鉴定,本研究从100份即食食品样品中,分离获得32株克罗诺杆菌,样品的分离率为32%.
本研究中从武侯区周边超市共采集样品45份,有11份样品分离出克罗诺杆菌,分离率为24.4%;从武侯区周边食品小吃店共采样51份,有21份样品分离出克罗诺杆菌,分离率为41.2%;从周边农贸市场采样4份,未分离出克罗诺杆菌.
进一步对采样样品种类进行分析,凉拌即食蔬菜类44份中检出17份,检出率为38.64%;熟肉、内脏及其制品采样35份中检出8份,检出率为22.86%;即食豆制品采样16份,检出6份,检出率为37.5%;即食米面制品采样3份,检出1份,检出率为33.33%(见图5).其中,凉拌菜的污染最为严重.
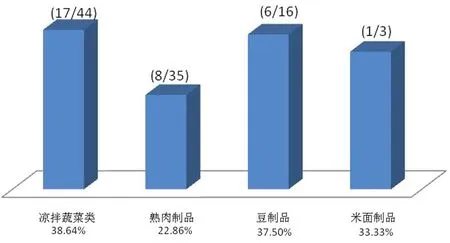
图5 不同种类食品中克罗诺杆菌的检出率Fig.5 The detection rates of Cronobacter spp.in different foods
2.2 克罗诺杆菌分离菌株的药敏检测结果
分离菌株的药敏检测结果见表3,克罗诺杆菌32株分离菌株对头孢曲松、头孢噻肟、头孢他啶、庆大霉素、阿米卡星、环丙沙星、氯霉素、头孢西丁、甲氧苄啶及氨曲南等10种抗生素完全敏感;对万古霉素和克林霉素两种抗生素完全耐药;对红霉素、氨苄西林和四环素的耐药率分别为9.38%、6.25%、6.25%;对红霉素、氨苄西林、亚胺培南和四环素的中介率分别为90.62%、40.63%、3.13%和3.13%.本研究中分离的克罗诺杆菌尚未出现多重耐药情况.
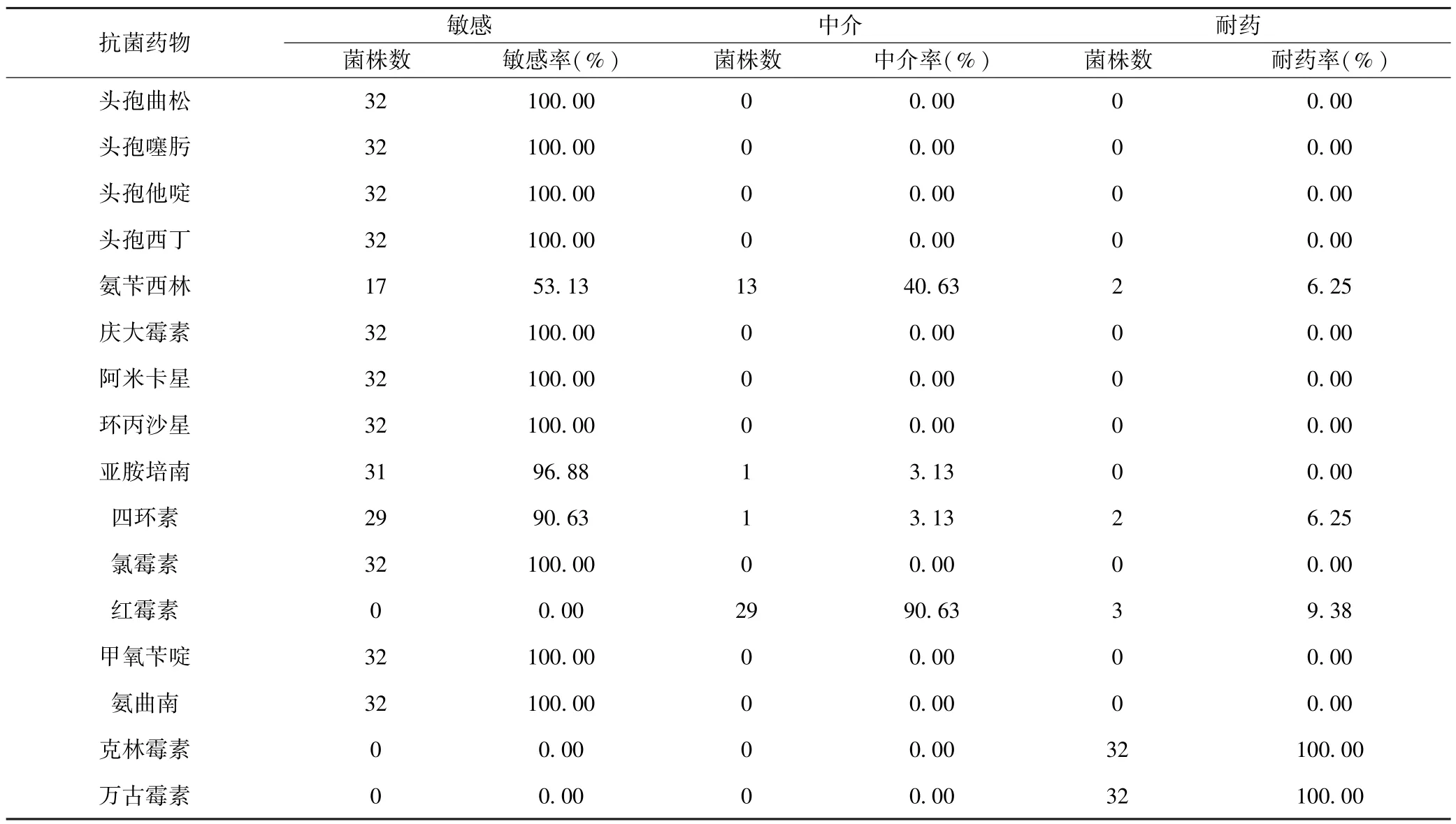
表3 克罗诺杆菌分离菌株对16种抗菌药物的药敏检测结果Table 3 The antimicrobial susceptibility of Cronobacter spp.isolates to 16 antibiotics
3 讨论
克罗诺杆菌在环境中广泛分布,在婴幼儿奶粉、奶酪、腌肉、水、蔬菜、大米、面包、茶叶、草药、调味料及豆腐等多种食品中被检测到,即使有微量污染,该菌在室温下也会大量繁殖[19-20].李远宏[21]等在食品香辛料和调味料等64份样品中检出19份样品含有克罗诺杆菌,检出率为29.7%.王倩宁[22]等对羊奶粉加工厂的环境和产品进行采样,180份样品中有29份检出阪崎肠杆菌,污染率为16.1%.本研究中,我们从成都市武侯区周边超市和食品摊点采集的食品样本中分离出32株克罗诺杆菌,样品的分离率为32%.其中,米面制品的检出率低于姜探璐[22]等在营养面条中对克罗诺杆菌的检出率(71.4%).黄启红[23]等对豆制品的检出率为100%(2/2),而本研究中豆制品的检出率为37.5%(6/16),这可能是前者采样基数较小的原因.从我们的研究结果来看,凉拌菜中的污染较大,凉拌菜的污染大多来自加工和贩卖过程,夏季天气炎热,为细菌的繁殖提供了有利的条件,有关部门应加强对食品中克罗诺杆菌污染的监督.
本研究中,32株克罗诺分离菌株均检测出gyrB基因,我们的研究结果与曲春波[9]、陈万义[12]等的结果具有一致性,证实了管家基因gyrB具有良好的特异性,可作为克罗诺杆菌检测的一个分子标识.
近年来,细菌的耐药性不断增加,给临床治疗带来诸多困难[24].黄玉兰等[25]针对四川省市售婴幼儿奶粉、婴幼儿谷物辅助食品及临床病例中分离的克罗诺杆菌药敏进行检测,109株克罗诺杆菌对环丙沙星、萘啶酸、头孢噻肟、庆大霉素、甲氧苄啶/磺胺甲恶唑、氯霉素、四环素等7种抗生素均敏感.王倩宁[21]等对羊奶粉生产环节分离的阪崎肠杆菌进行药敏检测,发现29株阪崎肠杆菌分离菌株对氟喹诺酮类、氨基糖苷类、四环素类和氯霉素类抗生素均敏感.张西萌[26]等对进口乳制品中的克罗诺杆菌分离株进行药敏检测,发现100株克罗诺杆菌分离菌株对庆大霉素、阿米卡星、氯霉素、头孢噻肟、头孢他啶、环丙沙星等14种抗生素敏感,对四环素、氨苄西林表现出不同程度的耐药.裴晓燕[27]等对中国婴幼儿配方奶粉中分离的阪崎肠杆菌进行药敏分析,发现所有菌株对头孢他啶、亚胺培南、庆大霉素、阿米卡星、环丙沙星、氯霉素等抗生素敏感,对万古霉素耐药.本研究中,32株克罗诺杆菌分离菌株对头孢曲松、头孢噻肟、头孢他啶、庆大霉素、阿米卡星、环丙沙星、氯霉素、头孢西丁、甲氧苄啶及氨曲南等10种抗生素均敏感,对克林霉素和万古霉素耐药率为100%,对红霉素、氨苄西林和四环素有不同程度耐药.我们的研究结果与上述报道具有一致性.但以上报道中发现克罗诺杆菌出现多重耐药情况,本研究中尚未发现.
综上,本研究针对成都市武侯区周边超市、食品小吃店和农贸市场的食品样品进行采样调查,发现不同样品中存在一定程度的克罗诺杆菌污染,并且分离菌株存在一定的耐药性,与其他研究相比较,即食食品中克诺罗杆菌的耐药性并不高.本研究结果为成都市市售食品中克罗诺杆菌污染评价提供参考.
