酵母菌株ZZ-46利用木质纤维素水解液产油脂的研究
2019-01-16刘旭敏肖泽涛王冬梅郭书贤
李 斌 刘旭敏 肖泽涛 韩 尧 王冬梅 郭书贤
(南阳理工学院生物与化学工程学院;河南省工业微生物资源与发酵技术重点实验室,南阳 473004)
微生物油脂是除了植物油脂和动物油脂之外的又一油脂资源[1],是由真菌、细菌或微藻等产油微生物利用糖类、烃类和一般油脂作为碳源,并配合氮源和无机盐辅助因子在特定情况下产生的物质。从德国科学家首次发现产油微生物以来,科学家们从未停止研究。20世纪80年代,新西兰、日本、英国、法国等对一些高产γ-亚麻酸、花生四烯酸的微生物进行了大规模生产,并将一些发酵产品投入市场。90年代后,研究的重点都在如何获取功能性油脂上。随后,科学家们发现大部分微生物生产的油脂在脂肪酸组成上与植物油脂类似,以 C16、C18脂肪酸为主,均富含饱和、低度不饱和长链脂肪酸,这使得微生物油脂有潜力成为生物柴油的生产原料[2]。利用木质纤维素生产油脂不仅可以获得作为新油源的微生物油脂,而且有助于解决农业废弃物问题。木质纤维素含有纤维素、半纤维素和木质素,另外还有少量的灰分、蛋白质、淀粉等成分组成[3-4]。木质纤维素里能水解成被利用的糖是纤维素和半纤维素,而木质素的结构会降低对纤维素和半纤维素的利用,因此木质纤维素材料要进行预处理才能打破木质素的结构,提高对木质纤维素的利用率[5-9]。纤维素水解是将预处理获得的纤维素经水解转化为单糖,才能够被产油酵母利用。木质纤维素水解较难,影响其水解的因素主要有结晶度、木质素对纤维素的保护作用、物料特性及半纤维素对纤维素的包裹[10-14]。以木质纤维素为原料,经粉碎后稀酸水解得到发酵液,并进一步脱毒处理可用于油脂酵母的利用[15-17]。因此,对水解技术和脱毒技术要有进一步的研究。能源短缺和环境污染是人类当今面临的两大难题,因传统能源消耗大、污染严重、发展新型清洁的可再生能源已成为全球关注的热点[18]。从土壤中分离筛选出的TrichosporondermatisZZ-46可同步利用葡萄糖和木糖生产油脂,通过本次研究也将真正探索出酵母菌利用木质纤维素产油脂发酵的规律所在,以便提高生产效率。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
TrichosporoncutaneumCGMCC2.571购于中国工业微生物菌种保藏管理中心,TrichosporondermatisZZ-46河南省工业微生物资源与发酵技术重点实验室保藏。
1.1.2 培养基
YEPD培养基:葡萄糖20 g,酵母粉10 g,蛋白胨10 g,水1 000 mL,pH自然,121 ℃饱和蒸汽灭菌20 min。
基础发酵培养基:葡萄糖70 g,酵母粉0.75 g,NH4Cl 0.1 g,KH2PO411.8 g,K2HPO43.7 g,CaCl2·H2O 40 mg,MgCl21.0 g,CaCl240 mg,FeSO4·7H2O 5.5 mg,ZnSO4·7H2O 1.0 mg,Na2SO40.1 g,MnSO4·4H2O 0.76 mg,浓H2SO40.001 84 mg,柠檬酸5.2 mg,水1 000 mL,pH 5.8~6.0,在121 ℃饱和蒸汽灭菌20 min。
发酵培养基:木质纤维素稀酸水解液脱毒后,在121 ℃饱和蒸汽压下灭菌20 min。在基础发酵培养基中用水解液代替1 000 mL水及总糖(其余同基础发酵培养基)作为发酵培养基。
1.1.3 实验试剂
酵母粉(BR)、蛋白胨(BR)、葡萄糖(AR)、柠檬酸(AR)、NH4Cl (AR)、KH2PO4(AR)、浓盐酸(AR)、浓硫酸(AR)、纤维素酶(酶活力15 000.0 U/g)、木聚糖酶(酶活力15 000.0 U/g)等:国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-2G超净工作台:苏州净化设备有限公司;HZQ-B大型恒温摇床:苏州威尔实验用品有限公司;DNP-9082电热恒温培养箱:上海精宏实验设备有限公司;TDL-40B离心机:上海安亭科学仪器厂;752N紫外-可见分光光度计:上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 水解液的制备
将小麦秸秆和甘蔗渣按1∶1的质量比称取样品25 g,置于三角瓶中,加入1%的稀硫酸(固液比1∶6),121 ℃下水解60 min。取出水解后的样品,加入蒸馏水(固液比1∶4),待样品冷却到常温后,用NaOH调节pH值为5.0。再加入MgCl20.137 5 g,吐温0.375 mL,纤维素酶2.00 g/100 g,木聚糖酶2.00 g/100 g。密封,置于45 ℃下水浴振荡48 h后,离心,抽滤。
1.3.2 脱毒方法
Ca(OH)2法:将水解液放入烧杯中,60 ℃水浴保温,用Ca(OH)2粉末调节pH至10~11,抽滤,得滤液,H3PO4调节pH到6.0,抽滤,得滤液[19]。
活性炭吸附法:按固液比1∶5向水解液中加入活性炭,28 ℃摇床中(120 r/min)下振荡60 min,过滤活性炭后得滤液[20]。
混合脱毒法:将以上两种脱毒方法混合使用,进行脱毒处理。
1.3.3 培养方法1.3.3.1 菌种活化
TrichosporoncutaneumCGMCC2.571、TrichosporondermatisZZ-46划线接种至YEPD固体斜面培养基,28 ℃培养48 h。
1.3.3.2 摇瓶种子液的培养
活化后的菌体接两环于YEPD液体种子培养基中,28 ℃,120 r/min培养36 h。
1.3.3.3 摇瓶发酵培养
取培养36 h的种子液,按10%接种量接种于发酵培养基中,28 ℃,200 r/min培养5 d,每间隔12 h测定生物量、油脂产量、残糖[19]。
1.3.4 测定方法1.3.4.1 OD值(采用光电比浊法)
取适量培养液,将样液稀释至OD值在0.2~0.8范围,用分光光度计在660 nm下测定光密度值[21]。
1.3.4.2 总糖的测定(苯酚-硫酸法)
精密称取烘干至恒重的葡萄糖标准品0.050 0 g,以蒸馏水定容至500 mL,配制成100 μg/mL葡萄糖标准溶液。精确量取100 μg/mL葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于8支10 mL比色管中,各加蒸馏水补至2.0 mL,依次加入6%苯酚1 mL,浓硫酸5 mL,摇匀,70 ℃水浴中加热20 min后冷却至室温,测定490 nm吸光度。以糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线[22]。样品液稀释一定浓度后,取2 mL,按上述步骤操作,根据标准曲线计算总糖含量。
1.3.4.3 残糖测定(DNS法)
精密称取烘干至恒重的葡萄糖标准品100 mg,以蒸馏水定容至100 mL,配制成1 mg/mL葡萄糖标准溶液。精确量取1 mg/mL葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL于7支25 mL具塞试管中,各加蒸馏水补至2.0 mL,分别加入DNS试剂2.0 mL,摇匀,沸水浴5 min显色,冰水冷却至室温,分别加入9.0 mL蒸馏水,摇匀,测定540 nm处吸光度值(A)。以第一支试管作为空白对照,以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线[22]。
1.3.4.4 发酵液中糠醛含量的测定
精确称取糠醛,用蒸馏水配制0、0.5、1.0、1.5、2.5、3.0、4.0 μg/mL标准溶液,测定 276 nm吸光度。以糠醛浓度为横坐标,吸光度为纵坐标,绘制标准曲线[23]。
1.3.4.5 油脂的提取及含量测算(磷酸香草醛法)
摇瓶培养皮状丝孢酵母TrichosporoncutaneumCGMCC2.571发酵液,使用酸热法提取油脂,收集得到氯仿层,旋转蒸发,得液体石蜡。取5个100 mL容量瓶,精确吸取不同剂量皮状丝孢酵母液体油脂0.02、0.016、0.012、0.01、0.008 g,配置浓度为0.2、0.16、0.12、0.1、0.08 g/L的油脂样品(溶剂为1∶2的乙醇∶正己烷)。取6根试管,其中5支试管加入配好的皮状丝孢酵母油脂样品各1 mL,1支加入蒸馏水,作为空白对照。把这6支试管放入沸水浴中,蒸干后加入2 mL98%硫酸,混匀,置于90 ℃水浴加热20 min,取出后在冰水浴中冷却至室温。加入0.25 g/L香草醛磷酸溶液3 mL,摇匀,室温反应20 min,在530 nm处测定吸光度。以油脂含量为横坐标,吸光度为纵坐标作图[24]。
1.3.4.6 菌体生物量测定(细胞干重法)
量取一定体积的待测发酵液V(mL)于已称重的7 mL的离心管(m1,g)中,8 000 r/min离心5 min。下层沉淀用蒸馏水洗涤3次后,8 000 r/min离心5 min,弃上清,下层沉淀放入鼓风干燥箱中105 ℃烘干至恒重,干燥器中自然冷却至室温后称总重量(m2,g)。菌体生物量以细胞干重(m,g/L)表示,计算公式[19]如下:
m=(m2-m1)×1 000/V
1.3.4.7 发酵动力学研究
为了研究产油脂酵母的生长、底物消耗以及产物生成的动力学特征,每隔12 h取样测定残糖量(S,g/L)、菌体生物量(X,g/L)及油脂产量(P,g/L),计算菌体的比生长速率μ(h-1)、底物比消耗速率Qs(h-1)和油脂比生成速率Qp(h-1),得到μ、Qs、Qp随发酵时间t(h)的变化规律,根据菌体生物量、油脂产量及残糖量的增减,计算其动力学参数,进行发酵动力学分析[19]。
1.3.4.8 油脂脂肪酸组成及相对含量的分析
样品甲酯化[25]:取样品油 0.1 g,加入0.5 mol/L KOH-甲醇溶液2 mL,于65 ℃水浴中皂化30 min,加入BF3-乙醚溶液(1∶1)0.2 mL,再在65 ℃水浴中甲酯化5 min,取出,迅速冷水冷却,加入石油醚2 mL,振荡,静置20 min,吸取上清液0.3~0.5 μL作为气相色谱的进样样品。
气相色谱检测条件:色谱柱是FFAP石英毛细管柱(30 m×0.32 mm×0.4 μm),柱温190 ℃,气化温度230 ℃,检测器(FID)温度230 ℃,载气(N2)流速41 mL/min,燃气(H2)流速33 mL/min,助燃气(空气)流速100 mL/min,分流比∶20∶1,进样量为1 μL。
不饱和脂肪酸指数(IUFA)=1×单烯酸质量分数/%+2×二烯酸质量分数/%+3×三烯酸质量分数/%+……+n×n烯酸质量分数/%。
定性方法:将测得的样品色谱图各峰的保留时间与脂肪酸标准品的保留时间作比较,确定样品色谱图各峰的性质。
定量方法:面积归一法。由于相同质量脂肪酸甲酯各组分在FID检测器上的响应值接近,不引入定量校正因子,各组分含量按下式计算:P=Ai/ ∑Ai×100%
式中:P表示组分的相对质量分数/%,Ai表示组分的峰面积,∑Ai表示各组分的峰面积总和。
2 结果与分析
2.1 不同脱毒方法下糠醛含量的检测
根据糠醛标准曲线y=0.186 8x+0.006 4(R2=0.999 7)计算得不同脱毒方法下糠醛的含量见表1。由表1可知,混合脱毒法脱毒效果较好,糠醛含量最低。因此,优先采用氢氧化钙与活性炭混合脱毒法进行纤维素水解液原液的脱毒处理,以防有毒物质对产油酵母的生长产生抑制作用。

表1 不同脱毒方法下糠醛含量的检测
2.2 ZZ-46在脱毒与未脱毒水解液中产油脂能力的比较
将TrichosporondermatisZZ-46接种在脱毒水解液的发酵培养基与未脱毒水解液的发酵培养基中,发酵120 h后,计算其油脂产量,比较TrichosporondermatisZZ-46在脱毒与未脱毒水解液中发酵产油脂的能力,结果见表2:
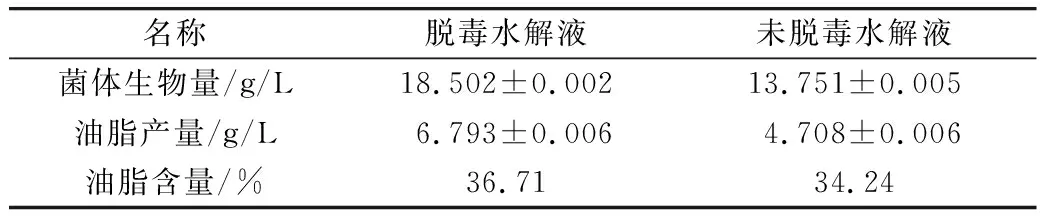
表2 ZZ-46利用不同水解液发酵产油能力
根据皮状丝孢酵母油脂的磷酸香草醛显色法标准曲线公式y=3.325 7x-0.095 4(R2=0.999 2)进行计算,结果显示产油酵母在脱毒水解液中长势较好,且生物量达到18.502 g/L,油脂质量分数达到36.71%,而未脱毒水解液中菌体生物量是13.751 g/L,油脂质量分数为34.24%。所以,TrichosporondermatisZZ-46菌株在脱毒水解液中产油能力要高于未脱毒水解液。

图1 ZZ-46在不同水解液发酵120h的光学显微镜照片
由图1可以看出,TrichosporondermatisZZ-46菌株培养120 h后,在脱毒水解液中菌体生物量和产油能力明显高于未脱毒水解液。
2.3 ZZ-46利用水解液发酵过程的研究
利用混合脱毒的水解液,添加适合TrichosporondermatisZZ-46生长所需的微量元素营养物质,在25 ℃,120 r/min的条件下进行摇床发酵培养,每隔12 h取样一次,测定其生物量、油脂产量和残糖量。
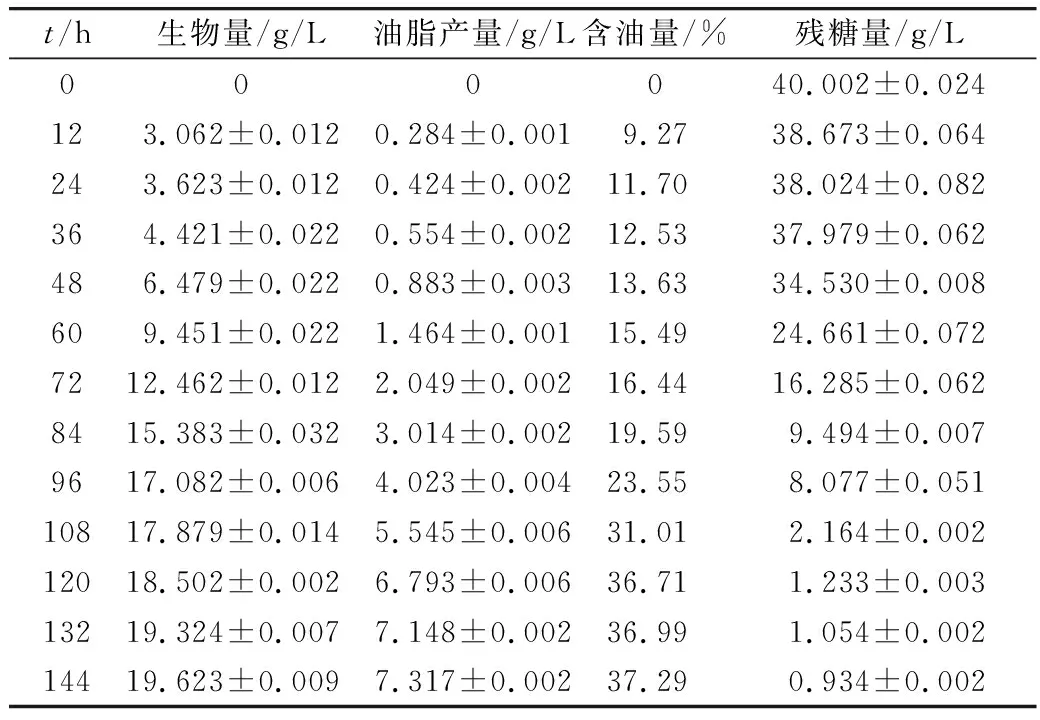
表3 ZZ-46利用脱毒水解液发酵产油情况
由表3可知,随着时间的增加,菌体生物量、油脂产量逐渐增大,残糖量逐渐减少。油脂含量在120 h后上升平缓,在144 h达到最高峰37.29%。菌体生物量前36 h变化都比较缓慢,在36~96 h才有明显升高,菌体生长旺盛,处于对数生长期。96 h后,由于对数生长期细胞的大量繁殖,培养基中营养物质消耗,有害物质逐渐积累,菌体生物量增长变缓,菌体生长趋于稳定。120 h后,由于发酵液的黏度增大使通氧受限、营养物质的缺乏以及有毒抑制物的存在等不利因素的影响,使其发酵过程减慢,菌体开始进入减速期。可见,最佳培养时间为120 h。

图2 ZZ-46在不同时期的光学显微镜照片
由图2可知,TrichosporondermatisZZ-46菌株在培养初期,细胞呈圆杆状,随着培养时间的延长,细胞形状逐渐变成椭圆形,细胞内逐渐产生1~4个脂肪球,有的多于4个,脂肪球较大,占细胞体积比例也较大。培养120 h后,菌体生物量、油脂产量无明显区别,菌体生长趋于稳定。因此,最佳培养时间为120 h。
2.4 ZZ-46发酵动力学参数分析
为了探讨ZZ-46的生长、底物消耗、产物生成特征,在 25 ℃,120 r/min的条件下利用混合脱毒的水解液进行发酵培养,每隔12 h取样测定菌体生物量X、残糖量S及油脂产量P,计算菌体利用水解液中还原糖的比生长速率μ、底物比消耗速率Qs和油脂比生成速率Qp,得到μ、Qs和Qp随发酵时间的变化规律,结果如图3所示。
由图3可知:在培养前12 h,菌体比生长速率μ和总底物比消耗速率Qs迅速增长,在12~24 h期间达到最大值。同时,油脂比生成速率Qp增长不大。这说明此时菌体大量繁殖消耗营养物质,而几乎不积累油脂。此后,菌体比生长速率μ和总底物比消耗速率Qs则迅速降低,油脂比生成速率快速增长,在72~84 h期间达到最高,84 h之后比较稳定,说明此时细胞内开始积累油脂。随着时间延长,120 h后菌体生长进入减速期,生长产油能力逐渐减退。
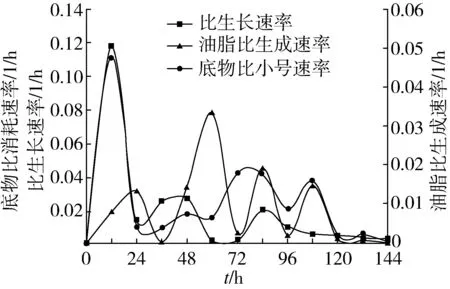
图3 ZZ-46发酵产油脂的μ、Qs、Qp变化曲线
2.5 ZZ-46在脱毒水解液中产油脂的脂肪酸组成分析
由表4分析可知:ZZ-46菌株利用木质纤维素脱毒水解液产生的菌油以油酸为主,其次为棕榈酸、亚油酸,三种脂肪酸约占总脂肪酸的81.58%。其中,油酸含量占36.2%、棕榈酸含量占22.77%、亚油酸含量占22.61%。ZZ-46不饱和脂肪酸指数(IUFA)也比较高,大于85%,还能形成一部分多不饱和脂肪酸,这些脂肪酸具有一定的保健功能和对某些疾病有一定的治疗效果等[26]。

图4 脂肪酸标准品的气相色谱图谱
表4 ZZ-46在脱毒水解液发酵培养基中产油脂肪酸组成分析

种类月桂酸C12∶0豆蔻酸C14∶0棕榈酸C16∶0棕榈油酸C16∶1硬脂酸C18∶0油酸C18∶1亚油酸C18∶2亚麻酸C18∶3未知IUFA%ZZ-460.060.8722.771.4612.6436.2022.611.162.2386.36
3 结论
3.1 通过对不同脱毒方法下水解液中糠醛含量的测定,确定了氢氧化钙+活性炭混合脱毒法为最佳方法。其中,原水解液糠醛含量为1.565 μg/mL,氢氧化钙、活性炭、混合脱毒法脱毒后糠醛含量分别为:0.397、0.135、0.032 2 μg/mL。混合脱毒法糠醛含量最低,优先选用混合脱毒法进行脱毒处理。
3.2 在研究ZZ-46利用木质纤维素水解的发酵产油脂能力时,随着时间的延长,菌体生物量、油脂产量逐渐增大,油脂含量在120 h左右趋于稳定。同时,残糖量逐渐减少,直至达到0.934 g/L。菌体生物量前36 h变化都比较缓慢,在36~96 h才有明显升高,菌体生长旺盛,处于对数生长期。96 h后,由于对数生长期细胞的大量繁殖,培养基中营养物质消耗,有害物质逐渐积累,菌体生物量增长变缓,菌体生长趋于稳定。120 h后,由于发酵液的黏度增大使通氧受限、营养物质的缺乏以及有毒抑制物的存在等不利因素的影响,使其发酵过程减慢,菌体开始进入减速期。可见,最佳培养时间为120 h。
3.3 由发酵生长动力参数可得:菌株的底物消耗与菌体生长同步,属于与菌体生长相关型,而油脂积累则属于与菌体生长部分相关型。
3.4 ZZ-46菌株利用木质纤维素脱毒水解液产生的菌油不饱和脂肪酸含量较高。
