右美托咪定对肺癌切除术患者应激反应的影响
2019-01-15幸泽艇王梅王万辉钟钦文巫光华钟玉婷叶军明
幸泽艇 王梅 王万辉 钟钦文 巫光华 钟玉婷 叶军明

【摘要】 目的:觀察在胸腔镜肺癌切除术中运用右美托咪定(DEX)对围术期患者应激反应的影响。方法:选择胸外科住院的非小细胞性肺癌患者,随机分C组(生理盐水)和DEX组(右美托咪定),双盲隐藏,各组均60例。DEX组麻醉诱导前10 min开始给予负荷量0.5 μg/kg泵注,后给予维持剂量为0.6 μg/(kg·h)。观察并记录患者入手术室时(T0)、插管后即刻(T1)、切皮时(T2)、肿瘤切除后即刻(T3)、拔管后即刻(T4)、拔管后30 min(T5)的SBP、DBP和HR,并在T0~T5各时间点抽静脉血5 mL检测NE、E、CRH、Glu,观察苏醒时间、拔管时间及VAS和苏醒期躁动、寒战的发生情况。结果:DEX组的SBP、DBP、HR、NE、E、CRH、Glu均显著低于C组(P<0.01)。T1~T5时C组DBP、HR、NE、E、CRH、Glu显著高于T0(P<0.01),T1~T3、T5时DEX组DBP、HR低于T0(P<0.05),T4时DEX组DBP、HR高于T0(P<0.05)。与C组比较,DEX组苏醒时间、拔管时间无明显差异(P>0.05),而VAS更低(P<0.05),躁动、寒战发生率更低、程度更轻(P<0.05)。结论:右美托咪定使围术期血流动力学波动小,抑制神经内分泌激素分泌,苏醒期不良反应小,不影响苏醒及拔管。
【关键词】 右美托咪定 应激 去甲肾上腺素 促肾上腺皮质激素释放激素 糖皮质激素
[Abstract] Objective: To study the influence of Dexmedetomidine (DEX) on stress reaction in patients with lung cancer resection by the thoracoscope. Method: The total of 120 patients with lung cancer in hospital were selected according to the inclusion and exclusion criteria who signed the informed consent forms, they were randomly distributed to two groups: group C (n=60) and group DEX (n=60) with double blind. Group C was given normal saline, group DEX was given Dexmedetomidine. All patients were received intravenously at a rate of 0.5 μg/kg 10 min prior to the onset of anesthesia induction, and then maintained with the dose of 0.6 μg/(kg·h). The SBP, DBP, HR, NE, E, CRH and Glu, awake time and extubate time, VAS and the incidence and degree of agitation and shiver happened in the T0, T1, T2, T3, T4 and T5 were observed and recorded. Result: Compared with group C, the levels of SBP, DBP, HR, NE, E, CRH and Glu of DEX group were significantly lower (P<0.01). The levels of DBP, HR, NE, E, CRH, Glu at T1-T5 in group C were significantly higher than those of T0 (P<0.01), DBP and HR at T1-T3 and T5 in DEX group were lower than those of T0 (P<0.05), DBP and HR at T4 in DEX group were higher than those of T0 (P<0.05).Compared with group C, the difference of wake up time and extubate time in group DEX was not statistical different(P>0.05), but VAS decreased more (P<0.05). Compared with group C, the incidence and degree of agitation and shiver happened in group DEX was respectively lower and lighter (P<0.05). Conclusion: Dexmedetomidine reduces hemodynamic fluctuation during perioperative period, inhibits neuroendocrine hormone secretion, has little adverse reactions during waking period, and does not affect waking and extubation.
[Key words] Dexmedetomidine Stress Norepinephrine Corticotrophin releasing hormone Glucocorticoids
First-authors address: Fraternity Hospital of Zhongshan City, Zhongshan 528400, China
doi:10.3969/j.issn.1674-4985.2019.34.002
右美托咪啶(dexmedetomidine, DEX)对肾上腺素受体α2具有高选择性。人体中枢神经系统广泛分布α2受体(尤其是蓝斑和胶质的突触前α2受体),DEX作用突触前膜的α2受体直接调节神经介质的释放(去甲肾上腺素),调节交感神经的负反馈机制,抑制交感神经突触小泡进一步释放去甲肾上腺素,同时刺激突触后α2AR激活钾离子通道,引起神经细胞膜超极化,减少神经元放电[1-2]。DEX作用中枢神经系统α2受体最密集的区域—脑干蓝斑,调解觉醒与睡眠,引发并维持自然非动眼睡眠(NREM)状态,产生镇静、催眠、抗焦虑作用[1-2]。DEX对围术期应激反应的作用如何,尤其是对肺癌切除术应激反应的情况,目前国内外相关文獻较少。本研究通过观察DEX对胸腔镜下肺癌切除术的血流动力学、神经内分泌相关指标及苏醒期的苏醒时间、拔管时间、疼痛评分、不良反应(躁动、寒战等)的影响,了解该药对肺癌切除术应激反应的抑制作用,以期提供理论依据及临床经验,现报道如下。
1 资料与方法
1.1 一般资料 经过赣南医学院第一附属医院伦理委员会批准,自2014年10月-2017年10月,严格按照纳入、排除标准选择医院胸外科住院的非小细胞性肺癌患者120例,所有患者或委托人均签署知情同意书,采用随机数字表法随机分组,分为试验组(DEX组)和对照组(C组),双盲法,每组60例。纳入标准:(1)美国麻醉医师协会(ASA)I~Ⅱ级;(2)无严重心肺功能低下或近期内心绞痛发作者;(3)Hb≥100 g/L,HCT≥30%;(4)无肺部感染或者其炎症已经控制;(5)年龄40~65岁;(6)肺部第一次手术;(7)无喉返神经或膈神经麻痹的患者;(8)肺部CT检查提示肺癌无远处转移者;(9)无原发性高血压、抑郁症、精神分裂症、心脑血管意外疾病史、肝肾功能不全、神经精神疾病、内分泌紊乱者。排除标准:甲亢、体温大于38 ℃或小于36 ℃、术中输血、小细胞肺癌、脓胸、胸腔粘连、麻醉禁忌或其他手术禁忌者、电解质紊乱、肥胖、凝血功能异常等者。
1.2 方法 药物配制:两组药物均由同一护士根据信封内分组情况于患者手术当日入室时配制,注射器上均标注为“SY药物”。DEX组:使用前以0.9%的氯化钠注射液(NS)稀释,即DEX 0.1 mg+49 mL NS[DEX:盐酸右美托咪定注射液,辰欣药业股份有限公司,国药准字H20130027,2 mL∶0.2 mg(按右美托咪定计)],C组:50 mL NS。两组药液摇匀,均无色透明,输注泵泵注。
患者术前不使用镇静、镇痛药物。入手术室后开放静脉通道,心电监测仪监测ECG、SpO2、BP、HR、PETCO2。麻醉方法:双腔气管导管插管全身麻醉,Narcotrend仪监测麻醉深度,肌松仪监测肌松情况。麻醉药物:枸橼酸舒芬太尼注射液,宜昌人福药业有限责任公司,国药准字H20054172,1 mL︰50 μg;丙泊酚注射液,清远嘉博制药有限公司,国药准字H20051843,10 mL︰0.1 g;注射用苯磺酸阿曲库铵,上海恒瑞医药有限公司,国药准字H20061298,25 mg*10瓶;注射用盐酸瑞芬太尼(瑞捷),宜昌人福药业有限责任公司,国药准字H20030197,1 mg(以C20H28N2O5计)。麻醉诱导:依次给予舒芬太尼0.4 μg/kg、丙泊酚2 mg/kg(泵注)、阿曲库胺0.6 mg/kg静脉推注,Narcotrend监测麻醉深度,麻醉深度指数NI为40左右时开始插入双腔支气管导管,用纤维支气管镜确定双腔支气管位置。麻醉维持:泵注丙泊酚5~6 mg/(kg·h),瑞芬太尼0.15~0.30 μg/(kg·min)(用生理盐水配制成20 μg/mL),阿曲库胺15~25 mg/h,术中根据Narcotrend调整丙泊酚维持NI在35~45,肌松仪的监测情况追加阿曲库胺,在准备关闭胸腔前30 min时根据肌松监测仪指导肌松药的应用,术毕前30 min舒芬太尼0.1 μg/kg,手术结束时停止泵注丙泊酚及瑞芬太尼。试验药物负荷量:0.5 μg/kg(麻醉诱导前10 min开始泵注“SY药物”,泵注10 min);试验药物维持量:本试验采用DEX 0.6 μg/(kg·h)作为麻醉时的维持剂量,持续泵注至手术结束。手术结束至恢复室时间7~8 min。
手术室、恢复室温度24~25 ℃,输注的液体36 ℃,消毒后铺巾,监测鼻咽窝体温,麻醉诱导后桡动脉置管监测有创动脉血压,右侧颈内静脉穿刺置管监测CVP。机械控制通气:通气频率12~18次/min,Vt 8~10 mL/kg,I︰E=1︰2,FiO250%,调整呼吸参数,使PETCO2保持于30~35 mm Hg,每小时行血气分析,及时调整体内环境。手术结束后患者进入麻醉恢复室,棉被覆盖保温,继续监测ECG、SpO2、MAP、HR、T。
1.3 观察指标及评价标准 观察并记录患者入手术室时(T0),插管后即刻(T1)、切皮时(T2)、肿瘤切除后即刻(T3)、拔管后即刻(T4)、拔管后30 min(T5)的收缩血压(SBP)、舒张压(DBP)和心率(HR),并在T0、T1、T2、T3、T4、T5各时点抽取同部位非输液侧外周静脉血5 mL,本院检验科检测去甲肾上腺素(NE)、肾上腺素(E)、促肾上腺皮质激素释放激素(CRH)、糖皮质激素(GC)、血糖(Glu),同时记录苏醒时间、拔管时间和观察苏醒期躁动、寒战的发生情况。躁动程度(参考纪维等,2007):0级为患者安静合作;1级为被询问时主述不适,但不伴有行为反应;2级为频繁主动表示不适,3级为频繁有行为反应,如四肢乱动,甚至要拔掉导尿管。当患者出现2级以上躁动,可适当镇静,如异丙酚0.5 mg/kg。寒战程度参照Wrench分级:0级没有发抖,1级面部或颈部肌肉轻度自发性的收缩,2级涉及一个以上的肌肉组织颤抖,3级涉及整个身体的肌肉活动。2级以上寒战可药物治疗,如曲马朵0.5~1.0 mg/kg。VAS超过4.0 cm追加舒芬太尼0.5~1.0 μg/kg。
1.4 统计学处理 采用SPSS 19.0统计软件进行分析,计量资料采用(x±s)表示,计量资料两组比较采用可重复测量方差检验,根据条件进行各因素间的比较,各时间点组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料采用率(%)表示,分级比较采用字2检验,以P<0.05为差异有统计学意义。
2 结果
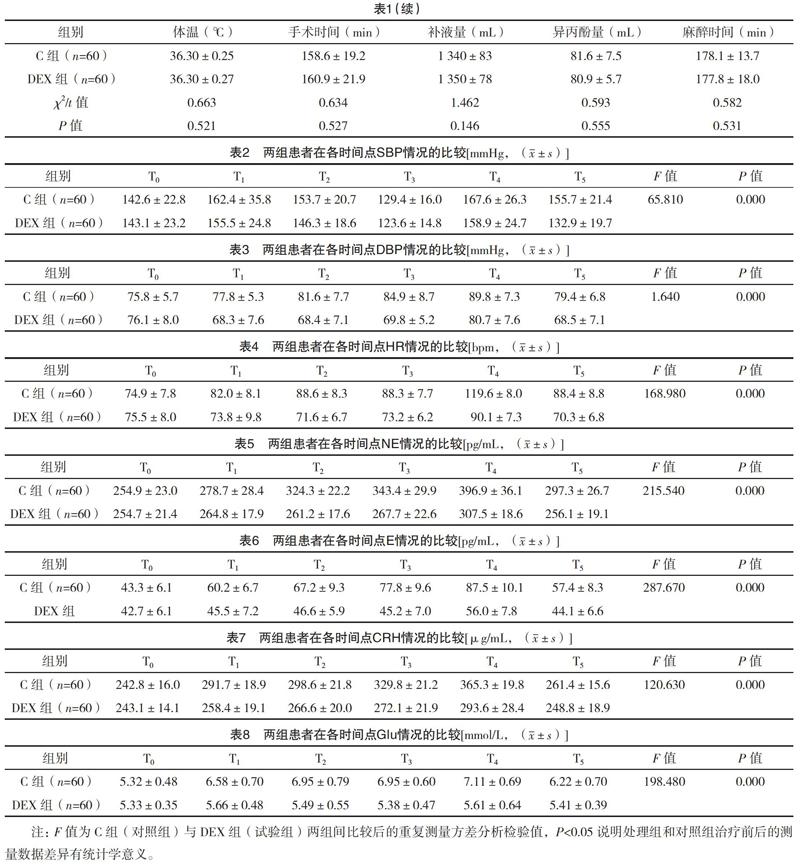
2.1 两组基线资料比较 两组患者均顺利完成试验,在性别、年龄、体重上比较差异均无统计学意义(P>0.05);在手术时间、补液量、麻醉药泵注时间和总的剂量上比较,差异均无统计学意义(P>0.05)。两组患者均手术过程顺利,无明显麻醉相关并发症,也无术后严重并发症或死亡的情况。见表1。
2.2 两组患者围手术期应激情况的比较 两组患者在各时间点SBP、DBP、HR、NE、E、CRH、Glu情况的比较,见表2~8。DEX组的SBP、DBP、HR、NE、E、CRH、Glu均显著低于C组(P<0.01)。T1~T5时C组DBP、HR、NE、E、CRH、Glu显著高于T0(P<0.01),T1~T3、T5时DEX组DBP、HR低于T0(P<0.05),T4時DEX组DBP、HR高于T0(P<0.05)。
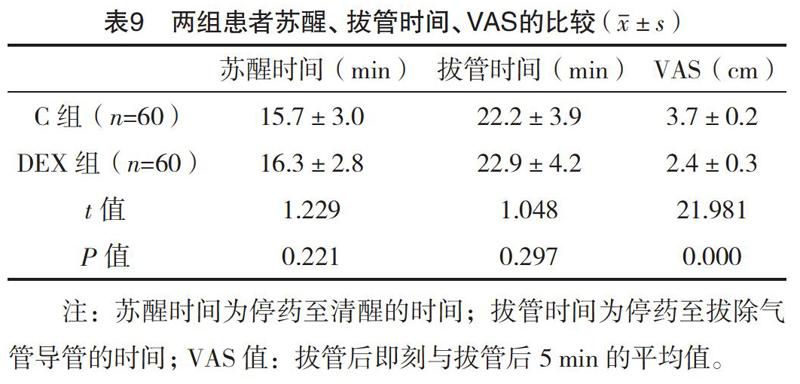
2.3 两组患者苏醒期情况的比较 与C组比较,DEX组苏醒时间、拔管时间比较,差异均无统计学意义(P>0.05),而DEX组VAS显著性下降(P<0.01)。见表9。
2.4 两组患者围手术期的不良反应发生情况的比较 2级以上的躁动、寒战需要治疗,故称2级以上为不良反应,其发生率=(2级例数+3级例数)/(0级例数+1级例数+2级例数+3级例数)×100%。与C组比较,DEX组在苏醒期躁动和寒战的发生率显著性降低、程度分级显著性降低,差异有统计学意义(P<0.01)。见表10。
3 讨论
据WHO统计显示,肺癌仍是目前发病率和死亡率最高的癌症之一,其首选治疗方法仍然是手术治疗[3]。2000年Yim等[4]研究证实肺癌开胸切除术较胸腔镜手术应激反应大。很多研究已证明,创伤部位的刺激传入是引起围术期应激反应的主要机制。Jung等[5]证明深麻醉状态时较浅麻醉应激反应小,但是目前大多数学者认为吸入性全身麻醉和静脉复合麻醉均不能有效地减轻患者应激反应的激素分泌,单纯依靠增加吸入麻醉药的浓度和静脉麻醉药的剂量来抑制应激反应的作用有限。如何提供良好的手术操作条件以及减少麻醉、手术等应激反应,均是目前麻醉学研究的热点。
在应激反应中,应激原刺激外周感受器,一条通路是上传激活蓝斑—去甲肾上腺素能神经元/交感—肾上腺髓质系统(LC/NE)[1-2],导致儿茶酚胺(CA)分泌增多、交感神经活动增强;另外一条旁路是由蓝斑传入大脑皮层、边缘系统刺激下丘脑,激活下丘脑—垂体—肾上腺皮质激素系统[1-2],应激原刺激后引起促肾上腺皮质激素释放激素CRH和促肾上腺皮质激素ACTH分泌增多,进而促进糖皮质激素GC(主要为皮质醇)的分泌,使糖、脂肪和蛋白质分解,加强糖异生,升高血糖。肺癌胸腔镜切除术中的各种刺激,可导致患者心血管、神经、内分泌等系统出现应激反应,并可能诱发围术期出现一些不良反应,如躁动、寒战、低氧血症等。而右美托咪定(DEX)是α2肾上腺受体激动剂,通过上述机制抑制应激反应的作用,从而产生抗焦虑、镇静、镇痛等作用[1-2]。因此,本研究观察右美托咪定对肺癌切除术中应激反应的抑制作用,减少并发症的发生率。本研究采用SBP、DBP、HR、NE、E、CRH、Glu等多种量化指标综合评价,研究结果相对更科学合理。
在DEX对心血管系统影响方面,Li等[6]研究发现,DEX组气管插管后1、3、5 min的HR、SBP、DBP较艾司洛尔组更稳定,即DEX快速序贯诱导气管插管的血流动力学反应更小。Wang等[7]研究发现DEX组患者给予DEX后的各时间点HR、MAP值与空白对照组比较显著性下降。Jiang等[8]meta分析发现,DEX可显著性抑制MAP和HR升高,MAP[MD=-13.53,95%CI(-18.48,-8.57)],HR[MD=-10.39,95%CI(-14.05,-6.74)]。2012年Riha等[9]将氯胺酮与右美托咪定(KET-DEX)麻醉与七氟醚-舒芬太尼麻醉比较,表明KET-DEX对心脏保护作用更强,原因可能是DEX可以抑制交感神经兴奋、降低儿茶酚胺的浓度。Gong等[10]研究发现,在先天性心脏病患者的心脏手术中DEX使MAP、HR、CVP在治疗后各时间点均较对照组下降,可以有效地保证血流动力学平稳,达到降低氧耗、保护心肌的作用。本研究中DEX组患者应用DEX治疗后SBP、DBP、HR较对照组下降,研究结果与Callaway等[11]一致,说明DEX能抑制手术、麻醉等刺激对机体心血管系统引起的应激反应。患者表现为血压降低、心率减慢和镇静等状态,可能与中枢神经系统突触后α2受体的激活产生交感神经的抑制作用有关[1,7]。
在DEX对神经内分泌激素及血糖影响方面,Jung等[5]研究表明,肺叶切除术中深麻醉状态患者血浆中的去甲肾上腺素和血糖浓度均低于浅麻醉状态者。Li等[12]观察90例患者行部分胃切除术,研究发现右美托咪定+全凭静脉麻醉(total intravenous anesthesia, TIVA)与硬膜外麻醉+TIVA两组中的各时间点(术前、气管插管、切皮、腹部探查、拔管)血浆中的NE、皮质醇浓度几乎相同,差异无统计学意义(P>0.05),但两组三个变量值均较对照组明显降低,麻醉过程更平稳,说明DEX抑制应激反应作用明显,且与硬膜外阻滞作用相当。有学者认为右美托咪定静脉输注用于短期镇静时,对类固醇的生成没有抑制作用[13]。宋亚男等[14]研究发现DEX组与对照组比较皮质醇差异无统计学意义,但对照组皮质醇波动较大;而两组间血糖水平在拔除气管导管的时间点差异有统计学意义,该学者认为可能与使用DEX剂量较小有关。研究中的血糖在拔除气管导管期间出现差异,分析原因可能:一是患者苏醒期麻醉药物逐渐代谢,拔管时各种刺激较手术中相对更强烈;二是小剂量DEX也能通过抑制下丘脑-垂体-肾上腺皮质激素使DEX组的血糖低于对照组。Jiang等[8]研究发现右美托咪定减少血浆中皮质醇和血糖的浓度,对脑氧代谢率无影响,能改善脑缺血损伤并发挥脑保护作用。本研究中与C组比较,DEX组T1~T5时NE、E、CRH、Glu降低,说明DEX能降低双腔支气管导管麻醉、手术对机体的刺激反应。DEX降低围术期患者血浆的NE和E水平,说明DEX抑制了蓝斑—去甲肾上腺素能神经元/交感—肾上腺髓质系统(LC/NE)通路;而DEX降低围术期患者血浆中CRH浓度和血糖水平,说明DEX也抑制了下丘脑-垂体-肾上腺皮质激素系统通路。由此表明,上述两条通路均被抑制。根据Li等[12]研究,DEX与硬膜外阻滞抑制应激反应的作用相当,故认为DEX抑制应激反应作用明显且完善,也能降低应激反应产生的内环境变化。
在DEX對患者苏醒情况影响方面,2010年Lazol等[15]研究发现在手术结束前给予静脉输注DEX对拔管时间及苏醒时间均无明显影响,同时可以有效减轻躁动、呛咳等不良反应。Wang等[7]对六个研究中DEX组与空白对照组比较,分析发现两组患者拔管时间也无明显差异。本研究中DEX组苏醒时间、拔管时间与C组比较差异无统计学意义(P>0.05),说明两组患者在苏醒时间及拔管时间上没有区别,即DEX不会延长全麻气管插管患者苏醒和拔管的时间。
在DEX对患者镇痛作用方面,2008年Yoshitomi等[16]研究发现DEX可以通过激活α2受体提高利多卡因的局部麻醉作用,同类药可乐定可以直接抑制周围神经活动,在脊髓运用该药可产生镇痛作用。Weerink等[1]研究表明,脊髓及脊髓上、甚至外周的α2AAR及α2CAR均参与镇痛作用。本研究中DEX组VAS值与C组比较差异有统计学意义(P<0.01),说明右美托咪定治疗后患者疼痛减轻,也即DEX抑制了手术区域对患者的疼痛刺激反应,可能与其外周镇痛作用机制相关[17]。
在DEX治疗不良反应方面,DEX可以治疗躁动、寒战[18-20],可能是其抑制患者疼痛、术前焦虑、手术及麻醉等刺激引起的应激反应有关[21]。有研究表明,DEX组的体温明显低于生理盐水组,但术后发生寒战的程度及比例均低于生理盐水组,其机制可能与外周神经传导通路抑制低体温信息的传入有关[22]。本研究中围术期全程静脉麻醉,同时采取了保温措施,实时监测体温,避免体温的干扰。与C组比较,DEX组躁动、寒战发生的情况差异有统计学意义(P<0.05),DEX组躁动2级以上发生率明显低于C组[8.33%(5/60)vs 63.33%(38/60)],DEX组寒战2级以上发生率明显低于C组[1.67%(1/60)vs 30%(15/60)],说明DEX组患者躁动、寒战发生率显著性减少,程度降低。分析认为可能是DEX具有镇静、镇痛、抗焦虑的作用[1,2],能降低寒战的阈值[13],从而达到抑制寒战的作用[1,20]。有研究证明DEX可以减少手术后恶心和呕吐的发生率,减少术后的氧代谢需求[23],甚至有保护肾、心、脑等重要脏器的作用[24-27]。
综上所述,右美托咪定使围术期患者血流动力学波动小,可降低患者血浆去甲肾上腺素、肾上腺素及促肾上腺皮质激素释放激素的释放,血糖水平低,使患者在苏醒期疼痛程度更轻;躁动及寒战发生率更低、程度更轻;同时又不影响苏醒和拔管时间。而且,文献[28-30]表明右美托咪定在缺血再灌注损伤中能抑制氧化应激及炎症反应,改善缺血再灌注损伤引起的肺微循环高渗透性,可上调单肺通气时肺组织血红素氧合酶-1(HO-1),保护肺功能,该药又能保护心功能、脑功能[26-27],可以有效降低术后谵妄的发生率[31]。由此可见,右美托咪定可以减少患者围术期应激反应,降低患者围术期并发症的发生率,因此,该药可以在临床麻醉中推广应用,加速外科患者康复。
参考文献
[1] Weerink M A S, Struys M M R F, Hannivoort L N, et al. Clinical Pharmacokinetics and Pharmacodynamics of Dexmedetomidine[J].Clin Pharmacokinet,2017,56(8):893-913.
[2] Li A, Yuen V M, Goulay-Dufay S, et al. Pharmacokinetics and Pharmacodynamics of Dexmedetomidine[J].Drug Dev Ind Pharm,2016,42(12):1917-1927.
[3] Liu L, Shi M, Wang Z, et al. A Molecular and Staging Model Predicts Survival in Patients With Resected Non-small Cell Lung Cancer[J].BMC Cancer,2018,18(1):996.
[4] Yim APC, Wan S, Lee T W, et al.VATS lobectomy reduces cytokine responses compared with conventional surgery[J].The Annals of Thoracic Surgery,2000,70(1):243-247.
[5] Jung S M,Cho C K.The Effects of Deep and Light Propofol Anesthesia on Stress Response in Patients Undergoing Open Lung Surgery:A Randomized Controlled Trial[J].Korean J Anesthesiol,2015,68(3):224-231.
[6] Li Z, Xu L, Zheng J, et al. Comparison of Intravenous Dexmedetomidine versus Esmolol for Attenuation of Hemodynamic Response to Tracheal Intubation after Rapid Sequence Induction: A Systematic Review and Meta-Analysis[J].Biomed Res Int,2019,2019:6791971.
[7] Wang G, Zhang L, Lou S, et al. Effect of Dexmedetomidine in Preventing Postoperative Side Effects for Laparoscopic Surgery: A Meta-Analysis of Randomized Controlled Trials and Trial Sequential Analysis (PRISMA)[J].Medicine,2016,95(10):e2927.
[8] Jiang L,Hu M,Lu Y,et al.The Protective Effects of Dexmedetomidine on Ischemic Brain Injury: A Meta-Analysis[J].
J Clin Anesth,2017,40:25-32.
[9] Riha H,Kotulak T,Brezina A,et al.Comparison of the effects of ketamine-dexmedetomidine and sevoflurane-sufentanil anesthesia on cardiac biomarkers after cardiac surgery: an observational study[J].Physiol Res,2012,61(1):63-72.
[10] Gong J,Zhang R,Shen L,et al.The Brain Protective Effect of Dexmedetomidine During Surgery for Paediatric Patients with Congenital Heart Disease[J].J Int Med Res,2019,47(4):1677-1684.
[11] Callaway C W,Elmer J,Guyette F X,et al.Dexmedetomidine Reduces Shivering during Mild Hypothermia in Waking Subjects[J].PLoS One,2015,10(8):e0129709.
[12] Li Y,Wang B,Zhang L L,et al.Dexmedetomidine Combined with General Anesthesia Provides Similar Intraoperative Stress Response Reduction When Compared with a Combined General and Epidural Anesthetic Technique[J].Anesth Analg,2016,122(4):1202.
[13]汤龙信,丁璐,张在旺.右美托咪定的药效动力学、药代动力学及临床应用研究进展[J].临床误诊误治,2018,31(11):117-122.
[14]宋亚男,赵艳,郭向阳.右美托咪定复合全麻对围术期应激反应的影响[J].中国微创外科杂志,2018,18(10):10-15.
[15] Lazol J P,Lichtenstein S E,Jooste E H,et al.Effect of dexmedetomidine on pulmonary artery pressure after congenital cardiac surgery: a pilot study[J].Pediatr Crit Care Med,2010,11(5):589-592.
[16] Yoshitomi T,Kohjitani A,Maeda S,et al.Dexmedetomidine enhances the local anesthetic action of lidocaine via an alpha-2A adrenoceptor[J].Anesth Analg,2008,107(1):96-101.
[17] Tang C,Xia Z.Dexmedetomidine in Perioperative Acute Pain Management: a Non-Opioid Adjuvant Analgesic[J].J Pain Res,2017,10:1899-1904.
[18] Roosens E,Mulier J P,Heylens G,et al.The Use of Dexmedetomidine in Extreme Agitation[J].Tijdschr Psychiatr,2017,59(9):554-558.
[19] Lamontagne C,Lesage S,Villeneuve E, et al.Intravenous Dexmedetomidine for the Treatment of Shivering during Cesarean Delivery under Neuraxial Anesthesia: A Randomized-Controlled Trial[J].Can J Anaesth,2019,66(7):762-771.
[20] Zhang J,Zhang X,Wang H,et al.Dexmedetomidine as a Neuraxial Adjuvant for Prevention of Perioperative Shivering: Meta-analysis of Randomized Controlled Trials[J].PLoS One,2017,12(8):e0183154.
[21] Peng K,Wu S R,Ji F H,et al.Premedication With Dexmedetomidine in Pediatric Patients: A Systematic Review and Meta-analysis[J].Clinics,2014,69(11):777-786.
[22]孫艺娟,罗辉,黄希照,等.不同剂量右美托咪定预防妇科腹腔镜手术患者全麻后寒战的临床观察[J].实用医学杂志,2014(12):1976-1978.
[23] Jin S,Liang D D,Chen C,et al.Dexmedetomidine Prevent Postoperative Nausea and Vomiting on Patients During General Anesthesia: A PRISMA-compliant Meta Analysis of Randomized Controlled Trials[J].Medicine,2017,96(1):e5770.
[24] Abdallah F W,Dwyer T,Chan V W S,et al.IV and Perineural Dexmedetomidine Similarly Prolong the Duration of Analgesia after Interscalene Brachial Plexus Block[J].Anesthesiology,2016,124(3):683.
[25] Chen Y,Feng X,Hu X,et al.Dexmedetomidine Ameliorates Acute Stress-Induced Kidney Injury by Attenuating Oxidative Stress and Apoptosis through Inhibition of the ROS/JNK Signaling Pathway[J].Oxid Med Cell Longev,2018,2018:4035310.
[26] Lempi?inen J,Finckenberg P,Mervaala E E,et al. Dexmedetomidine Preconditioning Ameliorates Kidney Ischemia-Reperfusion Injury[J].Pharmacol Res Perspect,2014,2(3):e00045.
[27] Riquelme J,Westermeier F,Pedrozo Z,et al.Dexmedetomidine Protects the Heart Against Ischemia-reperfusion Injury by an Endothelial eNOS/NO Dependent Mechanism[J].Pharmacol Res,2016,103:318-327.
[28] Chen Q,Yi B,Ma J,et al.α2-adrenoreceptor Modulated FAK Pathway Induced by Dexmedetomidine Attenuates Pulmonary Microvascular Hyper-permeability Following Kidney Injury[J].Oncotarget,2016,7(35):55990-56001.
[29] Zeng X Z, Wang H L, Xing X C, et al. Dexmedetomidine Protects Against Transient Global Cerebral Ischemia/Reperfusion Induced Oxidative Stress and Inflammation in Diabetic Rats[J].PLoS One,2016,11(3):e0151620.
[30] Gao S,Wang Y,Zhao J,et al.Effects of Dexmedetomidine Pretreatment on Heme oxygenase-1 Expression and Oxidative Stress During One-lung Ventilation[J].Int J Clin Exp Pathol,2015,8(3):3144-3149.
[31] Su X,Meng Z T,Wu X H,et al.Dexmedetomidine for Prevention of Delirium in Elderly Patients After Non-cardiac Surgery: A Randomised, Double-blind, Placebo-controlled trial[J].Lancet,2016,388(10054):1893-1902.
(收稿日期:2019-05-10) (本文編辑:周亚杰)
