水飞蓟宾通过调控AMPK活性抑制自由脂肪酸诱导的肝细胞炎症因子分泌
2019-01-15何彦瑶刘敏卓
罗 颂,张 羽,何彦瑶,刘敏卓
(1.湖南省儿童医院药学部,长沙 410007;2.中南大学化学化工学院,长沙 410083)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是由多种病因引起的以肝脏细胞内脂类物质异常积蓄为主要特征的临床综合征,其疾病谱包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎及相关肝硬化和肝细胞癌[1]。NAFLD与胰岛素抵抗2型糖尿病、动脉粥样硬化和高脂血症等疾病密切相关[2]。近年来随着人们生活水平的提高,NAFLD发病率逐年上升,发病年龄逐年下降,儿童和青少年的脂肪肝发病率逐年上升。NAFLD已成为危害人类健康最常见的慢性疾病之一[3]。研究发现,炎症与NAFLD密切联系,在NAFLD的患者和动物模型肝脏组织中肿瘤坏死因子-α(TNF-α)表达含量增加[4-5]。肝细胞炎症因子的分泌增加可引起肝细胞微环境炎性反应,而抗炎药物可改善NAFLD患者的临床症状[6]。
水飞蓟宾是从植物水飞蓟的种子和果实中提取得到的黄酮类化合物,其具有抗脂质过氧化、清除自由基、维持细胞膜稳定性和促进肝细胞再生的作用,临床主治各种急慢性肝炎、初期肝硬化和肝中毒等疾病[7-8]。研究发现,水飞蓟宾能增加高脂饮食诱导的小鼠胰岛素敏感性,改善肝脏脂质代谢[9]。有研究报道,水飞蓟宾可通过调节炎症小体NLRP3的组装而抑制炎症因子IL-1β的释放[10]。水飞蓟宾在高脂状况下抑制肝脏炎症反应的作用机制尚不清楚。
腺苷单磷酸活化蛋白激酶(AMPK)是调控细胞能量平衡的关键因子,AMPK的活化对非酒精性脂肪肝具有显著作用,能调节胆固醇代谢,改善血脂异常,还可抑制巨噬细胞炎症因子的合成[11],水飞蓟宾是否通过AMPK调节炎症因子的释放,目前还不清楚。本文通过自由脂肪酸诱导HepG2细胞炎症模型研究水飞蓟宾对炎症因子分泌减少的机制,为水飞蓟宾防治肝脏疾病提供了实验依据。
1 仪器与试药
1.1仪器 生物安全柜(美国Nuaire公司);二氧化碳培养箱(Thermo Fisher Scientific公司);倒置显微镜(德国卡尔蔡司公司);酶标仪(美国Thermo Scientific公司);SDS-PAGE凝胶Western Blot仪(美国Bio-Rad公司);实时荧光定量PCR仪(瑞士罗氏公司)。
1.2试药 水飞蓟宾(质量分数≥98%)、油酸(均为阿拉丁试剂有限公司);棕榈酸、油红O染色试剂(美国Sigma公司);TNF-α试剂盒,IL-1β试剂盒,Elisa试剂盒,AMPK抗体,β-actin抗体(博士德生物公司);p-AMPK抗体(美国CST公司);RIPA裂解液,BCA法蛋白定量试剂盒(碧云天生物公司);HepG2细胞(中科院上海细胞库);DMEM高糖培养基(Hyclone公司);小牛血清(Gibco公司);逆转录试剂盒,Real-time PCR试剂盒(大连宝生物有限公司)。
2 方法
2.1HepG2细胞的培养 HepG2细胞用含有体积分数为10%的胎牛血清、100 u·mL-1青霉素、质量浓度为100 μg·mL-1链霉素的RPMI-1640培养液于37 ℃、体积分数为5%的CO2培养箱中培养。当细胞密度生长至80%融合度时,用质量浓度为2.5 g·L-1的胰酶消化传代。
2.2水飞蓟宾对FFA诱导炎症因子生成的影响 将HepG2细胞密度调整为2.5×104个·mL-1,接种于24孔板。待细胞生长至合适密度,将细胞随机分为对照组、FFA处理组(500 μmol·L-1,油酸∶棕榈酸=2∶1)以及水飞蓟宾组(水飞蓟宾预孵育4 h后,加入500 μmol·L-1的FFA)。
2.3水飞蓟宾对HepG2细胞活力的影响 将HepG2细胞接种于96孔板,设置6个复孔。待细胞密度生长至60%时,用不同浓度的水飞蓟宾(0,5,10,20,40,80和160 μmol·L-1)处理24 h,换液后加入20 μL MTT溶液,培养2~4 h后,弃上清液。每孔加入200 μL的DMSO,待蓝色结晶溶解后,在酶标仪490 nm波长处检测吸光度值A,计算细胞的相对活性,实验重复3次。
2.4Elisa试剂盒法检测上清液中炎症因子的水平 用24孔板培养HepG2细胞,按照实验设计处理各组细胞后,收集每组细胞的上清液,按照Elisa试剂盒说明书检测细胞上清液中TNF-α和IL-1β的水平。
2.5基因表达分析 按照Trizol法提取细胞总RNA,测定总浓度后,将不同样品的RNA反转录为cDNA,用于Real-time PCR扩增。TNF-α和IL-1β的引物序列为:TNF-α:5′-AGCTGGTGGTGCCATCAGAGG-3′(上游),5′-TGGTAGGAGACGGCGATGCG-3′(下游)。IL-1β:5′-TGGCAATGAGGATGACTTGT-3′(上游),5′-TGGTGGTCGGAGATTCGTA-3′(下游),β-actin:5′-CTCTTCCAGCCTTCCTTCCT-3′(上游),5′-AGCACTGTGTTGGCGTACAG-3′(下游)。反应条件为:95 ℃预变性30 s,然后95 ℃ 5 s,60 ℃ 20 s,共45个循环,4 ℃终止反应。β-actin作为内参,用2-△△Ct法分析目的基因的相对表达量。
2.6Western Blot 收集细胞后加入适量PIPA裂解液(含磷酸酶抑制剂和蛋白酶抑制剂)进行总蛋白提取,采用BCA法测定蛋白浓度。用质量浓度为100 g·L-1的SDS-PAGE电泳分离蛋白,湿法转膜将蛋白条带移至PVDF膜上(250 mL,100 min),用5%脱脂奶粉封闭1 h后,加一抗AMPK和p-AMPK抗体4 ℃孵育过夜。洗涤后孵二抗1 h,增强化学发光ECL(enhanced chemilumin escence)底物化学发光显色后曝光,采图。Amersham Image 600图像分析系统进行条带灰度值分析,以β-actin为内参。
2.7油红O染色 细胞处理完毕后,用PBS缓冲液冲洗3次,用质量浓度为40 g·L-1的多聚甲醛固定细胞30 min。用体积分数为60%的异丙醇洗后晾干。加入适量体积分数为0.3%的油红O 溶液染色3 min。弃去油红O溶液,用体积分数为60%的异丙醇洗涤3次,显微镜下观察并拍照。定量分析时加入异丙醇将油红O溶解,在510 nm处测定吸光度值A。

3 结果
3.1水飞蓟宾对HepG2细胞活力的影响 MTT法检测不同浓度水飞蓟宾对HepG2细胞活力的影响,结果显示,与空白对照组比较,5,10,20,40,80和160 μmol·L-1的水飞蓟宾处理细胞24 h对细胞的活力无影响。见图1。
3.2水飞蓟宾降低FFA诱导炎症因子的表达 FFA可诱导肝细胞炎症因子分泌的增加,结果显示,500 μmol·L-1的FFA可增加HepG2细胞炎症因子IL-1β和TNF-α的mRNA和蛋白的表达。用80和160 μmol·L-1的水飞蓟宾预孵育细胞4 h后,FFA处理24 h,则降低IL-1β和TNF-α的mRNA和蛋白的表达,见图2。
3.3水飞蓟宾降低肝细胞内脂质的生成 HepG2细胞在FFA处理24 h后,会导致肝细胞内脂质生成。用油红O染色法观察细胞内脂质积累的情况,结果显示,FFA组能明显增加细胞内脂质生成,而水飞蓟宾80和160 μmol·L-1能降低细胞中脂质的生成。见图3。
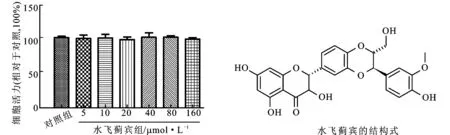
图1不同浓度水飞蓟宾对HepG2细胞活力的影响
Fig.1 Effect of different concentration silybin on the viability of HepG2 cells

图2水飞蓟宾对FFA诱导HepG2细胞炎症因子表达的影响
注:与对照组比较*P<0.05,**P<0.01,与FFA组比较#P<0.05。
Fig.2 Effect of silybin on the expression of inflammatory factor of HepG2 cells induced by FFA
Note:*P<0.05,**P<0.01 vs control group,#P<0.05 vs FFA group.

图3水飞蓟宾对FFA诱导HepG2细胞脂质生成的影响
注:与对照组比较***P<0.001,与FFA组比较##P<0.01。
Fig.3 Effect of silybin on the lipid accumulation in FFA-induced HepG2 cells
Note:***P<0.001 vs control group,##P<0.01 vs FFA group.
3.4水飞蓟宾通过AMPK调控HepG2炎症因子的生成 为了探讨水飞蓟宾是否通过AMPK调控炎症因子的生成,用免疫印迹法检测AMPK的变化。结果显示,FFA对HepG2细胞中AMPK的表达无显著影响,但能显著降低AMPK的磷酸化水平。水飞蓟宾(80 和160 μmol·L-1)可增加p-AMPK的表达。用AMPK抑制剂(compound C)或水飞蓟宾(80 μmol·L-1)预孵育HepG2细胞,用FFA处理,结果显示,AMPK抑制剂可阻止水飞蓟宾对炎症因子的生成。见图4。
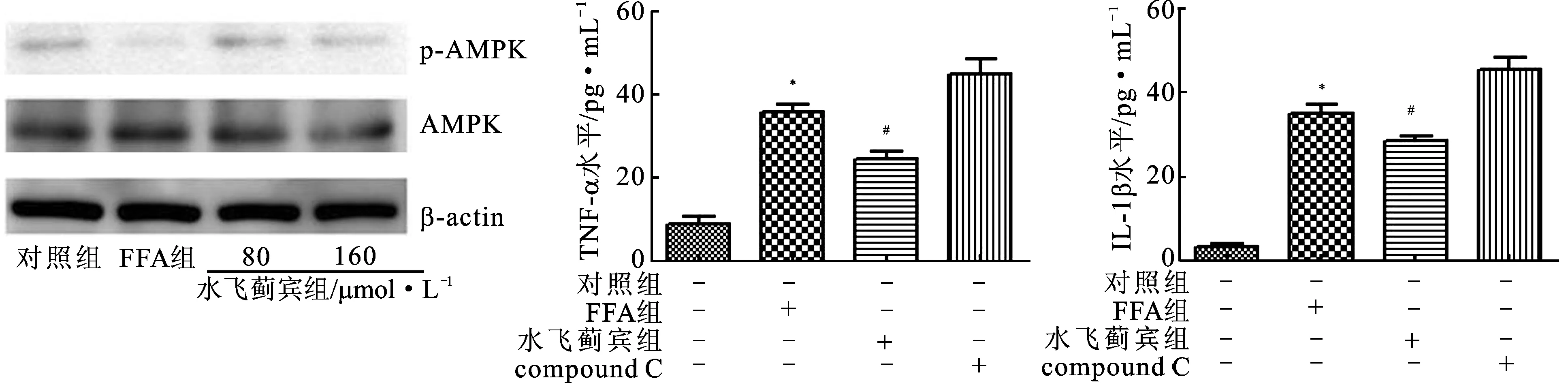
图4Silybin通过AMPK调节HepG2炎症因子的生成
注:与对照组比较*P<0.05;与FFA组比较#P<0.05。
Fig.4 Silybin regulating inflammatory factors through AMPK in HepG2 cells
Note:*P<0.05 vs control group,#P<0.05 vs FFA group.
4 讨论
随着全球城市化进程的加快和生活方式的改变,NAFLD的发病率日益增长,已成为危害人类健康的重要疾病之一[3]。目前,在NAFLD的发病机制中,“二次打击”学说被普遍接受。第一次打击是指胰岛素引起的脂肪变性,在此基础上炎症因子、游离脂肪酸和氧化应激等因素第二次打击肝细胞,产生毒性,导致肝脏病理性变化[12]。由于炎症因子在胰岛素抵抗中发挥了重要作用,因此,炎症反应贯穿于NAFLD的发生和发展过程中[13]。水飞蓟宾具有保肝、护肝的作用,可通过清除体内活性氧、抗脂质过氧化和抑制一氧化氮的产生来保护肝细胞受损[14]。研究结果显示,80和160 μmol·L-1的水飞蓟宾可抑制FFA诱导的炎症因子的产生。
在NAFLD和胰岛素抵抗时,循环系统FFA浓度升高,过量的自由脂肪酸发生异位存储,产生脂毒性[15]。FFA可引起线粒体功能障碍,引起氧化应激和活性氧增加,进而激活NF-κB信号通路[16-17]。结果表明,FFA能诱导肝细胞产生炎症因子IL-1β和TNF-α。AMPK在肝脏脂质稳态调节中发挥重要作用,活化的AMPK可通过调节与脂肪代谢相关的靶蛋白活性从而影响肝脏脂质代谢。研究发现,AMPK可通过调节NF-κB活性抑制肝脏炎症反应,减轻肝损伤,说明AMPK参与了NAFLD的病理过程,其可能是防治NAFLD的靶点。实验发现,水飞蓟宾逆转FFA诱导HepG2细胞AMPK磷酸化的降低,对AMPK的蛋白量没有影响。进一步研究发现,AMPK抑制剂compound C能阻止水飞蓟宾对炎症因子的抑制作用。这些研究均表明,水飞蓟宾是通过AMPK来发挥作用的。
综上所述,实验发现水飞蓟宾可通过AMPK抑制肝细胞炎症因子的产生,本研究对于阐述水飞蓟宾防治NAFLD的机制具有重要意义。
