猪流行性腹泻病毒CH-HeNXX-2017株全基因组序列测定与分析
2019-01-15焦文强徐引弟王治方张青娴王克领朱文豪李海利张立宪郎利敏
焦文强 ,许 峰 ,徐引弟 ,王治方 ,张青娴 ,王克领 ,朱文豪 ,李海利 ,张立宪 ,郎利敏
(1.河南省农业科学院畜牧兽医研究所,河南郑州450002;2.河南省畜禽繁育与营养调控重点实验室,河南郑州450002)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),核酸类型为单股正链RNA。猪流行性腹泻(Porcine epidemic diarrhea,PED)是由PEDV感染猪引起的一种高度接触性肠道传染性疾病,临床以呕吐、腹泻和脱水为主要特征。该病对各种年龄阶段的猪均易感,尤其是7日龄以内的哺乳仔猪,发病后死亡率可达100%。1971年英国首次报道PED的流行[1],随后迅速蔓延到欧洲其他国家,并在比利时流行期间被证实其病原为PEDV,给欧洲养猪业带来了重大损失[2-3]。在亚洲,日本、韩国、泰国以及越南都曾报道过PED的流行[4-6]。我国于1984年首次报道PEDV在我国猪场的存在,并且在2010年以前主要以零星出现为主[7],但是从2010年10月开始,我国南方较多省份暴发了PED,并迅速蔓延到全国多个省份和地区,测序证明,本次PED暴发是由变异的PEDV引起。
2017年10月至2018年2月,豫北某免疫过猪流行性腹泻疫苗的规模化猪场产房2日龄仔猪突然发生水样腹泻、呕吐,迅速脱水死亡,且传播迅速,发病率为80%,死亡率达到90%,剖检病例变化主要表现为肠壁变薄,肠黏膜脱落,胃内有大量固体状奶块。通过临床症状和病例变化分析,初步怀疑为猪流行性腹泻病毒、猪传染性胃肠炎病毒与细菌混合感染引起的消化道综合征。通过临床诊断和实验室诊断,最终确定为猪流行性腹泻病毒感染。
本研究对CH-HeNXX-2017毒株进行了全基因组序列测定,旨在分析该毒株与疫苗毒株在基因序列和抗原性等方面的差异,为以后PEDV疫苗毒株的筛选提供理论依据。
1 材料和方法
1.1 材料
1.1.1 病料来源 无菌采集濒死的仔猪的肠道组织,加入1 mL灭菌PBS,在研钵中充分研磨后倒入1.5 mL离心管中,8 000 r/min离心5 min,取上清置-80℃冰箱备用。
1.1.2 试剂 RNA提取试剂盒、MLV反转录酶、RNA酶抑制剂、Taq DNA聚合酶、pMD20-T载体、JM109感受态细胞、T4DNA连接酶、DL 2000 Marker、核酸染料、DNA胶回收试剂盒、小型质粒提取试剂盒,均购自于宝日医生物技术(北京)有限公司;琼脂糖购自于Invitrogen公司;DMEM培养基和胰酶购自于北京索莱宝生物科技有限公司,胎牛血清购自于Gibco公司。
1.2 方法
1.2.1 猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪轮状病毒的检测 取-80℃冻存的组织上清液,按照RNA提取说明书进行RNA抽提。抽提的RNA立即用于反转录反应,体系如下:5×MLV缓冲液 2 μL,dNTP 2 μL,MLV 反转录酶 0.5 μL,RNA酶抑制剂0.3 μL,特异性检测引物0.3 μL,加入RNA 4.9 μL,共 10 μL,充分混匀后置 42 ℃水浴1 h,然后70℃反应10 min后进行PCR反应。PCR反应体系为:cDNA1 μL,上、下游引物各 1 μL,10×Taq Buffer 5 μL,dNTP 8 μL,Taq DNA聚合酶 1 μL,灭菌双蒸水补足50 μL。引物参照文献[8],并进行少许优化。
PCR反应程序为:95℃预变性5 min;94℃变性 30 s,56 ℃退火 30 s,72 ℃延伸 45 s,35 个循环;72℃延伸10 min。PCR反应结束后,取5 μLPCR产物于1%琼脂糖凝胶中电泳检测,回收与预期大小相符的片段,连接pMD19-TSimple载体,4℃连接过夜,转化JM109感受态细胞,37℃培养15 h后挑取单克隆进行PCR检测,阳性克隆送生工生物工程(上海)股份有限公司测序。
1.2.2 猪流行性腹泻病毒的分离 将生长状态良好的Vero细胞弃去培养液,用无菌的PBS冲洗细胞2次,然后将病料上清加入到细胞中,加胰酶至终质量浓度5~6 μg/mL,37℃5%CO2培养箱培养2 h,每隔15 min晃动一下细胞,以确保病料上清与细胞充分结合[9-10]。2 h后弃去培养液,加入终质量浓度为5~6 μg/mL的胰酶,37℃连续培养96 h,并连续盲传5代,待观察到有细胞病变时收获病毒液。
1.2.3 PEDV CH-HeNXX-2017株基因组全长的扩增 参照文献[11]设计的引物进行全基因组序列的扩增。引物序列参照表1。具体的反转录以及PCR扩增体系和反应程序同1.2.1。

表1 PEDV CH-HeNXX-2017株全序列扩增引物

续表1
1.2.4 PEDV CH-HeNXX-2017株遗传进化分析将本研究得到的PEDV CH-HeNXX-2017株全长基因组序列与GenBank中下载的国内外参考毒株进行比对,应用MEGA5.0软件进行遗传进化分析,采用Neighbor-Joining算法生成系统进化树。
2 结果与分析
2.1 猪流行性腹泻病毒、猪传染性胃肠炎病毒(TGE)和猪轮状病毒(RV)的RT-PCR检测
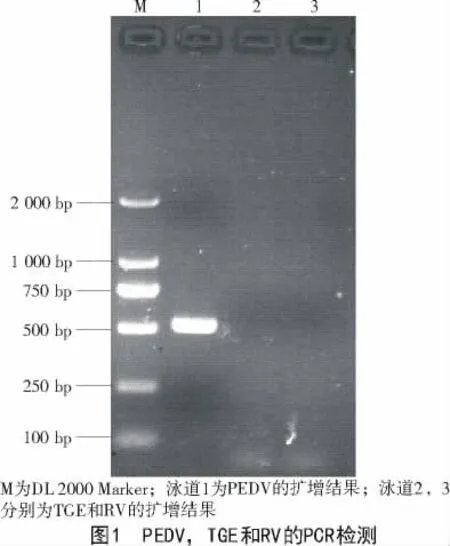
按照本研究设计的引物,可以扩增出约500 bp的片段,而猪传染性胃肠炎病毒和轮状病毒则没有目的条带出现(图1)。根据此结果判断,猪流行性腹泻病毒阳性,猪传染性胃肠炎病毒和猪轮状病毒阴性。
2.2 猪流行性腹泻病毒的分离
从图2可以看出,用病毒上清接种Vero细胞盲传5代以后,发现细胞出现变圆、肿胀等形态变化,最后发现多核体特征性病变(2-A),确定为病毒分离成功。

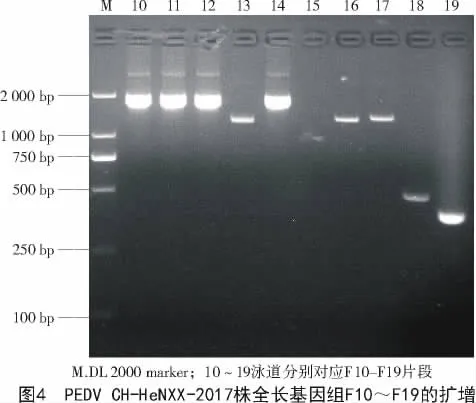
2.3 PEDV CH-HeNXX-2017株基因组全长的扩增
采用本研究中的引物,将PEDV CH-HeNXX-2017分为19段进行扩增,然后通过片段之间的重叠部分将整个基因组全长拼接起来(图3,4)。

2.4 PEDV CH-HeNXX-2017株遗传进化分析
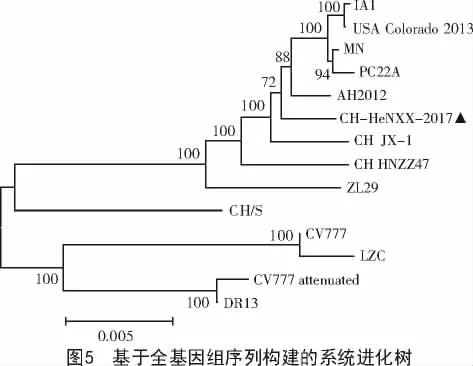
通过进化树分析,本研究得到的CH-HeNXX-2017株(图5中的三角标记)与传统毒株如CV777,LZC,DR13等亲缘关系较远,而与新近分离的毒株如IA1,USA Colorado 2013,MN和PC22A等在同一个进化分枝中,亲缘关系较为接近(图5)。
3 讨论
1984年,我国成功分离出第1株PEDV毒株,证明了PEDV在我国的存在。但是直到2010年以前,PEDV在我国主要呈现地方零星出现的特点,很少出现大范围的流行。2010年开始,我国大部分省份都经历了一次PEDV疫情,给养猪业健康发展带来了巨大的经济损失[12]。
本研究得到的CH-HeNXX-2017全基因组序列,分离自豫北某规模化猪场,该场一直对母猪进行PEDV免疫,且未见大范围仔猪腹泻的发生,但是这次突发产房仔猪腹泻,临床症状表现为水样腹泻,迅速脱水死亡。经过临床诊断和剖检病理变化,并结合实验室检测,最终确定为是由PEDV感染所致。说明PEDV病毒可能已经发生了变异,抗原性和免疫原性已经发生较大变化,接种现有的疫苗不能完全中和病毒的繁殖。为了进一步分析此次疫情毒株的遗传进化情况,通过全基因组序列构建的系统进化树分析发现发现,本研究得到的CH-HeNXX-2017 与 IA1,USA Colorado 2013,MN 和 PC22A 等毒株在同一个进化分析中,亲缘关系较为接近,而与传统毒株CV777和LZC等毒株亲缘关系较远,与赵丽等[13-14]的研究结果一致。其原因主要是因为RNA病毒在自身基因组复制过程中缺少5′-3′DNA聚合酶的校正功能,加之PEDV与野毒株之间不断进行重组、突变和缺失,造成了PEDV一直处于不断进化变异中。因此,对病毒进行长期的遗传进化分析,对于临床诊断和疫苗研发等具有重要意义。另外,PEDV对于肠道组织具有明显的嗜性,除了常规的细胞免疫和体液免疫以外,黏膜免疫也具有重要的抗病毒作用。目前,我国使用的PEDV疫苗多为全病毒灭活苗,且多为肌肉注射,这样并不能完全激活黏膜免疫在抗PEDV的作用[15]。因此,对于PEDV疫苗的研发需要考虑多种因素,在PEDV防控和疫苗研发方面还面临着巨大的挑战。
