茶园土壤中优势菌株棘孢曲霉的分离与鉴定
2019-01-15宋加艳周小露刘丽明赵幸运周才碧
宋加艳 ,周小露 ,刘丽明 ,赵幸运 ,石 悦 ,周才碧
(1.黔南民族师范学院生物科学与农学院,贵州都匀558000;2.湖南农业大学园艺园林学院,湖南长沙410000)
贵州省茶叶种植面积约46.7万hm2,是全国种植茶叶面积最大的省份,其中,黔南州的种植面积为10.7万hm2,也是贵州省比较重要的茶区之一。黔南州在《关于进一步加快推进茶产业发展的意见》中明确提出有机茶今后的发展目标,以及在有机茶园建设中,必须提高无害化有机肥的投入使用。有机肥是特定的微生物与经过腐熟等工艺流程的农作物秸秆复合而形成的微生物有机肥料,其具有无毒性、肥效高、成本低、节约能源等优点。
茶树生长必需的养分大部分是土壤供给的,但土壤中的营养物质只能通过施肥来补充。长期大量施用化肥,容易导致土壤板结、酸化、地下水硝酸盐含量超标以及土壤基础肥力下降等问题。施用化肥也是茶叶有害物质超标的主要原因之一,特别是含铅、汞等化肥引起的重金属超标。
相关研究表明,贵州茶区存在不同程度的土壤酸化、重金属超标、农药残留等问题。如都匀茶区pH值3.50~4.00,土壤严重酸化[1-2];湄潭和凤冈茶区pH值在4.00~4.50,土壤酸化;正安茶区pH值在4.00~5.00,土壤有酸化趋势;云雾区存在严重的Cd和Hg污染[3];贵定县有2个茶园土壤处于轻污染状态,8个乡镇处于警戒限范围[3-5];贵州省约9个市茶区铅[6]、氯氰菊酯等重金属均有不同程度的检出,但没有超标。
施用化肥是一种给茶树补充营养物质的有效途径,能为茶树的生长发育提供充足的营养成分,又可在一定程度上改良土壤。土壤是植物吸收养分的主要来源之一,通过给茶树施肥能改良茶树因缺少大量元素带来的叶片发黄等问题。茶树专用有机肥,速效与缓效养分协调、肥料利用率比较高,可以减轻氮肥造成的硝酸盐积累以及磷钾肥造成的污染,其既可作基肥又可作追肥,将成为农业生产的必然选择。因此,都匀毛尖茶区专用有机肥菌种资源的开发与应用具有极其重要的意义。
本试验以黔南州茶园优质土壤为材料,分离、纯化得到优势菌株,并对其进行形态鉴定和分子鉴定,旨在明确优势菌株的种属关系,为其在茶园专用有机肥的开发提供参考。
1 材料和方法
1.1 试验材料
1.1.1 材料 供试土样采集于贵州省黔南州都匀市三江堰茶园。
1.1.2 试剂与仪器 蔗糖(化学纯,贵阳中川化工有限公司),磷酸二氢钾(分析纯,寿光市艾益农生物科技有限公司),七水合硫酸镁(分析纯,天津市风船化学试剂科技有限公司),氯化钾(分析纯,天津市福晨化学试剂厂),琼脂粉(北京鼎国昌盛生物技术责任有限公司),七水合硫酸亚铁(分析纯,天津市致远化学试剂有限公司),硝酸钠(分析纯,贵阳中川化工有限公司)等。
电子显微镜(XSP-8C,德卡精密量仪有限公司),电子天平(LTI000B,常熟市天量仪器有限责任公司),恒温培养箱(BIC-250,上海博迅实业有限公司),超净工作台(SW-CJ1FDA,苏净集团苏州安泰空气技术有限公司),高压蒸汽灭菌锅(GI54DS,致微仪器有限公司),冰箱(BCD-251WBSV,上海帝览实业有限公司)等。
1.2 试验方法
1.2.1 培养基配制 参考周才碧等[7]的方法,按试验要求进行适当修改。PDA培养基:葡萄糖20 g,马铃薯200 g,蒸馏水1 000 mL,琼脂粉20 g。WA培养基:琼脂粉13 g,蒸馏水1 000 mL。
1.2.2 菌株分离培养 称取20 g茶园土样放入三角瓶,加入80 mL无菌水,摇匀制备成菌种悬液,并将其稀释成不同浓度菌种溶液备用。再用接种环蘸取不同稀释浓度的菌种悬浮液1~2滴,采用涂布法接种于PDA培养基上,每个稀释浓度6个重复;将PDA培养基放入28℃恒温培养箱中,培养6~7 d,有菌落形成时,即对菌株进行纯化处理。
1.2.3 菌株纯化培养 待培养基上的菌落培养6 d可以明显观察到菌落时,挑选生长旺盛的菌落,用平板划线法接种到PDA培养基上;并将培养基放入培养箱继续培养,待菌落长出较多时,继续划线纯化,直到纯化出单一菌落。
1.2.4 菌株形态特征观察 利用电子显微镜对菌种菌落的孢子囊、分生孢子、厚垣孢子及生长速率等形态特征进行观察记录,以对该菌种菌落的类型进行初步判断。
1.2.5 菌株生长速率测定 在无菌环境下,把优势菌株打成直径为5 mm的菌饼,再转移至25℃培养箱中,培养7 d,量取菌落直径并再次记录其特征。
1.2.6 菌株分子生物学鉴定
1.2.6.1 DNA的提取 挑取约1 mg优势种菌丝,研磨,依次加入500μL裂解液、150μLKAC和50μL异丙醇,反复离心15 min;收取上清液,加等体积70%的乙醇,离心10 min;等待水分散失,加0.1×TE 30 μL,收集上清液得优势种菌丝DNA。用1.0%琼脂糖凝胶电泳检测DNA的完整性,紫外分光光度法检测DNA的浓度,再稀释至30~50 ng/μL,备用。
1.2.6.2 PCR扩增 用于引物筛选的PCR扩增反应的总体积为 25 μL:1 μL DNA 模板,10×Buffer的缓冲液体 2.5 μL,dNTPs 2 μL,正反向引物各1 μL,ExTaq DNA聚合酶 0.1 μL和 ddH2O 17.4 μL。PCR扩增反应程序:94℃预变性5 min;94℃变性30 s,50~60 ℃退火 30 s,72 ℃延伸 1 min,循环32次;最后72℃延伸5 min;12℃保存备用。以通用引物 ITS4(5′-TCCTCCGCTTATTGATATGC-3′,苏州金唯智生物技术有限公司合成)为引阴性对照,进行PCR扩增,4℃冰箱保存PCR扩增产物。扩增产物经1.2%琼脂糖凝胶电泳分离检测,将PCR扩增产物送到测序公司测序。
1.3 数据统计
所得序列提交到National Center for Biotechnology Information(NCBI)核酸数据库,通过 BLAST 程序,将28SrDNA序列与GeneBank中的核酸序列进行对照,并从数据库中获得相关序列。采用MEGA 6.0软件进行多序列比对,并利用Neighbor-Joining方法构建进化树,确定菌株类别。
2 结果与分析
2.1 目标菌株的分离、纯化
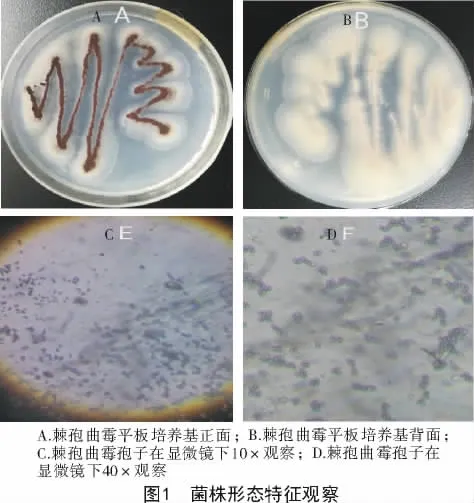
以优质土壤为材料,利用稀释涂布分离得到5种菌;进一步利用平板划线纯化该菌株,最终得到优势菌株S1(图1-A),该菌株在25℃的PDA培养基中生长旺盛,生长周期较长。
2.2 目标菌株的鉴定
2.2.1 形态鉴定 利用传统形态学鉴定的方法,对分离、纯化得到的菌株进行观察。
通过肉眼观察,菌丝体为白色,在培养基表面葡匐向上生长,是气生菌丝中的繁殖菌丝。利用电子显微镜观察,优势菌种形态特征鲜明,容易识别,其菌落较大,菌丝体向上生长出孢子体,孢子体为圆形,褐色。根据菌株的菌落和孢子形态等特征,初步推断该菌属为棘孢曲霉(图1)。
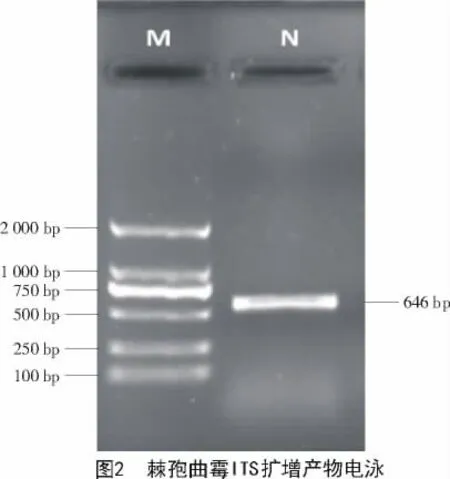
2.2.2 分子鉴定 以棘孢曲霉菌株DNA为模板,用通用引物ITS1/ITS4扩增得到1条646 bp的清晰条带(图 2)。
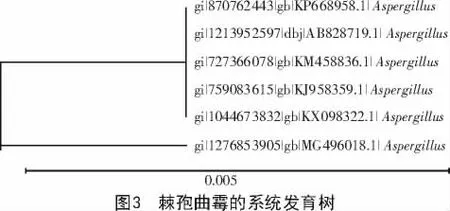
将PCR产物测序后提交到GenBank中,经BLAST比对后发现,病原真菌的rDNA-ITS序列与Phytophthora nicotianae(MG496018.1)的序列相似度高达99%。依据比对结果构建系统进化树(图3),表明该菌应归为Aspergillus aculeayus。结合形态学与分子生物学鉴定,确定其为曲霉属中的棘孢曲霉。
棘孢曲霉(Aspergillus aculeayus)的具体分类地位如下:

3 结论与讨论
土壤是微生物的大本营,天然栖息地[8]。土壤微生物是陆地生态系统植物多样性和生产力的重要驱动者,直接参与了植物获得养分和土壤养分循环2个过程[9]。本试验以黔南州茶园优质土壤为材料,进行稀释,并将样品悬液涂布于培养皿培养得出多种菌种,又对菌种进行分离,再挑取菌种纯化得到优势菌株。为了明确优势菌株的种属关系,首先对于优势菌株的鉴定主要采用传统的生物形态学鉴定法,利用电子显微镜进行观察[10],初步确定该优势菌株为曲霉属;其次,对于优势菌株采用ITS序列(分子)鉴定法,确定其为棘孢曲霉。
棘孢曲霉JMUdb058固态发酵产酶的能力突出,是一种高产柚苷酶[11]、β-葡萄糖苷酶[12]的微生物新资源。从土壤真菌棘孢曲霉(Aspergillus aculeatus)中分离得到2个新化合物和2个已知化合物,活性测试结果表明,4个化合物均表现出一定的抗氧化活性[13]。
