姬玉露组织培养体系的建立
2019-01-15段鹏慧
段鹏慧,焦 茹,马 娟
(山西林业职业技术学院,山西太原030009)
姬玉露(Haworthia cooperi var.truncata)为百合科十二卷属多肉植物[1-2],原产南非[3],叶片肉质,翠绿色或淡紫色,圆润饱满,呈莲座状紧凑排列,顶端透明或半透明,形成美丽的“窗”[4],顶部有细丝,中下部有深色的线状脉纹,光线较强时,脉纹为棕红色。近年来,多肉植物风靡全国,成为植物新宠,对多肉植物的需求短时间内激增,尤其是玉露类,其株型奇特美丽,清新典雅,常用作居家、办公场所的小型盆栽装饰物,是多肉植物中的极品,市场价格昂贵。
姬玉露一般采用种子繁殖和分株繁殖,但繁殖系数较低,生长周期长,速度较慢[5-6],而采用植物组织培养方法可以较好地解决这些问题。康平寿[7]、毛玉露[8]、克里克特寿[9]、西山寿[10]、Haworthia mirabilis[11]、美吉寿[12]和白银寿[13]等同属多肉植物的组织培养已有报道[14-16],但姬玉露作为新品,相关报道较少。
本试验通过进行外植体不同消毒时间、不同培养阶段不同激素组合、有机添加物壮苗等研究,探索建立姬玉露组培与快繁体系,以满足目前消费者对姬玉露的大量需求。
1 材料和方法
1.1 试验材料
供试材料来自太原市植物园温室。选择株型好、无病虫害、生长健壮的姬玉露植株为母本,以姬玉露叶片作为外植体进行试验。
1.2 试验方法
1.2.1 外植体消毒 将姬玉露叶片从基部小心切下,用饱和洗衣粉水清洗干净,在自来水下流水冲洗30 min。在超净工作台中,用75%酒精浸泡30 s,再用0.1%HgCl2进行常规消毒处理,消毒时间分别为 5,7,9,11 min,然后用无菌水冲洗 5 次,每次冲洗2 min。将叶片上的新伤口切去,立刻接种于MS+25 g/L蔗糖+7 g/L琼脂培养基上,每个处理接种20瓶,每瓶1个外植体。接种后10~20 d统计外植体的污染率、成活率,分析不同消毒时间的消毒效果。

1.2.2 诱导愈伤组织 选取未污染的姬玉露无菌材料,接种至MS基本培养基添加激素的初代诱导培养基中,研究细胞分裂素(6-BA,KT)和生长素NAA对姬玉露诱导愈伤组织的影响。激素组合设置6个处理,每个处理接种20瓶,每瓶2个无菌外植体,15 d后观察叶片启动情况,统计愈伤组织诱导率。

1.2.3 丛生芽增殖培养 增殖培养基以MS+NAA 0.1 mg/L为基础,分别添加1.0,0.8,0.5 mg/L细胞分裂素6-BA和KT,探究不同激素不同浓度对姬玉露丛生芽增殖的影响。将初代培养中长出来的小苗进行分割,切成单株小苗后接种于增殖培养基上。每个处理接种10瓶,每瓶3个。30 d后,观察丛生芽增殖情况并统计增殖倍数。

1.2.4 壮苗培养 将分化出的姬玉露丛生苗切分为单株小苗,接种于添加不同质量浓度(0,10,20,30 g/L)马铃薯泥的壮苗培养基MS+0.8 mg/L 6-BA+0.1 mg/LNAA上。每处理10瓶,每瓶3株。30 d后,观察记录姬玉露生长情况,研究马铃薯泥对姬玉露生长情况的影响。
1.2.5 生根诱导 将壮苗培养30~35d长出的1cm以上的健壮苗进行生根诱导,以1/2 MS+2 g/L活性炭为基础培养基,生长素IBA设置4个质量浓度,分别为 0,0.03,0.05,0.10 mg/L。每处理 10 瓶,每瓶3株。30 d后观察生根情况,统计生根率。

1.2.6 驯化移栽 选择生长健壮、根系良好的姬玉露小苗,移入温室,打开瓶盖炼苗,3~5 d后,小心取出瓶苗,用清水洗净根部粘附的培养基,于通风处晾干,1~2 d后移栽到已经消毒的基质中,研究珍珠岩+粗河沙+泥炭(体积比为1∶2∶2)、粗河沙+泥炭(体积比为2∶1)、粗河沙3种基质对姬玉露组培苗移栽成活率的影响。移栽后,放在通风、有散射光的环境,保持温度15~28℃,空气湿度70%~90%,严格控制土壤湿度(见干见湿,宁干勿湿)。20 d后每种基质随机选取20株幼苗,统计生根率、根长及发育情况。
1.3 培养条件
培养基附加琼脂7 g/L,蔗糖30 g/L,pH值5.8。培养温度(20±2)℃,湿度50%~60%,光照强度2 000 lx,光照时间12 h/d。生根培养、驯化移栽阶段光照强度3 000 lx。
2 结果与分析
2.1 0.1%HgCl2不同消毒时间对姬玉露外植体消毒效果的比较
姬玉露叶片含水多,消毒难度大。本研究每处理接种20个外植体,由表1可知,0.1%HgCl2对姬玉露叶片进行消毒处理,随着消毒时间的加长,污染率逐渐降低。其中,11 min消毒处理的污染率最小,为20%,9 min消毒处理次之,污染率为25%,这2种处理的污染主要发生在接种后的前10 d;5 min消毒处理的材料污染率高达70%,接种20 d内持续有污染现象。处理时间加长降低了污染程度,成活率在逐渐提高。4种处理中,9 min消毒处理的姬玉露外植体成活率最高,是70%;11 min消毒处理中有2株材料未染菌,但叶片呈黄色枯萎状,是由于过度消毒导致材料死亡。因此,综合考虑污染率、成活率指标,9 min消毒处理适宜用于姬玉露叶片外植体的消毒。

表1 0.1%HgCl2不同消毒时间对姬玉露外植体的消毒效果
2.2 不同激素组合及浓度对姬玉露叶片启动的影响
初代培养15 d后,叶片基部开始膨大,出现不规则黄绿色疏松的突起,无组织结构,生长速度迅速,30 d左右形成大块愈伤组织。由表2可知,在相同质量浓度6-BA,NAA培养基中添加1 mg/L KT后,叶片愈伤组织诱导率为不含KT培养基的2.9~6.4倍,启动效果明显提高,说明6-BA,KT与NAA配合使用更有助于诱导产生姬玉露愈伤组织。KT和NAA的添加量分别为1,0.2mg/L时,添加1mg/L 6-BA诱导愈伤组织的数量是添加2 mg/L 6-BA诱导组织数量的4.57倍;而当6-BA,KT用量相同时,0.1mg/L的NAA诱导效果又好于0.2 mg/L的NAA,说明高浓度6-BA,NAA对姬玉露叶片出愈具有一定抑制作用。当6-BA,KT和NAA用量分别为1,1,0.1 mg/L时,姬玉露叶片产生的愈伤组织最多,诱导率达87.5%,效果最佳。
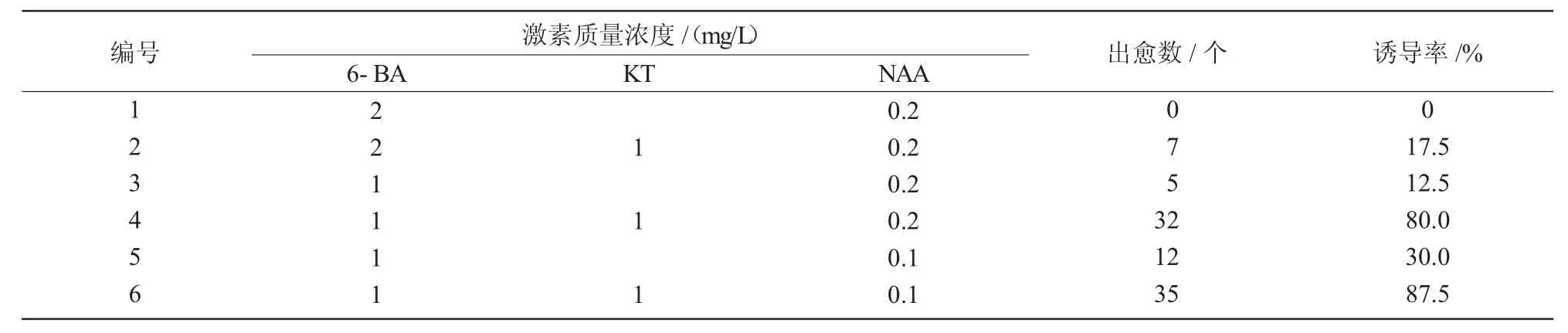
表2 不同激素组合及浓度对姬玉露叶片启动的影响
2.3 不同激素不同浓度对姬玉露丛生芽增殖的影响
愈伤组织在原培养基中保持培养约20 d,可见愈伤组织表面出现绿色芽点。30 d后芽点处长出第1片新叶,继续培养,每7 d左右都会生长出一片新叶,形成丛生芽。将丛生芽分成单株小苗进行增殖培养,30 d后生成丛状苗。由表3可知,6-BA在姬玉露增殖培养中的作用较KT明显,平均增殖倍数都在5.7以上,且丛生苗健壮,叶片大,生长舒展,叶色正常。而KT处理的平均增殖倍数最高仅为4.6,且苗细弱,色浅。当6-BA质量浓度为1.0,0.8 mg/L时,姬玉露丛生芽增殖较多,生长健壮,但是1.0 mg/L 6-BA处理会产生轻微玻璃化现象,直接影响芽苗质量;当6-BA质量浓度为0.5 mg/L时,丛生芽增殖量略显逊色,叶片较0.8 mg/L处理的叶片小。所以,MS+0.8 mg/L 6-BA+0.1 mg/L NAA是姬玉露丛生芽增殖的最适培养基。
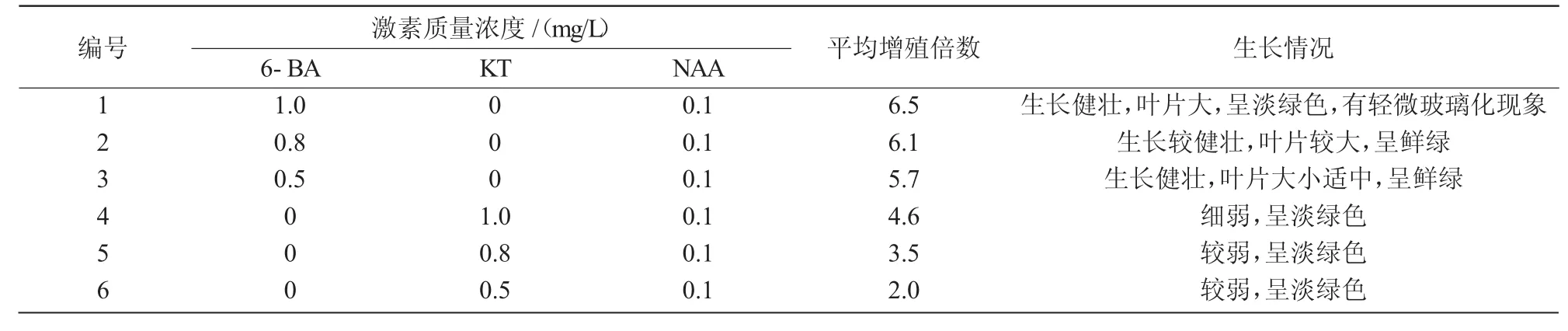
表3 不同激素浓度对姬玉露丛生芽增殖的影响
2.4 马铃薯泥对姬玉露壮苗生长的影响

表4 马铃薯泥对姬玉露壮苗生长的比较
添加马铃薯泥进行姬玉露壮苗培养30 d后,马铃薯泥对姬玉露组培苗的生长状态有较大影响。由表4可知,添加马铃薯泥的组培苗普遍比未添加马铃薯泥的健壮,随着使用量加大,植株的直径、高度均有所增加,效果明显。添加20,30 g/L马铃薯泥时幼苗生长状态基本相同,为节约成本,选择添加20 g/L马铃薯泥为最适壮苗有机附加物。
2.5 IBA对姬玉露诱导生根的影响
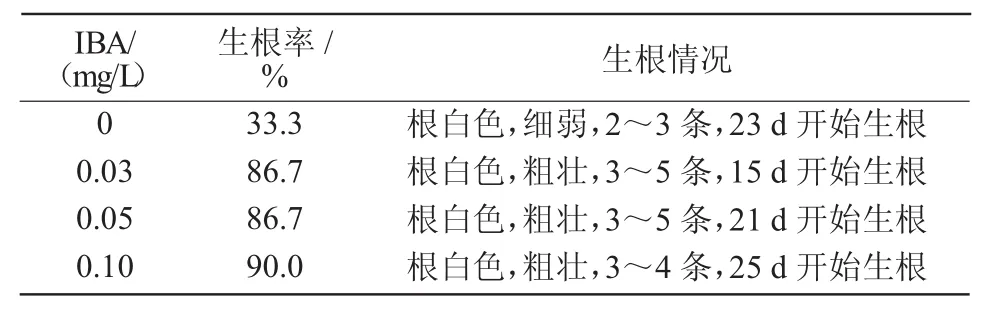
表5 IBA对姬玉露诱导生根的影响
将1 cm以上的健壮姬玉露组培苗接种至含不同浓度IBA的培养基中,15 d后陆续开始萌出根尖,30 d生根情况表明(表5),不含IBA的生根培养基,姬玉露生根率较低,仅为33.3%,且发根需要23 d,时间较长。含有IBA的培养基对组培苗生根均有较好的促进作用,根粗壮,质量高,生根率均有所提升,分别达到86.7%,86.7%和90%。但随着IBA浓度增加,发根时间逐渐延长。与0.03 mg/LIBA处理组培苗生根情况相比,0.05 mg/L IBA处理的生根率相同(86.7%),但生根时间延长了6 d;虽然0.1 mg/L IBA处理的生根率最高(90%),但生根时间(25 d)最长,比0.03 mg/L IBA处理的生根时间整整多10 d。综合考虑,1/2 MS+0.03 mg/L IBA+2 g/L活性炭为最适宜姬玉露组培苗生根培养基。
2.6 不同移栽基质对姬玉露幼苗生根的影响
移栽后10 d左右姬玉露幼苗便开始长新根,20 d后多数幼苗都会发出新根,根长1~3 cm。由表6可知,粗河沙+泥炭、粗河沙2种基质中,幼苗生根率均为95%,比珍珠岩+粗河沙+泥炭基质的生根率(75%)高。粗河沙+泥炭基质中的幼苗健壮,新根数量多(多为3条根),根较长(平均2.69 cm);而粗河沙中新根数量少,细弱,长势不良。因此,粗河沙∶泥炭体积比为2∶1的基质是姬玉露组培苗移栽的最适基质。

表6 IBA对姬玉露诱导生根的影响
3 结论与讨论
生长调节物质是培养基中不可缺少的关键物质,其用量虽极少,但对外植体愈伤组织的诱导和器官分化却起着重要的调节作用[17-18]。在一定范围内,植物激素浓度升高,对植物的促进作用增强,当超过这一范围后,浓度再升高,就会对植物产生抑制作用[19]。本试验结果表明,同等条件下,2 mg/L 6-BA,0.2 mg/L NAA的叶片诱导率均比低浓度1.0 mg/L6-BA,0.1 mg/LNAA的诱导作用差。同时,多种激素协同作用效果要远大于一种激素单独使用效果[20],KT,6-BA与NAA混和使用,有效地提高了姬玉露叶片出愈率,是同种浓度6-BA单独与NAA作用叶片出芽率的2.9~6.4倍。姬玉露叶片启动培养基以MS+1mg/L6-BA+1mg/LKT+0.1mg/L NAA+7 g/L琼脂+30 g/L蔗糖为宜。
姬玉露丛生芽增殖过程中,6-BA的增殖效果优于激动素KT。6-BA在0.5~1.0mg/L范围内,随着浓度增加,丛生芽增殖倍数也增加,但是由于细胞分裂速度加快,出现了玻璃化现象,应适当控制丛生芽增殖数量,因此,选择MS+0.8 mg/L 6-BA+0.1 mg/LNAA作姬玉露丛生芽增殖培养基,增殖倍数可达6.1。生根培养选用培养基1/2 MS+0.03 mg/L IBA+2 g/L活性炭,15 d开始生根,生根率为86.7%。
马铃薯块茎中含有多种氨基酸,如赖氨酸、蛋氨酸以及多种维生素等,能为植物提供营养元素,对试管苗在株高、叶数、根数、鲜质量等方面有明显促进作用,适合试管苗的生长发育[21]。本试验研究发现,20 g/L马铃薯泥可以有效促进姬玉露生长,植株健壮,株高、直径均有明显提高。
姬玉露移栽管理同样重要。姬玉露移栽选用透气良好、排水良好、不易结块的基质,试验中以粗河沙∶泥炭体积比为2∶1的基质作为最优选择。目前,生产中,还选用专用多肉植物栽培土,如(麦饭石+火山岩+轻石+虹彩石)∶泥炭体积比为3∶1,效果也较好。商品销售时,还会用大颗粒赤玉土作铺面装饰。多肉植物栽培管理要严格控制环境条件,必须通风良好、有散射光,温度在15~28℃,不宜长时间高温暴晒。严格控制水分,可以预防徒长,保持株型美观。新上盆或长势较弱的植株不需要施肥,待植株长势比较旺盛后每月可施一次液肥或缓释肥,以确保植株健康生长。
