猫免疫缺陷病毒宿主限制因子的研究进展
2019-01-14许运斌高兴红
许运斌,高兴红,罗 果,王 欢
(遵义医学院 贵州省普通高等学校传染病与生物安全特色重点实验室,遵义 563000)
众所周知,慢病毒以狭窄的细胞嗜性和感染宿主谱著称,这是由促进或抑制病毒复制的宿主蛋白所决定。其中促进病毒复制的宿主蛋白称之为辅助因子或病毒感染依赖因子,而抑制病毒复制的宿主蛋白称之为限制因子。目前,在人类免疫缺陷病毒(Human immunodeficiency virus,HIV)研究领域中,已获得关于慢病毒宿主限制因子的大部分认识。然而,这些宿主限制因子对其他慢病毒的影响知之不多。猫免疫缺陷病毒(Feline immunodeficiency virus,FIV)与HIV同属于逆转录病毒科慢病毒属,其感染的家猫(简称为FIV/家猫)是HIV研究的重要动物模型,对FIV复制机理进行深入研究,并不断改进该模型,对于该模型在HIV研究领域的应用具有重要推动作用。而加强FIV与其宿主限制因子相互关系的研究,对应用于HIV研究的FIV/家猫模型的改进意义重大。本文主要对FIV/家猫模型对HIV研究的贡献和不足、FIV与宿主限制因子的相互关系的研究进展进行综述。
1 FIV/家猫是HIV研究的重要动物模型
FIV隶属于逆转录病毒科慢病毒属,可特异引起猫免疫系统瘫痪,并由此引发一系列机会性感染、肿瘤和神经功能紊乱等多种症状的猫获得性免疫缺陷综合征(feline ac quired immune deficiency syndrome,FAIDS)。该病毒最早于1986年分离自美国加利福尼亚州的家猫,之后不同分支的FIV在世界各地陆续有报道,最近在我国内陆首次报道家猫中A亚群FIV的存在,该病毒已被公认为世界范围内猫科动物的重要病原体[1-3]。FIV由于与同为慢病毒属的HIV具有相似的基因组和致病特性, FIV/家猫是研究HIV的重要动物模型,它在了解HIV致病机理、疫苗免疫效果、新药药效和毒性评估以及制定新的疾病治疗策略和干预策略等方面发挥着重要作用[4-7]。该模型可用于抗HIV药物的开发和测试,许多抗HIV的药物对FIV表现出相似的抗病毒效果[4,8]。将HIV宿主限制因子猕猴来源的TRIMCyp基因导入家猫可使之具备抗FIV复制的能力,用于评估HIV基因治疗效果以及该宿主限制因子抗病毒的潜力[9]。此外,该模型还可用于测试组蛋白脱乙酰酶抑制剂辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)激活潜伏病毒的效果,研究发现SAHA的治疗可增强感染家猫中细胞内FIV的转录水平,从而降低其病毒基因组DNA水平,即SAHA可激活潜伏的病毒,如此可为制定和测试消除HIV潜伏病毒的治疗和干预策略提供机会[10]。目前,FIV/家猫模型在HIV研究中的应用虽取得一定进展,但并不顺利,其中一个重要原因就是对FIV的复制机理和致病机制知之甚少。因此,为促使FIV/家猫模型更科学合理地应用于HIV的研究,有必要对FIV 的感染机理进行更为深入和全面的探究。而研究宿主限制因子在FIV感染宿主细胞过程中所扮演的角色,并不断比较FIV与HIV相关的研究结果,有助于验证和改善FIV/家猫模型,为未来在HIV宿主限制因子抗病毒潜力评估及其药物开发方面FIV/家猫作为HIV的研究模型提供可供参考的基础依据。
2 FIV与宿主限制因子的相互关系
病毒作为一种专门在细胞内寄生的微生物,包括HIV和FIV等免疫缺陷病毒在内的众多病毒已进化成能够利用许多宿主蛋白满足自己高效的复制和传播。另一方面,在免疫缺陷病毒感染细胞的过程中,宿主细胞自身可表达一系列宿主限制因子通过不同途径抑制病毒的复制。这些宿主限制因子,它们是宿主细胞内在先天免疫系统的重要组成部分,提供了一条除获得性免疫系统和经典先天免疫系统之外的抵抗病毒感染的防御系统。寻找新的宿主限制因子并解析宿主限制因子抑制病毒复制的具体机制、发现病毒蛋白拮抗宿主限制因子抗病毒活性并解析这种拮抗作用的具体机制已成为免疫缺陷病毒研究领域的热点。目前,报道最为广泛且在FIV研究领域中研究较为深入的宿主限制因子:TRIM5a(tripartite motif-containing protein 5a)蛋白,APOBEC3(apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like 3)家族蛋白和BST-2(bone marrow stromal antigen 2,又名 Tetherin)蛋白。
2.1 TRIM5a三维基体蛋白(tripartite motifcontaining proteins,TRIMs)是参与多种细胞活动的大型蛋白质家族,在细胞周期调控、胚胎发育、细胞信号通路的调控或直接激活以及对病毒感染的细胞固有免疫反应中起着重要作用[11-14]。TRIM5a是TRIMs蛋白家族的一个亚型蛋白,其中人源TRIM5a由四个功能区域组成:RING、B-box 2、coiled-coil以及B30.2,而猫源TRIM5a由于基因开放阅读框读码提前终止则缺少B30.2结构域(图1)。人源TRIM5a通过其C端的B30.2结构域与HIV的病毒衣壳蛋白CA相结合,接着通过B-Box 2结构域介导TRIM5a蛋白在CA蛋白表面组装成有着构象可塑性的六角形网状样结构,并借助具有E3 泛素连接酶活性的N端RBCC结构域(RING、B-box 2、coiled-coil)经蛋白酶体途径降解CA蛋白,从而阻止HIV的逆转录[15-23];此外,TRIM5a抗HIV的能力还与其激活TAK1依赖的先天免疫信号通路的能力密切相关[24]。猫源TRIM5a蛋白C端由于缺少B30.2 结构域则失去抑制FIV的功能[25]。当在其C端融合表达可与HIV CA蛋白相结合的亲环蛋白A(Cyclophilin A,CypA)时,这种融合表达的蛋白TRIMCyp可同时具备抑制HIV和FIV感染的能力[26],其具体的抗病毒机制是否与人源TRIM5a相同或类似尚未可知,有待深究。而且截至目前为止,未发现HIV和FIV的病毒蛋白能够拮抗宿主限制因子TRIM5a和TRIMCyp的抗病毒活性,这暗示着TRIM5a和TRIMCyp蛋白作为抗逆转录病毒的药物靶标具有很大潜力。

图1 TRIM5a蛋白的结构域Fig.1 Domain structure of TRIM5a
2.2 APOBEC3APOBEC3家族蛋白普遍表达于哺乳动物细胞中,是一类胞嘧啶脱氨酶,具有广谱抗病毒活性,可基于模仿HIV核壳蛋白NC的RNA结合特异性包装至新生病毒粒子中,然后通过胞嘧啶的脱氨基作用在新合成的病毒DNA中诱导G到A的超突变,从而促进病毒基因组中非致死性超突变的积累,如此导致慢病毒群体的遗传变异[27-29]。该家族蛋白具有两个对称的结构域,即N端和C端区域,每个区域都含有典型的、具备胞嘧啶脱氨酶催化活性的锌(Z)-协调催化基序(His-X-Glu-X23-28-Pro-Cys-X2-4-Cys),如此可根据Z1、Z2或Z3基序的组合情况对APOBEC3蛋白进行分型。根据Z1、Z2和Z3基序的组合情况,人源的APOBEC3家族蛋白包括A3A、A3B、A3C、A3DE、A3F、A3G和A3H七个成员蛋白(图2),研究发现A3DE、A3F、A3G和A3H对Vif缺失型HIV有显著的抗病毒功能[30,31],其中A3G和A3F蛋白共表达形成的异源寡聚体对病毒基因组则具有更强的超突变效率,从而对病毒感染具有更好的限制作用[32,33]。HIV则通过编码辅助蛋白Vif来拮抗A3G和A3F的抑制作用[31,34,35]。Vif募集E3泛素连接酶复合物ElonginB/C-Cullin5-Rbx2-CEBβ通过蛋白酶体途径降解A3G蛋白,阻止其对病毒基因组的脱氨基作用,并避免其包装至病毒粒子中[36-38]。同时,CEBβ则可保护Vif免遭小鼠MDM2蛋白介导的降解作用,从而增强Vif拮抗A3G蛋白抗病毒活性的能力[39]。根据Z2和Z3基序的组合情况,猫源APOBEC3蛋白则共有五种类型:APOBEC3Z2a,APOBEC3Z2b,APOBEC3Z2c,APOBEC3Z3和APOBEC3Z2-Z3(图2)。其中APOBEC3Z3和APOBEC3Z2-Z3蛋白对Vif缺失型FIV具有抗病毒活性[40,41]。FIV辅助蛋白Vif通过募集ElonginB/C-Cullin5 E3泛素连接酶复合物降解APOBEC3蛋白,但在此过程CEBβ并非必需[42,43]。另外有趣的是,FIV病毒蛋白酶PR还可在释放的病毒粒子中切割APOBEC3蛋白,进而拮抗其抗病毒活性[44]。这是FIV与HIV Vif蛋白在降解APOBEC3蛋白方面的不同之处。

图2 人源(2A)和猫源(2B)APOBEC3蛋白的结构域Fig.2 Domain structure of human(2A) and feline(2B)APOBEC3
2.3 BST-2BST-2蛋白,又名CD317、Tetherin或HM1.24,是一种干扰素诱导的II型跨膜蛋白。人源和猫源BST-2蛋白均主要由胞质区(Cytoplasmatic,Cyto)、跨膜区(transmembrane,TM)、coiledcoil区和糖磷脂酰肌醇(GPI)-锚定区等4个功能区域组成(图3)。人源BST-2可将包装好的病毒粒子滞留在细胞膜表面,从而抑制Vpu缺失型HIV病毒粒子的释放[44],抑或在HIV感染的细胞中激活NF-kB产生干扰素抑制病毒的感染[45]。HIV通过其辅助蛋白Vpu拮抗BST-2蛋白的抗病毒活性[44,45]。Vpu为跨膜蛋白,通过其跨膜区与BST-2蛋白相互作用介导其通过溶酶体途径或蛋白酶体途径降解[46,47],或将其限制在反面高尔基体,从而阻断BST-2蛋白对病毒粒子释放的抑制作用[48]。而猫源BST-2蛋白可有效抑制FIV的释放但不能抑制FIV的传播[49]。近期研究发现该蛋白缺乏激活NF-kB的能力,所以它不能通过激活NF-kB途径抑制病毒感染,而且它的抗病毒活性与其N端的糖基化修饰无关[50]。FIV编码的结构蛋白Env虽未能降低细胞膜表面的BST-2蛋白量,但它通过一种不同的机制拮抗BST-2蛋白对病毒释放的抑制作用[51],其具体机制尚待解析。
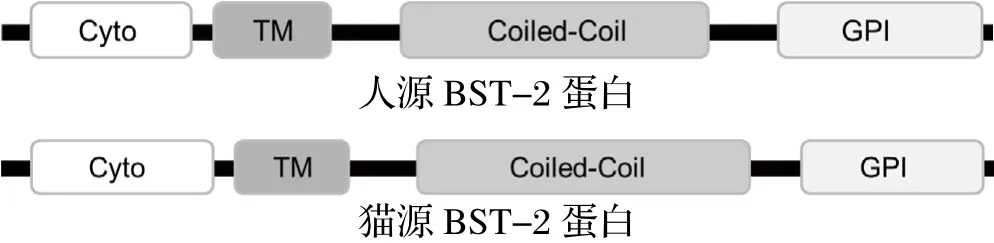
图3 BST-2蛋白的结构域Fig.3 Domain structure of BST-2
3 展望
纵观上述这些宿主限制因子相关的研究成果,不难发现不同物种宿主细胞在FIV和HIV感染过程中产生的宿主限制因子种类、FIV和HIV用于拮抗宿主限制因子所编码的病毒蛋白种类以及这些病毒蛋白拮抗宿主限制因子的具体分子机制有相同之处也有不同之处。目前对HIV宿主限制因子的研究进行的最为广泛和深入,而对其他免疫缺陷病毒宿主限制因子的研究则较为有限和滞后。因此,在FIV研究领域及时推进宿主限制因子相关方面的研究具有重要意义。首先,FIV/家猫是研究HIV的重要动物模型,对FIV与其宿主限制因子之间相互关系的研究将为FIV/家猫作为HIV动物模型提供理论支持;同时,对FIV宿主限制因子的研究,对HIV宿主限制因子研究具有启示作用,通过解析不同物种同源宿主限制因子功能的差别,可解释病毒狭窄的感染宿主谱或跨种间传播可能的原由;此外,研究不同物种宿主限制因子的抗病毒能力可推动高效抗HIV药物发现的进程。
现有的研究发现暗示绝大多数HIV的宿主限制因子具有广泛的抗病毒谱,不仅能够阻止慢病毒的感染,而且还能够阻止其他亲缘关系较远的非慢病毒属囊膜病毒的感染。另一方面,这些病毒编码的病毒蛋白又能够进化出拮抗宿主限制因子抗病毒活性的能力。FIV作为慢病毒属成员,大部分HIV的宿主限制因子是FIV潜在的宿主限制因子。进一步研究FIV复制与这些宿主限制因子的相互关系,对于解析FIV的复制机制以及改进HIV研究的FIV/家猫模型具有重要意义,进而促进FIV感染疾病的有效防控措施的发现以及推动FIV/家猫模型在HIV治疗新策略制定方面的应用。
