Otoplan重建在人工耳蜗植入术前评估和电极选择中的应用
2019-01-14高搏蒋刈王强吴丽华蔡剑鸣戴朴
高搏蒋刈王强吴丽华蔡剑鸣戴朴*
1中国人民解放军总医院耳鼻咽喉头颈外科(北京100853)
2福建医科大学省立临床医学院、福建省立医院耳鼻咽喉科(福州350001)
3中国人民解放军总医院放射科(北京100853)
目前,人工耳蜗植入是治疗双耳极重度感音神经性耳聋的唯一有效方法,然而仍有部分患者术后恢复不佳,许多研究提示人工耳蜗的电极植入长度、深度以及电极位置与患者术后康复效果及残余听力的保存密切相关[1,2]。颞骨高分辨率电脑断层扫描(High Resolution Computed tomography,HRCT)是术前评估耳蜗形态、预测手术风险的重要手段,但是HRCT并不能直接辅助术者进行电极的选择,术者需要根据常规影像中耳蜗的高度和大小,经验性选择合适的电极进行植入。为了规范电极植入,许多学者尝试通过CT重建结合耳蜗螺旋数学模型计算耳蜗蜗管长度[3,4],希望术前预测植入电极长度。然而,重建的方法相对费时,不能便捷的辅助术者在术前决定植入方式和电极长度,因此在临床应用较少。Otoplan软件仅需导入患者原始dicom文件,即可快速实现患者内耳重建和测量耳蜗关键参数,为术者呈现三维重建图像并快速计算出耳蜗蜗管长度,从而预测植入电极长度,实现电极个性化植入。本研究应用Otoplan软件对患者术前颞骨CT原始数据进行重建,结合耳蜗螺旋公式计算蜗管长度[4],通过比较Otoplan软件预测耳蜗电极的选择跟实际手术中植入电极的情况,评估此方法的准确度和可靠性。
1 材料与方法
1.1 临床资料
选取2018年1月-2018年10月在中国人民解放军总医院耳鼻咽喉头颈外科就诊的患者13例(14耳),男性7例,女性6例,平均年龄15.1岁,最小患者8个月,最大年龄55岁,所有患者皆为双侧重度感音神经性耳聋。耳蜗结构正常6例(6耳),耳蜗结构正常伴胆脂瘤破坏圆窗起始部1例(左耳),耳蜗发育不良Ⅲ型3例(1例左耳,2例右耳),脑膜炎耳蜗骨化1例(双耳),蜗型耳硬化症伴耳蜗骨化1例(左耳),大前庭水管综合征1例(左耳)。耳蜗畸形分类方法采用2017年Sennaroglu的最新分类方法[5]。
1.2 颞骨CT扫描仪器及扫描参数
Image United 64排螺旋CT进行颞骨CT扫描,成人扫描时采用的管电压和电流分别为120kV、250mAs,儿童扫描时采用的管电压和电流分别为80kV、120mAs,测量图像的重建层厚为0.6mm。窗宽2600,窗位500,扫描基线定位于眶听线并与之平行。所有扫描全部为解放军总医院影像科医师操作进行。
1.3 颞骨影像原始数据Otoplan软件重建及蜗管测量
1.3.1 颞骨影像原始数据Otoplan软件重建
将患者颞骨CT的dicom数据导入Otoplan程序,选择患者影像,进行重建。首先在轴位层面将影像调整至耳蜗蜗轴层面(图1-A),将十字中心移动至底转蜗轴中心(图1-A),旋转红线使其在轴位和冠状位与底转平行且过圆窗中心(图1-A,图1-B),调整蓝线使其在斜冠状位与圆窗中点平行(图1-C)。

图1 Otoplan软件颞骨CT重建层面Fig.1 CT Multiplanar Reconstruction of temporal bone with Otoplan
1.3.2 Otoplan软件下耳蜗参数的测量及蜗管长度计算
重建后选择耳蜗参数测量,首先测量从圆窗膜中点经蜗轴到相对外侧壁的最远距离(图2-A,图2-C绿色标记),测得耳蜗底转直径,测量耳蜗底部到蜗轴顶端的距离得到耳蜗高度(图2-A,图2-B耳蜗顶端红色标记),测量从最内到最外标记点的距离测得耳蜗宽度(图2-B,图2-C蓝色标记),通过耳蜗螺旋函数公式计算出耳蜗蜗管长度,对植入耳蜗电极长度提出建议。
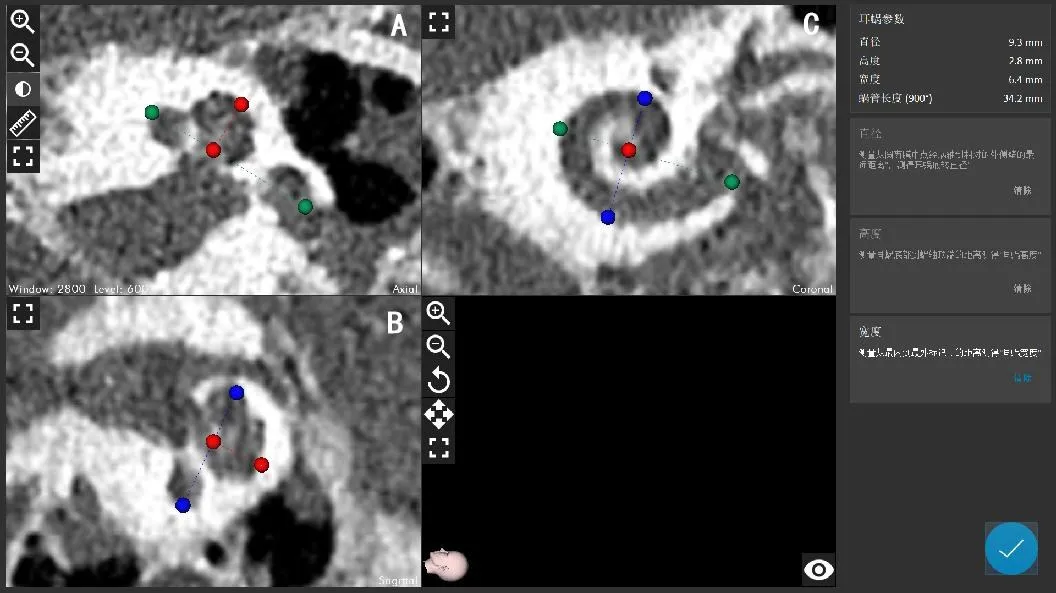
图2 耳蜗测量参数定位示意图Fig.2 Cochlear measurement parameters
1.4 耳蜗手术中电极植入情况
结合耳蜗蜗管长度预测结果,根据术中电极是否完全植入,评估预测的准确性。对于特殊病例术中先通过试探电极探测耳蜗,最终确定植入电极大小。
2 结果
根据术前Otoplan软件预测电极长度,12例患者能够完全植入电极(表1),其中1例耳蜗骨化的患者(图3),计算蜗管长度分别为左侧30.4mm和右侧34.1mm,通过测算其实部骨化长度左侧2.9mm和右侧4.5mm,考虑左侧可植入24mm电极,术中划开圆窗电极不可植入,沿潜在蜗管磨出4mm深的管腔才找到具有空腔的蜗管,24mm电极顺利全部植入。未能完成预测长度电极植入的耳蜗骨化患者有双侧脑膜炎病史,Otoplan重建结果提示双侧耳蜗底转圆窗起始部骨化(图4),计算双侧蜗管长度为左侧32mm和右侧32.1mm,通过测算起始部骨化长度为左侧6.5mm和右侧5.5mm,预估双侧可植入21mm电极,根据术中试探电极测量情况,患者双侧耳蜗实际植入长度为左侧13.5和右侧15.5mm,故选取MED-el短电极完成双侧植入,左侧15mm电极部分植入,右侧15mm电极完全植入。

表1 Otoplan预测电极与耳蜗植入情况Table 1 Otoplan Predicts Electrode and Cochlear Implantation
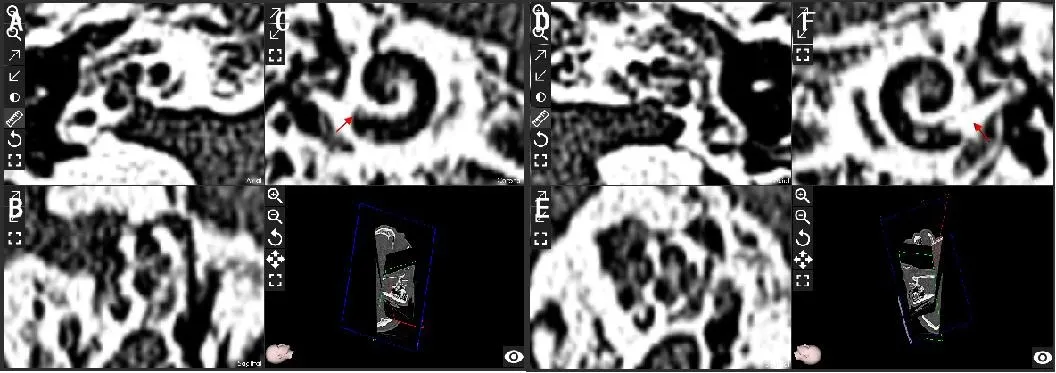
图3 蜗型耳硬化伴圆窗及耳蜗底转起始处骨化(红色箭头所示位置)Fig.3 Otoscelerosis with ossification of round window and basal turn
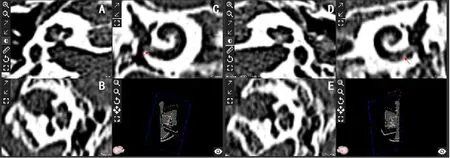
图4脑膜炎患者圆窗及耳蜗底转起始处骨化(红色箭头所示位置)Fig.4 Ossification of round window and basal turn
3 讨论
随着人工耳蜗手术的发展,越来越多的学者关注对耳蜗内精细结构的保护[6,7],选择适合长度的电极植入是其中一个重要因素。电极的长短取决于患者耳蜗蜗管的长度、耳蜗内是否骨化等情况,而不同患者的耳蜗蜗管长度有着个体化差异,因此,耳蜗蜗管的长度测量显得尤为重要,尤其是对于一些耳蜗存在畸形或骨化的患者。既往,术前预测人工耳蜗植入电极主要通过颞骨CT,对耳蜗的大小、耳蜗畸形程度进行大体评估。颞骨CT是观察内耳结构的最主要方式,然而常规颞骨轴位CT并非沿内耳结构的几何轴线扫描,因此在判断耳蜗形态上存在着一定挑战。随着高分辨率CT可以满足各项同性的要求,使用重建技术可以在保留图像分辨率的基础上重建出所需观察结构的任意层面,国内已有相关文献报道采用双斜位影像重建[8],实现了颞骨内不同结构的全程显示,相对于轴位和冠状位图像,重建图像对于内耳结构的显示更加清晰和直观。通过影像重建对耳蜗进行测量,主要需要构建测量的标准层面,既往采用影像重建的方式对耳蜗的形态进行测量,但是重建未充分显示耳蜗底转[9],且测量耳蜗高度的基线并非真正耳蜗底转的基线,故与真实值仍存在一定误差。笔者前期通过CT原始数据,构建三个标准层面(耳蜗底转层面、耳蜗底转长轴层面、耳蜗中轴层面)对耳蜗大小进行检测,与Otoplan的测量层面一致。颞骨CT影像重建虽然可以较便捷、直观的观察内耳形态结构,然而该方法并不能直接测量耳蜗的蜗管长度,即无法为术者提供直观的电极植入长度预测,为此,许多团队开展了针对蜗管长度测量的研究:Ketten团队最早应用阿基米德和等角螺旋模型计算耳蜗盘曲模式探索耳蜗重建[3];2006年,Escude团队[4]应用耳蜗底转的长径A、短径B和耳蜗高度H建立了耳蜗螺旋函数公式(spiral function),结合植入深度计算电极植入长度;随后Alexiades团队[10]认为耳蜗蜗管长度线性依赖于底转长度,在结合Escude耳蜗螺旋函数公式的基础上应用耳蜗底转的长径,计算了耳蜗蜗管长度。Schurzig等[11]应用μCT结合10例颞骨标本,评估了5种不同耳蜗盘曲数学模型,该研究认为耳蜗样条曲线重建(Spline curved reconstruction)最精准的反应了耳蜗的盘曲结构并能准确的测量耳蜗的长度。本研究Otoplan基于影像重建结合耳蜗螺旋函数公式,对13例(14耳)耳蜗植入患者术前耳蜗大小进行预测,其中12例能够在术前准确预测植入电极长度。
本研究通过Otoplan软件,可以清楚的观察耳蜗底转、耳蜗蜗轴结构以及耳蜗的外形轮廓,准确判断了患者的耳蜗形态。通过影像重建可以观察常规CT检测中容易忽略的某些异常,例如耳蜗部分骨化的蜗管内改变。以本研究中的脑膜炎耳蜗骨化患者为例,原始颞骨CT(图5)没有看到明显的耳蜗骨化情况,但从重建的影像中可以清晰的观察到耳蜗底转起始部骨化(图4-C),从而避免漏诊这例耳蜗骨化的患者在术前准确评估了耳蜗植入的困难。这种情况的出现可能与常规CT检测的角度和层厚有关,而影像重建后可以在不同角度观察同一部位的变异,提高术前评估的准确性。CT对于密度较低的硬化灶显影不佳,本研究中一例圆窗处耳蜗骨化患者结合测量硬化灶长度分析预测电极长度,然而其结果明显大于术中实际电极长度,提示对于耳蜗骨化等特殊患者除评估CT外,还应对患者的核磁T1加权像、T2加权像以及内耳水成像进行充分评估。
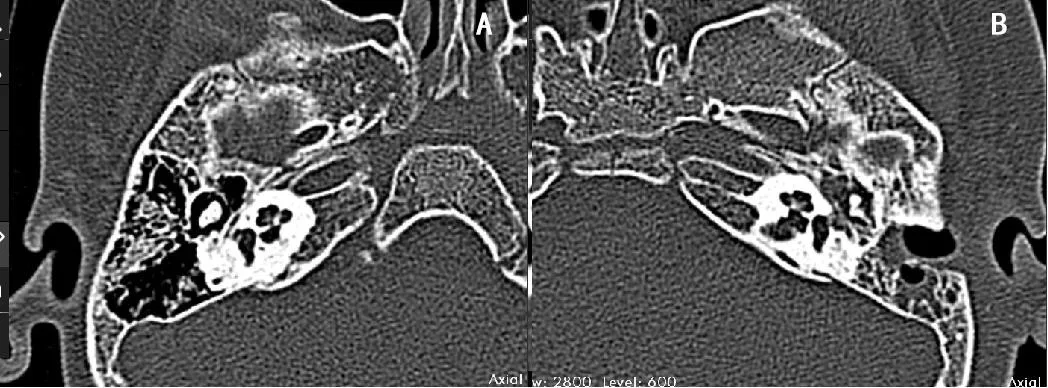
图5脑膜炎耳蜗骨化患者原始CTFig.5 Original CT scan of patient with cochlear ossification after meningitis
4 结论
应用Otoplan软件对耳蜗进行影像重建结合耳蜗螺旋函数公式计算,可以帮助人工耳蜗植入候选者进行植入电极选择的预测,且具有一定准确性,然而对于耳蜗骨化等特殊病例还应结合包括核磁共振在内的多种检测方法进行综合评估分析。
