新蛭素和人IgG-Fc融合蛋白的表达纯化和功能评价
2019-01-14吴祖泽李世崇董晓娜窦桂芳葛志强靳继德
吴祖泽,汪 坤,李世崇,董晓娜,窦桂芳,葛志强,靳继德
新蛭素和人IgG-Fc融合蛋白的表达纯化和功能评价
吴祖泽1, 2,汪 坤1,李世崇2,董晓娜2,窦桂芳2,葛志强1,靳继德2
(1. 天津大学化工学院,天津 300072;2. 军事科学院辐射医学研究所,北京 100850)
新蛭素(EH)具有很好的抗凝血效果,但由于半衰期短限制了其在临床上的推广和应用.为延长EH的半衰期,制备人IgG-Fc和EH的融合蛋白,并对其活性和药代动力学进行初步研究.将合成的Fc-EH和Fc-L-EH融合基因克隆至表达载体pcDNAHC上,再将重组表达载体转染CHO细胞.蛋白A亲和柱纯化融合蛋白,用SDS-PAGE和Western Blot鉴定蛋白表达情况,质谱法检测蛋白的分子质量和C端序列,体外凝块法和大鼠颈静脉血栓模型分别验证融合蛋白的体外抗凝活性和体内抗栓效果,应用化学发光免疫法检测融合蛋白半衰期.结果表明,成功构建了pcDNAHC-Fc-EH和pcDNAHC-Fc-L-EH两个重组表达载体,融合蛋白Fc-EH和Fc-L-EH分子质量分别为68476,u和70542,u,蛋白的C端序列正确,Fc-EH和Fc-L-EH活性分别为256,ATU/mg和64,ATU/mg.大鼠颈静脉血栓实验表明,Fc-EH具有抗血栓作用,体内消除半衰期为39.4,h.融合蛋白Fc-EH能延长EH体内半衰期,为融合蛋白的进一步研究奠定了基础.
水蛭素;新蛭素;抗凝活性;半衰期;Fc融合蛋白
天然水蛭素(hirudin,HV)是水蛭唾液腺分泌的一种小分子蛋白质,是目前发现的最强的凝血酶天然特异抑制剂[1],可直接抑制凝血酶活性且不需要抗凝血酶Ⅲ协同参与,不会诱发血小板和纤维蛋白的减少,有良好的抗凝溶栓效果[2-3].但是水蛭素存在严重的出血副作用,限制了其在临床上的推广和应用[4].本实验室前期构建并表达了通过靶向血栓部位释放抗凝活性的水蛭素衍生物[5],它将凝血因子Ⅹa和Ⅺa特异性识别并切割的寡肽谷氨酸-脯氨酸-精氨酸(EPR)连接到了水蛭素氨基末端,该寡肽可以封闭水蛭素的抗凝活性,只有当体内的凝血系统被激活时,寡肽EPR被富集到凝血部位的凝血因子Ⅹa和Ⅺa识别并裂解掉,才能释放出有活性的水蛭素,发挥靶向抗凝作用.通过这种设计可降低全身或系统性出血风险,将此水蛭素衍生物命名为新蛭素(neorudin,EH[6]). EH的分子质量很小,只有7.3,ku,很容易被肾小球过滤排除出体外,所以半衰期很短,约1~2,h[7],临床上需多次给药才能维持抗凝效果,因此,降低了患者用药的耐受性和依从性.
免疫球蛋白G(IgG)是人体血液中含量最丰富的蛋白质之一,体内半衰期长达21,d,其半衰期与Fc片段密切有关[8].将具有生物活性的功能蛋白分子与 Fc 片段融合,不仅可以延长目的蛋白的半衰期,还可以保留其生物学活性.本研究将EH、人IgG-Fc以两种不同的方式进行融合表达,一种是两者直接融合,另一种是两者之间引入甘氨酸丝氨酸(GS)组成的连接肽,合适的连接肽可以增加融合蛋白的柔性并增强其活性[9].希望能够获得既能明显延长EH半衰期、又不影响抗凝活性释放的融合蛋白,为新型抗凝蛋白的研究奠定基础.
1 材料与方法
1.1 材 料
Wistar大鼠购自北京维通利华实验动物技术有限公司,动物质量合格证号:SCXK(京)2016-0006;胰蛋白胨和酵母提取物购自OXOID公司;蛋氨酸亚氨基代砜(MSX)和山羊抗人IgG-Fc(HRP)购自sigma公司;抗水蛭素抗体购自Abcam公司;质粒提取试剂盒购自北京天根生化科技有限公司;Q5高保真DNA聚合酶、Taq DNA聚合酶、快速连接酶、限制性内切酶Ⅰ、Ⅰ和FXa蛋白酶购自NEB公司;Lipofectamine®2000 转染试剂购自Invitrogen公司;CD CHO培养基、Anti-Clumping Agent购自Gibco公司;澳洲胎牛血清购自北京百灵克生物科技有限责任公司;生物反应器购自赛多利斯公司;HiTrapTMrprotein A FF亲和层析预装柱购自GE公司;Fc-EH和Fc-L-EH融合基因由南京金斯瑞生物科技有限公司合成,以pUC57-Fc-EH和pUC57-Fc-L-EH质粒形式提供;表达载体pcDNAHC由本实验室构建,CHO细胞由本实验室保存;人凝血酶和牛纤维蛋白原购自中国食品药品检定研究院;三氯化铁购自国药集团化学试剂有限公司;EH蛋白冻干品由军事医学科学院放射与辐射医学研究所提供;注射用低分子量肝素钙(立迈清)购自中国人民解放军307医院;微孔板发光分析仪购自北京滨松光子技术股份有限公司;融合蛋白Fc-EH化学发光免疫检测试剂盒购自北京福瑞润康生物技术有限公司.
1.2 方 法
1.2.1 引物的设计与合成
实验用PCR引物序列如表1所示.
表1 PCR引物的序列

Tab.1 Sequence of PCR primers
注:下划线序列是Ⅰ(GCTAGC)和Ⅰ(CTCGAG)引物的酶切位点.
1.2.2 pcDNAHC-Fc-EH和pcDNAHC-Fc-L-EH重组质粒的构建与鉴定
根据已知的融合基因设计引物Fc-EH-FP、Fc-L-EH-FP、Fc-EH-RP和Fc-L-EH-RP,分别以合成的pUC57-Fc-EH和pUC57-Fc-L-EH质粒为模板,利用Q5高保真DNA聚合酶PCR扩增目的基因片段.琼脂糖凝胶电泳分析PCR产物,切胶回收目的片段,将回收产物进行TaqDNA聚合酶催化的PCR反应,然后用快速连接酶将PCR产物与T载体相连接,转化至Trans10感受态细胞,根据蓝白斑筛选阳性克隆,并进行酶切鉴定和测序.
用限制性核酸内切酶Ⅰ、Ⅰ双酶切含目的基因的T载体和表达载体pcDNAHC,将酶切得到的Fc-EH和Fc-L-EH片段克隆至表达载体上,得到重组质粒(见图1).重组质粒转化Trans10感受态细胞,挑选阳性克隆,进行双酶切鉴定并测序.

图1 重组质粒图谱
1.2.3 重组质粒转染CHO细胞与混合克隆的筛选
根据invitrogen公司脂质体2000转染试剂盒说明书,将重组质粒pcDNAHC-Fc-EH和pcDNAHC-Fc-L-EH转染CHO细胞,转染24,h后,将细胞转至摇瓶中培养,用25,μmol/L的MSX加压筛选,收集摇瓶中细胞培养上清,稀释后用ELISA法检测融合蛋白表达水平,选择高表达混合克隆细胞.
1.2.4 Western Blot检测融合蛋白表达
取高表达细胞培养上清,进行Western Blot验证.经12%,的SDS-PAGE后,凝胶湿法转膜(100,V,1.5,h),将蛋白质转到PVDF膜上,5%,的BSA封闭40,min,TBST溶液洗膜3次,用山羊抗人IgG-Fc/HRP(1∶3,000稀释)室温孵育1,h,TBST溶液洗膜3次,滴加显影液进行显影,凝胶成像仪进行拍照.
1.2.5 融合蛋白的纯化
筛选出来的混合克隆细胞经生物反应器扩大培养,离心收集细胞培养上清,先用0.80,μm和0.45,μm的滤膜依次过滤进行初步纯化,再用蛋白A亲和层析柱进行进一步纯化.亲和柱用5倍柱体积的pH 7.0、20,mmol/L的磷酸盐缓冲液平衡,然后将滤过的细胞培养上清过柱子,用平衡缓冲液冲洗柱子至紫外吸收值到达基线,再用pH,3.0、0.1,mol/L的柠檬酸钠缓冲液进行洗脱,pH,9.0、0.1,mol/L的Tris-Hcl调节蛋白液pH值至7.0.
1.2.6 融合蛋白浓度和纯度测定
用NanoDrop仪和Folin-酚法测纯化的融合蛋白浓度,Folin-酚法参考2015版的《中国药典》第三部;取融合蛋白样品进行SDS-PAGE,凝胶使用考马斯亮蓝染色后,进行扫描拍照,再用Scion Image软件分析融合蛋白纯度.
1.2.7 融合蛋白分子质量测定和C端测序
采用还原性SDS-PAGE和LC-MS(液相色谱-质谱)联用的方法测定融合蛋白的相对分子质量.用胰蛋白酶处理融合蛋白Fc-EH和Fc-L-EH,质谱法检测融合蛋白的C端氨基酸序列.
1.2.8 融合蛋白体外抗凝活性检测
取30,μL稀释的融合蛋白与1,μL凝血因子Ⅹa混匀,37,℃裂解6,h;裂解的融合蛋白做倍比稀释(根据形成凝块决定最终稀释倍数),取10,μL不同稀释倍数的样品,各加入20,μL、8,IU/mL凝血酶,轻轻混匀再加入2.5%,的纤维蛋白原20,μL,室温静置15,min,轻弹EP管壁,观察凝块形成情况.等体积的去离子水替代裂解的融合蛋白和凝血酶溶液作为空白对照;等体积的去离子水替代裂解的融合蛋白溶液作为阳性对照;未裂解的融合蛋白溶液替代裂解的融合蛋白溶液作为裂解前对照.融合蛋白的抗凝活 性=凝血酶活性/未出现凝块最低融合蛋白浓度=(凝血酶活性单位×凝血酶体积)/(融合蛋白浓度÷稀释倍数×样品体积).
1.2.9 Fc-EH融合蛋白体内活性初步检测
Wistar大鼠,雄性,体重200~250,g,随机分为模型组、阳性对照组和不同剂量实验组,每组6只.阳性对照组分别尾静脉注射低分子肝素钙(剂量3,U/kg)和EH(剂量3,mg/kg),实验组分别尾静脉注射融合蛋白Fc-EH(融合蛋白剂量分别为4.5、13.5、27.0,mg/kg,换算成EH剂量分别为1、3、6,mg/kg).分离颈静脉,静脉下放置小片塑料薄膜(2,cm×1,cm)保护血管周围组织,静脉注射给药15,min后,再用3,mL、50%,FeCl3溶液浸润的无尘纸(1.0,cm×0.5,cm)包裹血管,造成血管内皮损伤,诱导血栓形成.造模后0.5,h取血,3.8%,的枸橼酸钠抗凝,离心分离血浆测定凝血参数PT和APTT;2,h后剖开血管取出血栓,滤纸吸干净血栓表面血液,称量其湿重.
1.2.10 Fc-EH融合蛋白药代动力学初步研究
取6只Wistar雄性大鼠,体重200~250,g,以13.5,mg/kg剂量单次尾静脉注射融合蛋白Fc-EH.分别在给药前和给药后0.5,h、1,h、2,h、4,h、12,h、24,h、48,h、72,h、96,h、120,h和144,h取血,3.8%,的枸橼酸钠抗凝,离心分离血浆.利用双抗体夹心法检测血浆中融合蛋白Fc-EH含量,即用水蛭素抗体包被,加入待测样品,再加山羊抗人IgG-Fc(HRP标记),最后加入化学发光底物后,用光子计数仪测定各孔的光子计数.采用WinNonlin软件进行数据处理,计算药代动力学参数.
全球领先的传动与控制技术专家博世力士乐在2018年上海宝马展上展出了多款应用于行走机械行业的智能化和个性化产品,致力于帮助众多中国本土客户解决在企业发展和产品创新方面的诸多难题。
2 结 果
2.1 重组表达载体的构建与验证
用PCR扩增融合基因,产物进行琼脂糖凝胶电泳分析.结果显示,扩增的片段大小约为960,bp和1,000,bp,与融合基因Fc-EH和Fc-L-EH预期大小相一致;将融合基因克隆至T载体,用Ⅰ、Ⅰ双酶切,酶切结果与预期一致,测序结果正确.
将测序正确的融合基因克隆至表达载体pcDNAHC上,用Ⅰ、Ⅰ双酶切重组质粒,酶切结果显示大约在960,bp和1,000,bp位置有特异性条带(见图2),与预期结果相一致;重组质粒测序结果正确,说明没有发生核苷酸序列突变,通过酶切和测序的结果,表明pcDNAHC-Fc-EH和pcDNAHC-Fc-L-EH质粒构建成功.

图2 重组质粒的酶切鉴定
2.2 重组质粒转染和融合蛋白检测
重组质粒转染CHO细胞,MSX加压筛选培养两周后,转染组有成簇的细胞团产生,扩大培养后收集细胞上清,稀释3,000倍后通过ELISA法检测不同细胞培养上清中融合蛋白表达量(见表2).
表2 融合蛋白表达检测结果
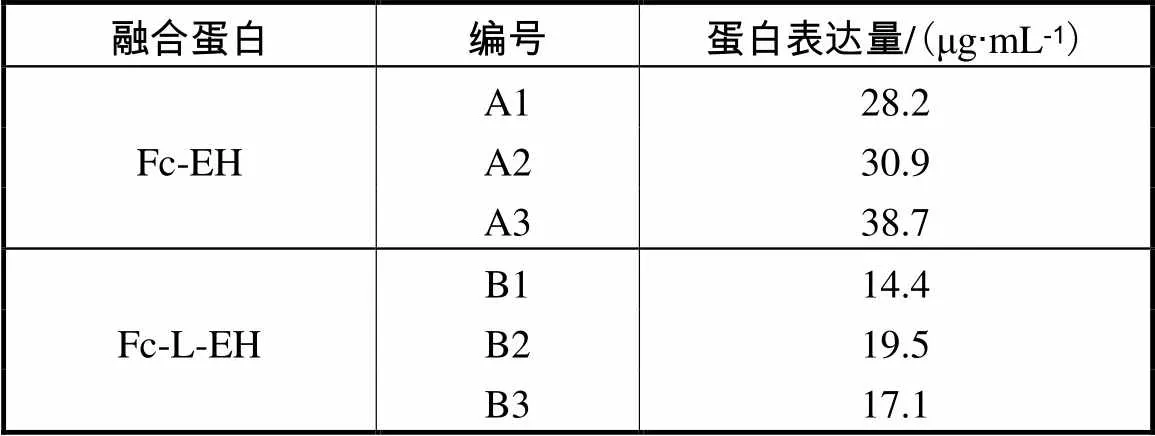
Tab.2 Result of expression of fusion protein
根据ELISA的结果,分别取细胞株A3和B2细胞培养上清进行Western Blot验证,两个高表达细胞培养上清在分子质量35,ku左右产生特异性条带(见图3),与融合蛋白预期分子质量大小一致.

1—Fc-EH高表达细胞培养上清;2—Fc-L-EH高表达细胞培养上清
图3 Western Blot鉴定细胞培养上清
Fig.3 Identification of cell culture supernatant using Western Blot
2.3 融合蛋白的纯化及鉴定
细胞培养上清经蛋白A亲和柱纯化后进行SDS-PAGE,经考马斯亮蓝染色后得到4条清晰的目的蛋白条带(见图4),第1和第2泳道为还原性SDS-PAGE,融合蛋白呈现为单体形式;第3和第4泳道为非还原性SDS-PAGE,融合蛋白呈现为二聚体形式.作为IgG抗体一部分的Fc片段含有二硫链,主要以二聚体的形式存在[10].本实验表达的两个Fc融合蛋白也主要是以二聚体的形式存在.电泳图经灰度分析得出融合蛋白Fc-EH和Fc-L-EH的纯度分别为98.9%,和97.8%,.
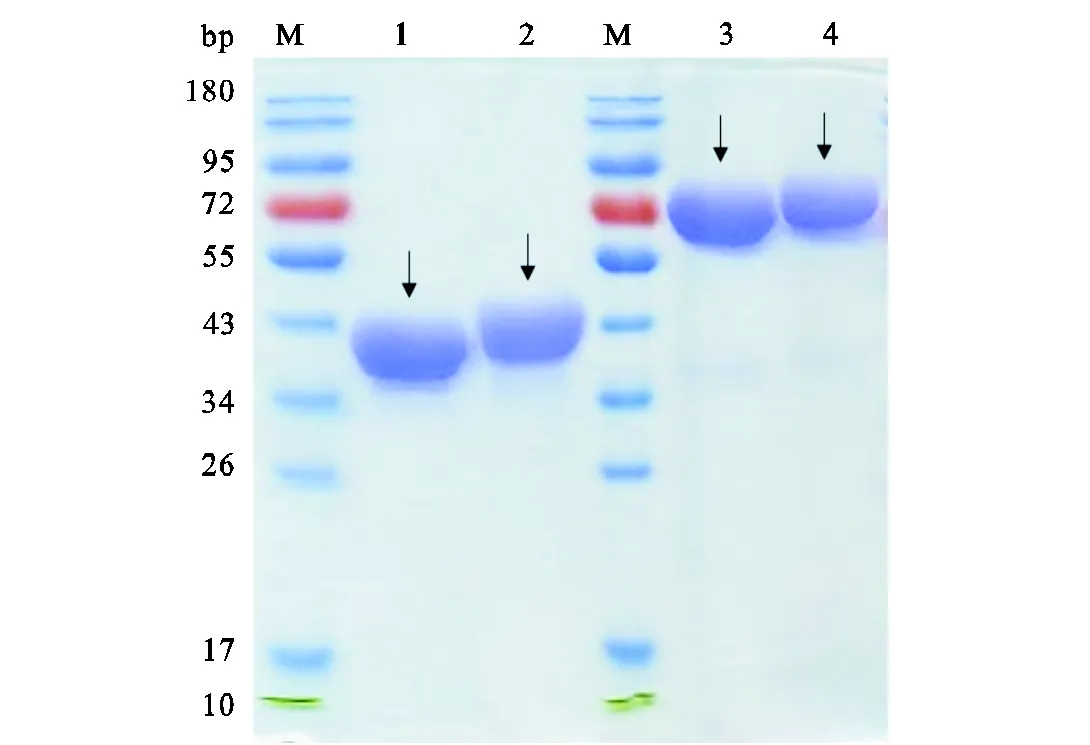
M—蛋白marker;1—融合蛋白Fc-EH单体;2—融合蛋白Fc-L-EH单体;3—融合蛋白Fc-EH二聚体;4—融合蛋白Fc-L-EH二聚体
质谱测得融合蛋白Fc-EH和Fc-L-EH的分子质量分别是68,476,u和70,542,u(见图5),与融合蛋白二聚体的理论分子质量大小相一致,进一步证实融合蛋白以二聚体的形式存在.融合蛋白Fc-EH和Fc-L-EH的C端测序结果GNQCVTGEGTPKPESHN NGDFEEIPEEYLQ,与标准融合蛋白的C端序列比对相同.
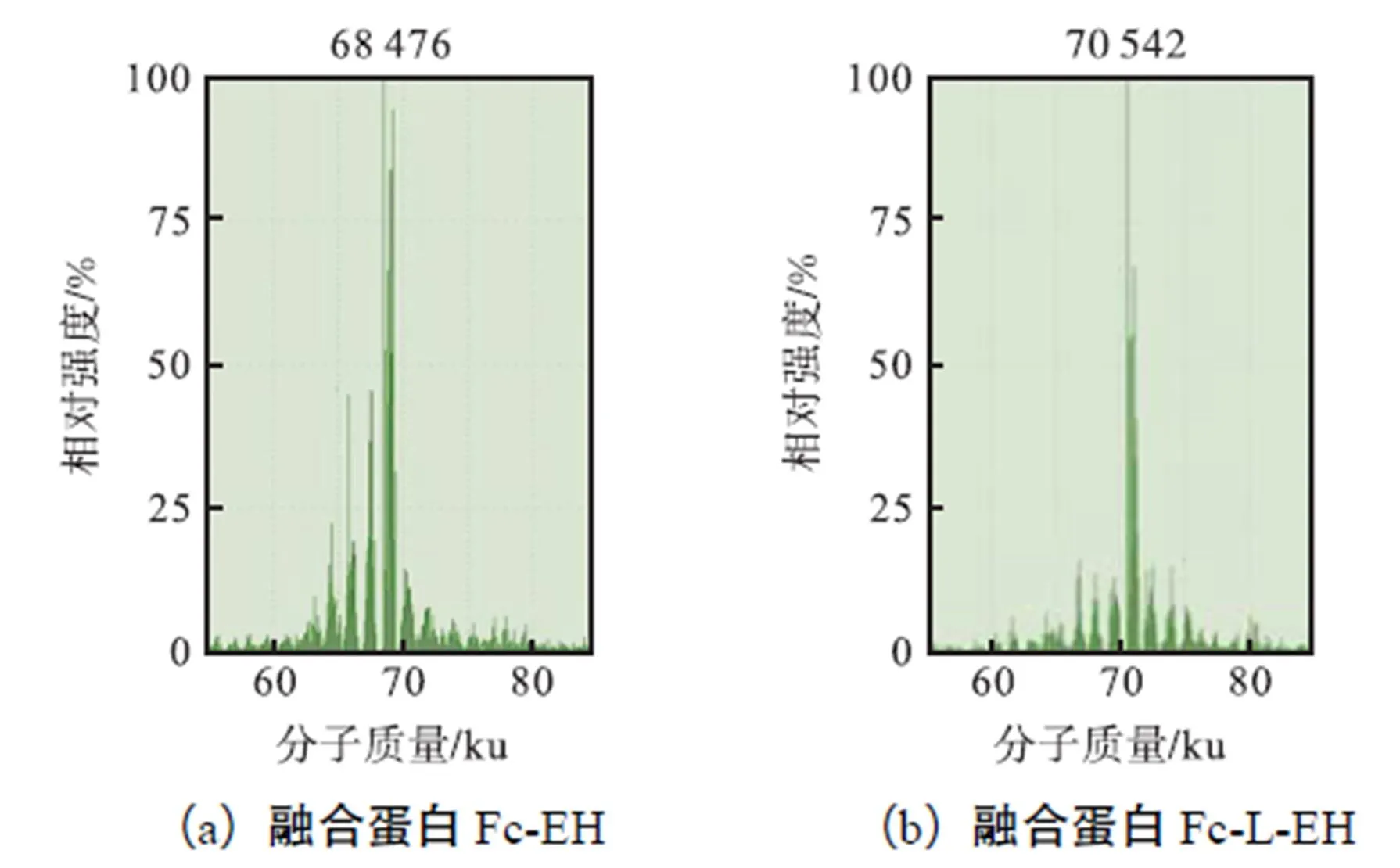
图5 融合蛋白质谱分析
2.4 融合蛋白活性检测
体外凝块法的实验结果显示(见表3),未经FXa切割的融合蛋白没有抗凝功能,但经FXa裂解后的融合蛋白Fc-EH和Fc-L-EH均释放出抗凝活性,融合蛋白Fc-EH活性为256,ATU/mg,Fc-L-EH活性为64,ATU/mg.
表3 融合蛋白的抗凝活性
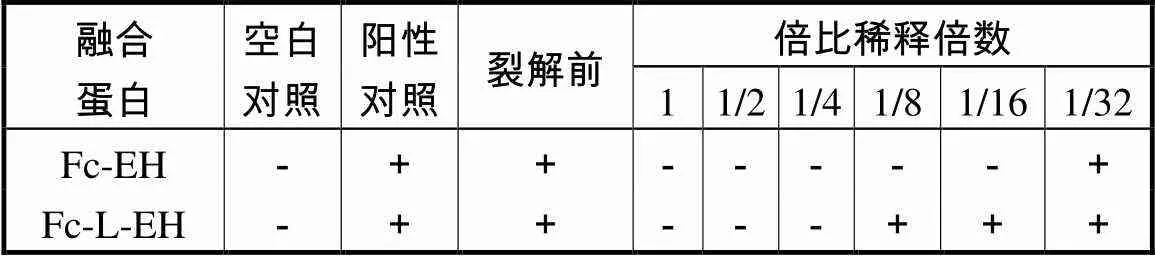
Tab.3 Anti-thrombin activity of fusion protein
注:“+”有凝块;“-”无凝块;空白对照:30,μL蒸馏水+20,μL纤维蛋白原;阳性对照:10,μL蒸馏水+20,μL凝血酶+20,μL纤维蛋白原;裂解前:10,μL未裂解的样品+20,μL凝血酶+20,μL纤维蛋白原.
2.5 抗大鼠颈静脉血栓实验结果
融合蛋白Fc-EH对大鼠静脉凝血参数的影响结果显示(见图7),与生理盐水组比较,4.5mg/kg、13.5mg/kg、27.0mg/kg融合蛋白Fc-EH组的PT值均明显延长.与低分子肝素钙组比较,4.5mg/kg融合蛋白组和EH组的PT值有明显差异(<0.05,<0.001),13.5mg/kg、27.0mg/kg融合蛋白无明显差异(>0.05).4.5mg/kg融合蛋白和EH组的APTT值与生理盐水组无明显差异(>0.05),13.5mg/kg、27.0mg/kg融合蛋白组明显高于生理盐水组(<0.001,<0.001).低分子肝素钙给药组的APTT值明显高于4.5mg/kg、13.5mg/kg、27.0mg/kg融合蛋白组.等摩尔剂量的Fc-EH对PT和APTT的影响大于EH(<0.01,<0.001).

*表示P<0.05,***表示P<0.001
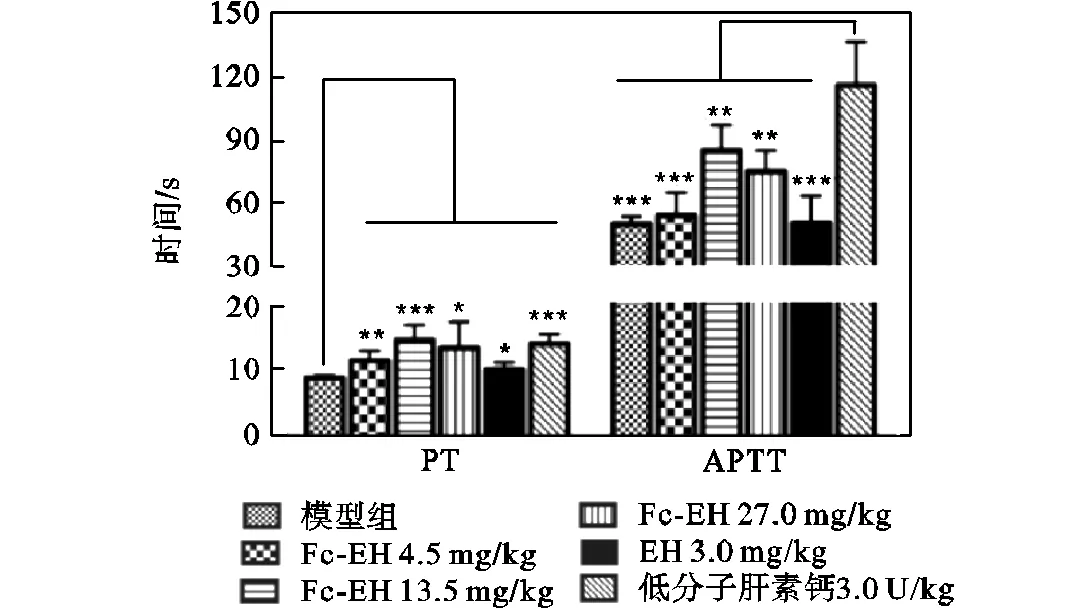
*表示P<0.05,**表示P<0.01,***表示P<0.001
2.6 融合蛋白Fc-EH药代动力学检测
通过化学发光免疫法检测大鼠给药后不同采血时间点血浆中融合蛋白Fc-EH的含量(见图8),经计算,大鼠静脉注射13.5,mg/kg融合蛋白Fc-EH后药代动力学参数,峰质量浓度(max)为(32.0±3.9) μg/mL,药-时曲线下面积(AUC0~144)为(1,294.9±104.6)(,h·μg)/mL,体内消除半衰期1/2为(39.4±4.9)h.

图8 大鼠静脉注射Fc-EH后的平均药-时曲线
3 讨 论
为解决水蛭素出血问题,本实验室构建了水蛭素的衍生物——新蛭素.通过体外的抗凝实验[11]、体内的大鼠颈动脉血栓模型和后腔静脉血栓模型实验[6]均证明了EH在有效抗血栓作用的情况下,出血副作用明显降低.虽然EH有很好的抗栓效果,但其体内半衰期较短,给临床应用带来一定的不便,因此,需要对EH修饰或改良来延长其半衰期,提高药物疗效.
传统上,增加重组蛋白半衰期的主要策略是通过与聚乙二醇(PEG)偶联来增加流体动力学体积,从而延长药物在体内的代谢时间[12-14].但是偶联PEG的方法存在很多问题,它与肾皮质上皮细胞的空泡化有关,存在安全性问题,且PEG在体内很难被降解,修饰后的蛋白再纯化、检测分析困难和价格高等因素限制了它的应用[15].
将药物蛋白和IgG的Fc片段融合是解决药物半衰期短的另一重要方法.Fc融合蛋白通过新生儿Fc受体(FcRn)介导的再循环过程可提高多肽或者小分子蛋白药物的药代动力学参数,这一技术得到了广泛的认可和应用[16-19].截至目前为止,Fc融合蛋白药物共有37种,处于Ⅰ/Ⅱ期临床阶段的有23种,Ⅲ期临床阶段有3种,已经批准上市的有11种[20].所以,利用Fc融合目的蛋白已发展为一种可靠的药物研发手段,具有很大的市场前景.
Fc片段与EH的连接方式有两种,一种是连接在EH的N端,另一种是连接在EH的C端,如果Fc片段连接到EH的C端时,当体内凝血系统激活时,融合蛋白被相应的凝血因子识别并裂解掉寡肽EPR,只释放出水蛭素的N端抗凝血酶活性,由于融合蛋白很难被肾小球过滤快速清除掉,这样裂解掉EPR寡肽的融合蛋白会一直保留着抗凝活性,增加了患者的出血风险.为了避免这一出血风险,本研究将Fc片段连接到EH的N端,在体内凝血系统未被激活时,可以较长时间存在于血液中.而当体内产生血栓时,融合蛋白即可被相应的凝血因子识别并裂解掉Fc和寡肽EPR,释放出完整的水蛭素,水蛭素跟凝血酶结合抑制其活性,发挥抑制血栓的作用.因此,这种设计可以在延长药物半衰期的基础上,既保留了EH的抗凝活性,又不增加出血风险.考虑到两种蛋白直接融合可能会影响蛋白的构型,从而会影响凝血因子对EPR的识别和切割作用.GS连接肽常用于融合蛋白功能域之间的连接,可以降低蛋白之间的空间位阻,提高蛋白的活性[21].因此,本文设计了在EH和IgG-Fc蛋白之间增加GS连接肽的结构,通过增加融合蛋白的柔性而规避其对EPR识别位点的 影响.
体外凝块法的实验结果显示,融合蛋白的活性(Fc-EH为256,ATU/mg,Fc-L-EH为64,ATU/mg)均较EH蛋白(512,ATU/mg)降低,说明融合蛋白的抗凝活性受到了连接Fc片段的干扰.而融合蛋白Fc-L-EH的活性受到干扰更为明显,推测连接肽进一步阻碍了凝血因子对融合蛋白EPR位点的识别与切割,结果没有达到预期目的.此外,连接肽的组成、长度、疏水性、对蛋白酶的敏感性都会影响蛋白的活性,后续会进一步设计和筛选最优的连接肽,提高融合蛋白的活性.
动物实验结果表明Fc-EH融合蛋白可有效抑制大鼠静脉血栓的形成,并呈剂量依赖性,在相同抗栓效果下,对凝血参数PT和APTT影响明显低于低分子肝素.在相同摩尔给药剂量下,Fc-EH融合蛋白与EH抗栓效果相当,但对凝血参数的影响较EH有所增加,可能与Fc-EH的体内半衰期较长有关.
Fc-EH在大鼠体内的半衰期长达39.4,h,而 EH在猕猴体内半衰期经ELISA法检测为1.3,h,EH在大鼠体内半衰期经放射性同位素标记法检测为6.3,h.因此与EH相比,Fc-EH在体内的半衰期明显延长,可较长时间地在体内发挥抑制血栓形成的作用.同时由于Fc-EH发挥抗凝活性需要凝血因子对其识别切割释放EH,因此Fc-EH半衰期的延长不会明显增加药物的出血副作用.Fc-EH融合蛋白的获得,为开发出安全、特异性和长效的新型抗栓药奠定基础.
4 结 论
(1)实验优化合成了融合基因Fc-EH和Fc-L-EH,并成功构建了两个重组表达载体pcDNAHC-Fc-EH和pcDNAHC-Fc-L-EH,将构建的重组表达载体转染CHO细胞,经蛋白A亲和柱纯化,得到了融合蛋白Fc-EH和Fc-L-EH,纯度分别为98.9%和97.8%.
(2)融合蛋白Fc-EH和Fc-L-EH经FXa裂解后,凝块法检测融合蛋白Fc-EH和Fc-L-EH的活性分别为256ATU/mg和64ATU/mg.
(3)融合蛋白Fc-EH体内药效学结果显示其具有较好的抗血栓活性,血栓湿重呈融合蛋白剂量依赖性降低;相同药效的情况下,融合蛋白Fc-EH的出血风险较低分子肝素明显降低.
(4)融合蛋白Fc-EH体内药代动力学结果显示,其半衰期明显延长,大约是EH的20倍,可较长时间在体内发挥抗血栓作用.
(5)本研究成功构建并表达了融合蛋白Fc-EH,该融合蛋白可以有效抑制血栓的形成,半衰期的延长没有明显增加出血副作用.这种新型长效融合蛋白为抗凝血药物的研究提供了新的思路.
[1] Markwardt F. Hirudin as alternative anticoagulant—A historical review[J]. Seminars in Thrombosis and Hemostasis,2002,28(5):405-414.
[2] Sohn J,Kang H,Rao K,et al. Current status of the anticoagulant hirudin:Its biotechnological production and clinical practice[J]. Applied Microbiology and Biotechnology,2001,57(5/6):606-613.
[3] Lubenow N,Greinacher A. Hirudin in heparin-induced thrombocytopenia[J]. Seminars in Thrombosis and Hemostasis,2002,28(5):431-438.
[4] Nisio M D,Middeldorp S,Büller H R. Direct thrombin inhibitors[J]. The New England Journal of Medicine,2005,353(10):1028-1040.
[5] Zhang C,Yu A,Yuan B,et al. Construction and functional evaluation of hirudin derivatives with low bleeding risk[J]. Thromb Haemost,2008,99(2):324-330.
[6] 王文文,徐向伟,赵专友. 谷氨酸-脯氨酸-精氨酸-水蛭素抑制血栓形成的实验研究[J]. 中国药学杂志,2013,48 (2):111-115.
Wang Wenwen,Xu Xiangwei,Zhao Zhuanyou,et al. Anti-thrombus activity of a novel anti-thrombus protein EPR-hirudin[J]. Chinese Pharmaceutical Journal,2013,48(2):111-115(in Chinese).
[7] Dong Xiaona,Meng Zhiyun,Jin Jide. Development,validation,and clinical pharmacokinetic application of ultraperformance liquid chromatography/tandem mass spectrometry method for simultaneously determining a novel recombinant hirudin derivative(neorudin)and its active metabolite in human serum[J]. Journal of Chromatography B,2017,1063:204-213.
[8] Jonathan T S,Szoka F C. The neonatal Fc receptor,FcRn,as a target for drug delivery and therapy[J]. Adv Drug Deliv Rev,2015,91(30):109-124.
[9] Chen X Y,Zaro J L,Shen W C. Fusion protein linkers:Property,design and functionality[J]. Adv Drug Deliv Rev,2013,65(10):1357-1369.
[10] Czajkowsky D M,Hu J,Shao Z,et al. Fc-fusion proteins:New developments and future perspectives[J]. EMBO Mol Med,2012,4(10):1015-1028.
[11] 秦晓永,于爱平,毕建进. 抗凝蛋白EH体外活性检测条件的建立[J]. 中国生物工程杂志,2010,31(5):108-112.
Qin Xiaoyong,Yu Aiping,Bi Jianjin. The anticoagulant activitydetection of EH in vitro[J]. China Biotechnology,2010,31(5):108-112(in Chinese).
[12] Van Witteloostuijn S B,Pedersen S L,Jensen K J. Half-life extension of biopharmaceuticals using chemical methods:Alternatives to PEGylation[J]. ChemMed-Chem,2016,11(22):2474-2495.
[13] Jevsevar S,Kunstelj M,Porekar V G. PEGylation of therapeutic proteins[J]. Biotechnol J,2010, 5(1):113-128.
[14] Caliceti P,Veronese F M. Pharmacokinetic and biodistribution properties of poly(ethylene glycol)-protein conjugates[J]. Advanced Drug Delivery Reviews,2003,55(10):1261-1277.
[15] Strohl W R. Fusion proteins for half-life extension of biologics as a strategy to make biobetters[J]. Biodrugs,2015,29(4):215-239.
[16] Rath T,Baker K,Dumont J A,et al. Fc-fusion proteins and FcRn:Structural insights for longer-lasting and more effective therapeutics[J]. Crit Rev Biotechnol,2015,35(2):235-254.
[17] Roopenian D C,Akilesh S. FcRn:The neonatal Fc receptor comes of age[J]. Nat Rev Immunol,2007,7(9):715-725.
[18] Kontermann R E. Strategies for extended serum half-life of protein therapeutics[J]. Curr Opin Biotechnol,2011,22(6):868-876.
[19] Kontermann R E. Strategies to extend plasma half-lives of recombinant antibodies[J]. Biodrugs,2009,23 (2):93-109.
[20] Strohl W R. Current progress in innovative engineered antibodies[J]. Protein Cell,2017,9(1):86-120.
[21] Zhao H L,Yao X Q,Xue C,et al. Increasing the homogeneity,stability and activity of human serum albumin and interferon-a2b fusion protein by linker engineering[J]. Protein Expression and Purification,2008,61(1):73-77.
(责任编辑:田 军)
Expression,Purification and Functional Evaluation of Neorudin-Human IgG-Fc Fusion Protein
Wu Zuze1, 2,Wang Kun1,Li Shichong2,Dong Xiaona2,Dou Guifang2,Ge Zhiqiang1,Jin Jide2
(1.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2.Institute of Radiation Medicine,Academy of Military Science,Beijing 100850,China)
Neorudin(EH)has a good anticoagulant effect.However,the short half-life of EH limits its clinical popularization and application.To prolong the half-life of EH,fusion proteins of Fc segment of human IgG and EH were prepared and the anticoagulant activity and pharmacokinetics of the fusion proteins were studied.The fusion genes Fc-EH and Fc-L-EH were cloned into the expression vector pcDNAHC and expressed in CHO cells.The fusion proteins were purified by protein A affinity chromatography and identified by SDS-PAGE and Western Blot.The molecular mass and C-terminal amino acid sequences of the fusion proteins were detected using mass spectrometry.The anticoagulant activities of fusion proteinsandwere detected with clot methods and jugular vein thrombosis rat models,respectively.The half-life of the fusion protein was tested in rats by chemiluminescence immunoassay.The results of restriction enzyme reaction indicated that the two recombinant expression vectors pcDNAHC-Fc-EH and pcDNAHC-Fc-L-EH were constructed,and the molecular masses of two targeting proteins were measured 68,476,u and 70,542,u,respectively.The correct C-terminal amino acid sequences of the fusion proteins were obtained.The anticoagulant activity of the fusion protein Fc-EH is 256 ATU/mg,whereas that of Fc-L-EH is 64 ATU/mg.The results of jugular vein thrombosis rat models indicated that the fusion proteins of Fc-EH dose-dependently inhibited thrombosis.pharmacokinetic,studies showed that the elimination half-life of Fc-EH spanned 39.4,h.These results demonstrate that the Fc-EH fusion protein prolongs the half-life of EH,paving the way for the further studies of its anticoagulant effects.
hirudin(HV);neorudin(EH);anticoagulant activity;half-life;Fc fusion protein
10.11784/tdxbz201803084
Q819
A
0493-2137(2019)02-0136-07
2018-03-23;
2018-04-27.
吴祖泽(1935— ),男,院士,13910026365@163.com.
靳继德,jinjide505@163.com.
国家科技重大专项资助项目(2012ZX09102301-008).
the National Science and Technology Major Project of the Ministry of Science and Technology of China(No.2012ZX09102301-008).
