18F-FDG PET/CT显像在肝单发占位病变中的诊断价值
2019-01-10
肝脏单发占位病变在临床较常见,有时难以判断良性、原发恶性或转移,准确地检测和定性诊断对临床治疗方案的选择及患者预后具有重要意义。目前主要依靠超声、增强CT、增强MRI等影像学检查,敏感度分别约为60%、70%、80%[1-2]。常规影像学检查主要观察肝内病灶的形态学特征、血供变化,这些影像学检查易受局部解剖位置的影响无法对全身的肿瘤侵袭情况与生物学性状进行评估[3]。正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)作为一种功能性分子影像学检查方法,将PET的功能显像与CT的解剖成像有机融合,作为互补的代谢成像可以检出肝内代谢活跃的结节。本研究回顾性分析接受18F-FDG PET/CT扫描的肝单发占位病变患者资料,探讨18FFDG PET/CT对肝单发占位病变的诊断价值。
1 材料与方法
1.1 患者资料
收集2012年3月至2017年9月在天津医科大学肿瘤医院行18F-FDG PET/CT检查发现肝单发占位病变,且均经本院或外院核磁共振或增强CT证实为肝单发占位,并拥有完整病理资料的177例患者资料。包括男性113例,女性64例,平均年龄(57.44±10.45)岁。其中,141例为肝单发占位首诊,36例为其他恶性肿瘤术后或放化疗后复查发现肝单发占位。
1.2 方法
1.2.1 显像方法18F-FDG PET/CT检查设备应用美国通用电气公司生产的Discovery 710 PET/CT。18F-FDG由本院PET-CT中心提供,由美国GE mini trace回旋加速器生产,TRACERlab FXFDG合成器合成,半衰期109.8 min,放化纯度>95%。受检者至少禁食6 h,且于注射18F-FDG前测指尖血糖,控制血糖<11.1 mmol/L。18FFDG的注射剂量为3.7~4.8 MBq/kg,注射药物后保持静息状态1~1.5 h。排尿后开始扫描,扫描范围为头部至大腿中部,先进行CT扫描,层厚5 mm,螺距0.75,然后三维采集PET图像,每个扫描床位采集2 min,采用迭代法进行图像重建。
1.2.2 影像学分析 由2名高级职称的核医学医师独立对图像进行处理及分析,判断生理性摄取与正常变异、伪影等,观察肝内单发占位病变有无放射性浓聚及病灶位置、大小、密度等。PET图像病灶放射性浓聚高于周围肝脏组织判定为阳性可测量病灶,若CT上可见病灶但PET显像上浓聚程度等于或低于周围正常组织,则为阴性不可测量病灶。在PACS系统上勾画出肝脏病变的感兴趣区(region of interest,ROI),测量多个层面的CT值,最后计算得到平均值,同时测量病灶最大层面的长、短径。此外,所有阳性患者图像通过AW4.6后处理工作站,应用PETVCAR(PET volume computed assisted reading,GE Healthcare)软件,自动勾画ROI,计算机程序自动计算出该部位的标准化摄取最大值(maximum standardized uptake value,SUVmax)、标准化摄取平均值(SUVmean),同时在周围正常肝脏实质部分选取1 cm3感兴趣区,测得正常肝组织的SUVmean,计算肝脏病灶(T)与正常肝组织(N)的T/N比值,即T/N(SUVmax)、T/N(SUVmean)等于肝脏病灶的SUVmax、SUVmean分别与肝脏正常组织SUVmean的比值。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。所有数据均以来表示。连续变量多组之间采用ANOVA方差分析,使用LSD法进行两两比较。为了解SUVmax、SUVmean两个代谢指标诊断不同病理类型肝病灶的敏感度及特异度,分别绘制不同代谢指标HCC、ICC、肝转移瘤的ROC曲线,曲线下面积(area under the ROC curve,AUC)比较行Z检验。两连续性变量间的相关性采用Pearson相关性分析。P<0.05为差异具有统计学意义。
2 结果
2.1 病理结果
177例患者均经手术或穿刺病理证实,详见表1。其中低分化HCC 18例、中分化HCC 12例、高分化HCC 7例。
2.2 PET/CT显像结果
在177例患者中,87.0%(154/177)病灶PET显像放射性浓聚程度高于周围肝脏组织,13.0%(23/177)病灶等于或低于周围肝脏组织(表1)。ICC、HCC、转移瘤和良性病灶的阳性率分别为95.2%、67.6%、98.7%、50.0%。此外,177例患者中PET/CT结果高度怀疑50例(28.2%)全身多处淋巴结转移,18例(10.2%)骨或骨髓转移,12例(6.8%)肺转移,5例(2.8%)腹膜转移,6例(3.4%)PET/CT疑诊为同时双原发,其中9例经病理确诊为淋巴结转移,3例经病理证实为双原发。
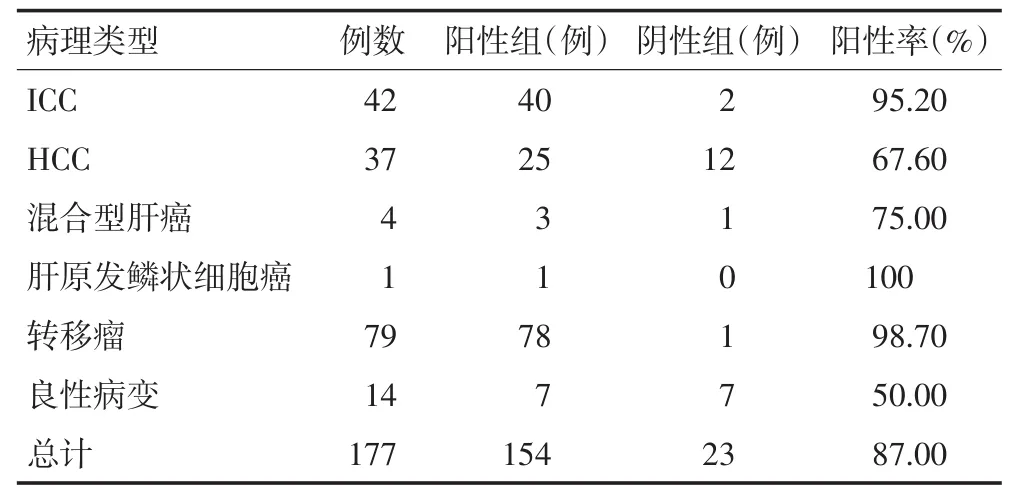
表1 肝单发占位病变的病理及PET显像结果
2.3 CT值及长、短径对肝单发占位病变的诊断价值
转移瘤组CT值<肝原发恶性肿瘤组<良性病变组,但差异无统计学意义(P=0.775,表2)。肝原发恶性肿瘤组长、短径均>转移瘤组和良性病变组,且组间差异存在统计学意义(P均<0.05,表2)。

表2 各组肝占位病变间CT值及长、短径差异
2.4 PET显像对肝单发占位病变的诊断价值
PET显像阳性率见表1,对阳性可测量病灶进行分组比较。HCC的SUVmax、SUVmean、T/N(SUVmax)、T/N(SUVmean)均低于其他类型肝癌、转移瘤及良性病变,且差异存在统计学意义(均P<0.05,表3)。进一步绘制SUVmax、SUVmean诊断HCC、ICC及转移瘤的ROC曲线,HCC的SUVmax、SUVmean曲线下面积均<0.5,ICC和转移瘤的SUVmax、SUVmean曲线下面积为0.550~0.577。此外,分别对ICC和转移瘤的AUC-SUVmax和AUC-SUVmean行Z检验,其结果均为Z≈0.32,差异均无统计学意义(P>0.05)。
2.5 SUVmax与病灶大小的相关性
根据结节直径将84例原发性肝癌分为直径≤3 cm的小肝癌组(17例)、直径在3~5 cm的结节型肝癌组(27例)、直径≥5 cm的大肝癌组(40例)。三组SUVmax分别为(5.34±3.45)、(6.64±4.99)、(10.03±6.28)g/mL,LSD法两两比较显示小肝癌组、结节型肝癌组分别与大肝癌组的SUVmax差异具有统计学意义(P均<0.05),但小肝癌组与结节性肝癌组间SUVmax差异无统计学意义(P>0.05)。Pearson相关性分析显示SUVmax与病灶大小呈正相关(r=0.535,P<0.001)。

表3 各组肝占位病变间不同代谢指标的差异

表4 HCC、ICC及转移瘤ROC曲线结果
3 讨论
PET/CT融合了PET的功能显像和CT精确显示解剖细节的优点,能一次检查全身成像,可以整体评估病灶及转移情况[4]。本研究中除肝病灶外,还检出了淋巴结、骨或骨髓、肺及腹膜的转移病灶。另有6例检出双原发,其中3例经病理证实。Choi等[5]的前瞻性研究中纳入了547例癌症患者证实PET/CT对于发现第二原发肿瘤以及肿瘤转移灶检出均优于常规随访手段。
众所周知,癌细胞的葡萄糖代谢明显增加。在癌细胞中,18F-FDG的摄取主要通过葡萄糖转运体(glucose transporters,GLUT)转运[6]。既往研究表明,中、高分化HCC中Glut-1的表达较低(仅为4.5%),而在ICC中Glut-1的表达约为81.3%[7-8]。因此,在中、高分化HCC病灶内18F-FDG摄取较低,有时不足以表现为高代谢状态。Li等[9]报道18F-FDG PET/CT灵敏度仅为45%,但联合11C-乙酸盐可将灵敏度提升至73%。11C-乙酸盐可以提高对中、高分化HCC的检出率,但对低分化HCC18F-FDG仍具有优势。本研究中18F-FDG对HCC检出的阳性率也较Li等[8]高(67.6%vs.45%),可能与本研究低分化HCC占48.6%(18/37),较Li等[9]研究(4/22,18%)高有关。
本研究中纳入1例肝原发鳞状细胞癌(squamous cell carcinoma,SCC),其SUVmax=28.82明显高于其他细胞类型肝占位病变。Tsuneyama等[10]报道认为,SCC可能是由腺癌细胞产生的,可能与腺癌细胞具有分化成各种细胞类型的潜能。既往肺癌的研究表明,鳞状细胞癌的SUVmax显著高于腺癌[11]。
由于肝脏接受肝动脉和门静脉双重血供,血流量异常丰富,是转移性肿瘤血行传播最常见的部位。早期研究报道18F-FDG PET/CT显像对肝转移瘤较传统影像学具有优势,几乎所有的肝转移瘤对18F-FDG都有不同程度的摄取,这可能因为肝转移瘤癌细胞为非肝细胞,去磷酸化水平较低[12]。Jhaveri等[13]研究显示MRI对<1 cm的转移灶具有优越性,但其研究仅对比了MRI和CT,未与PET/CT进行对比。Sivesgaard等[14]研究显示MRI、FDG PET/CT及增强CT对肝转移瘤的灵敏度分别为85.9%、72.0%、69.1%,但其研究纳入了接受过局部治疗的患者,这可能造成PET显像的灵敏度降低。本研究中,转移瘤的阳性率为98.7%,并检出了3例CT未发现的≤1.0 cm的转移灶。
SUV在PET/CT评价恶性肿瘤中起着重要作用,但其准确性多年来仍存在争议。SUVmax是临床核医学医生最常用的临床指标,但它仅反映了一个像素值,而不能反映实际的整个肿瘤的代谢活性。因此,SUVmean、肿瘤代谢体积(metabolic tumor volume,MTV)、病灶总糖酵解(total lesion glycolysis,TLG)等指标应运而生。在既往研究中,肯定了SUVmax对ICC和肝转移瘤的诊断价值[15]。本研究中,HCC的各个代谢指标均小于ICC和转移瘤,且差异具有统计学意义(P均<0.05)。但诊断HCC的ROC曲线下面积均小于<0.5,其诊断效能欠佳。因此,18F-FDG PET显像并不被推荐用于HCC的诊断,但可为HCC分化程度判断提供参考。诊断ICC和转移瘤的ROC曲线下面积范围为0.550~0.577,具有一定的诊断效能,但SUVmax与SUVmean两指标的诊断效能差异无统计学意义(P>0.05)。
张峰等[16]研究表明无论是18F-FDG PET/CT早期显像还是延迟显像,大肝癌的SUVmax>结节性肝癌>小肝癌,本研究中也得出了类似的研究结果。本研究中Pearson相关性分析显示SUVmax与病灶的大小呈正相关(r=0.535,P<0.001)。而在37例HCC中,病灶>3 cm的有26例(70.3%),这也可以进一步用于解释本研究中HCC阳性率较既往研究高[9]。
18F-FDG为非特异性的肿瘤显像剂,感染、炎症也会有FDG的摄取。研究报道肝脓肿、肝炎性肉芽肿、内镜检查等医源性创伤都会引起PET/CT诊断的假阳性[7,15-16]。本研究中发现3例肝炎性肉芽肿、2例肝脓肿、1例肝结核和1例肝脂肪变性,均表现为18FFDG摄取异常增高的假阳性。中、高分化HCC PET显像容易出现假阴性。本研究中、高分化HCC占51.4%(19/37),且11例假阴性的HCC患者均为中、高分化。
综上所述,18F-FDG PET/CT对ICC与肝转移瘤具有较高的阳性检出率,明显高于HCC。充分认识PET/CT在肝单发占位病变中的应用优势及局限性,有利于临床科学合理地诊疗肝脏肿瘤。
