艾乐替尼治疗ALK阳性非小细胞肺癌的研究进展
2019-01-10
随着肺癌发病率和死亡率的逐年上升,针对肺癌的研究也越来越多,尤其是在靶向治疗方向,对肺癌细胞的生物学行为、基因突变的发生、类型及其演变过程,靶向药物的作用靶点及其信号通路、耐药机制等的研究成为当前的热点。表皮生长因子受体(epidermal growth factor receptor,EGFR)、ALK融合基因、c-ROS1原癌基因1(c-ros oncogene 1,ROS1)融合基因是非小细胞肺癌(non-small cell lung cancer,NSCLC)中三个较为常见的肿瘤驱动基因。其中ALK阳性约占晚期NSCLC的4%~5%,多见于年轻、不吸烟、肺腺癌患者,且几乎不与EGFR和KRAS突变共存[1-2];中国每年新发病例数约3.5万例,约占NSCLC的6%[3-4]。ALK阳性的患者接受间变性淋巴瘤激酶酪氨酸激酶抑制剂(anaplastic lymphoma kinase-tyrosine kinase inhibitors,ALK-TKIs)序贯治疗,其总生存期(overall survival,OS)可达51.5个月,甚至优于EGFR突变的晚期NSCLC患者接受EGFR-TKIs治疗的效果[5]。因此,对晚期NSCLC患者进行ALK融合基因的筛选仍具有十分重要的临床意义。克唑替尼为第一代ALK-TKI,但其仍摆脱不了所有TKI的缺陷—耐药。克唑替尼耐药的产生可能与ALK基因的二次突变、扩增、信号通路的改变及病理类型的转化有关。此外,克唑替尼透过血脑屏障的浓度很低,极易出现中枢神经系统(central nervous system,CNS)的转移,导致一线使用克唑替尼时其中位无进展生存期(median progression-free survival,mPFS)仅为10.9个月[6-9]。艾乐替尼(alectinib)是由罗氏公司研发的第二代ALK-TKI,能有效地解决克唑替尼耐药的问题,本文就艾乐替尼近期的研究进展进行详细的介绍。
1 艾乐替尼
艾乐替尼(alectinib,商品名为Alecensa)是一种新型的具有高度选择性的ALK-TKI,并通过加速审批程序于2015年12月11日获得了美国FDA的批准,用于经克唑替尼治疗后失败或因不能耐受而出现复发的ALK基因突变的晚期(转移性)NSCLC患者[10]。2018年V6版本的NCCN指南推荐对于ALK基因重排阳性的晚期转移性肺癌首选艾乐替尼(Ⅰ类证据)。
艾乐替尼是一种苯并芘咔唑衍生物,分子结构如图1。其分子结构决定了它能与ALK基因的激酶区很好的结合,从而保证其对ALK的高度选择性及抑制性,其半抑制浓度(IC50)为1.9 nM。体外研究[11]发现艾乐替尼可抑制ALK的自磷酸化及ALK介导的下游信号通路中信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)蛋白在Tyr705位点的磷酸化,能降低具有ALK蛋白融合、增殖或激活突变能力的细胞株的存活率,其主要代谢产物M4具有和它类似的活性。此外,多项研究[12-14]表明艾乐替尼非P-糖蛋白(一个位于血脑屏障的关键性外排转运蛋白)的作用底物,其具有较好的CNS穿透性,在脑脊液中有较高的浓度,对ALK阳性的肺癌细胞的抑制效应是克唑替尼的5倍;且对大多数经克唑替尼治疗后产生的获得性耐药突变有效,包括L1196M、R1275Q、C1156Y、F1174L等,但对V1180L、G1202R、I1171T等无效[15]。
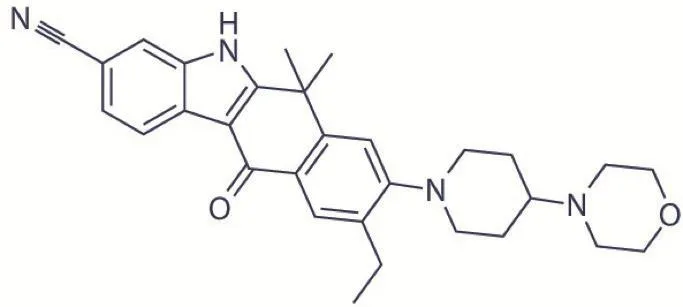
图1 艾乐替尼分子结构示意图
2 艾乐替尼的Ⅰ/Ⅱ期临床试验
AF-001JP[16]是一项在日本进行的单臂、多中心、开放式Ⅰ/Ⅱ期临床研究,主要纳入的是既往接受过至少一种化疗方案后疾病进展且未接受过ALKTKIs治疗的ALK阳性NSCLC患者,共计70例患者(24例进入Ⅰ期,46例进入Ⅱ期)。Ⅰ期的24例患者分别给予艾乐替尼20~300 mg bid,在进行其有效性和安全性观察中发现,给予最大剂量300mg时无剂量限制性毒性(dose-limiting toxicity,DLT)发生。Ⅱ期临床试验中推荐艾乐替尼300 mg bid的给药方案。数据显示:Ⅱ期临床试验的客观缓解率(objective response rate,ORR)为93.5%[43/46,其中2例为完全缓解(complete response,CR),41例为部分缓解(partial response,PR)],mPFS≥29个月。常见的不良反应是疲劳、水肿、便秘和肌肉疼痛。26%(12/46)的患者发生了3级不良反应,包括中性粒细胞的减少、ALT升高、磷酸激酶的升高。其3年的PFS为62%,OS为78%[17]。
AF-002JG[13]是一项在美国进行的单臂、多中心、开放式Ⅰ/Ⅱ期临床试验,共纳入了47例对克唑替尼不耐受或产生耐药的ALK阳性NSCLC患者。Ⅰ期分别给予受试者艾乐替尼300 mg(7例)、460 mg(7例)、600 mg(13例)、760 mg(7例)、900 mg(13例)bid进行试验。数据显示ORR为55%(1例为CR,9例为PR,9例为未证实的PR),16例为稳定(stable disease,SD),其余4例疾病进展(progressive disease,PD)。对21例有基线脑转移的患者,其ORR为52%(6例为CR,5例为PR),8例患者为SD,其余2例患者为PD。可以看出艾乐替尼在脑转移的患者中具有较好的优势。因此,根据艾乐替尼的药代动力学、活性及耐受性确定在随后进行的Ⅱ期临床试验中给予艾乐替尼600 mg bid的治疗方案。在安全性方面,艾乐替尼的耐受性良好,最常见的不良反应是疲劳(30%,均为1~2级),肌肉痛(17%,均为1~2级)及外周水肿(15%,为1~2级,除外1例发生3级水肿)。在900 mg队列中观察到2例患者发生了DLT(分别是3级头痛和3级中性粒细胞减少),3例患者因4级不良事件退出研究(分别为急性肾衰竭、胸腔、心包腔积液及脑转移)。基于此,美国FDA授予艾乐替尼获得快速审批通道。
有研究表明[18]予艾乐替尼或色瑞替尼治疗22例经克唑替尼治疗失败的患者,其ORR为86.4%,mPFS为7个月。Shaw等[19]在北美开展的单臂Ⅱ期临床试验(NP28761)共入组87例ⅢB/Ⅳ期受试者,给予艾乐替尼600 mg bid。数据显示ORR为48%,中位缓解持续时间(median duration of response,mDOR)为13.5个月,mPFS为8.1个月。所有受试者中有16例伴随可测量的脑转移病灶,25%达CR,50%达PR,颅内病灶mDOR为11.1个月,该试验最终OS为27.9个月[20]。再次证明了艾乐替尼在脑转移患者中疗效确切。不良反应和前两项研究类似,可见艾乐替尼安全性较好。
此外,在全球范围内也开展了一项单臂Ⅱ期临床试验[14](NP28673),艾乐替尼同样显示出良好的疗效。其ORR为49.2%。基线存在可测量脑转移病灶患者的ORR为55.9%,该研究最终OS为29.2个月[20],且其耐受性较好。基于此,美国FDA于2015年12月11日批准艾乐替尼可用于经克唑替尼治疗后失败的ALK阳性转移性NSCLC患者。
3 艾乐替尼的Ⅲ期临床试验
J-ALEX[21]是一项在日本开展的随机、多中心、开放式Ⅲ期临床试验,是第一个“头对头”比较艾乐替尼和克唑替尼治疗ALK阳性晚期NSCLC的研究。共纳入207例受试者,均未使用过ALK-TKIs,未接受过化疗或只接受过一种化疗方案。104例接受克唑替尼250 mg bid;103例接受艾乐替尼300 mg bid。结果显示:艾乐替尼组的mPFS≥20.3个月,ORR为91%(2%CR+89%PR);而克唑替尼组的mPFS为10.2个月,ORR为79%(2%CR+77%PR)。且艾乐替尼的安全性(3~4级不良反应的发生率)明显优于克唑替尼组(26%vs.52%)。艾乐替尼组常见的不良反应有便秘(35%)、鼻咽炎(20.4%)、转氨酶升高(19.4%)、味觉障碍(18.4%)、恶心(10.7%)、发热(9.7%)、腹泻(8.7%)等;3~4级不良反应包括便秘、转氨酶升高、发热、食欲下降等。虽然在该研究中看到艾乐替尼大幅度地提高了ALK阳性患者的PFS,但此研究仍有其不足之处。其一,因辅料原因限制了艾乐替尼的剂量,该研究认为日本患者300 mg bid的剂量可以达到西方患者600 mg bid的血药浓度[13],限制了该研究的意义;其二,两组受试者基线特征存在轻微的不匹配,如基线是否有脑转移比例为14%vs.28%;上述因素均可能导致试验结果产生一定的偏倚。因此,JALEX研究的结果在其它地区或研究中是否可以得到相同的结论仍需进一步的验证。
ALEX研究[22]是一项在全球范围内开展的“头对头”比较艾乐替尼与克唑替尼的随机、开放式、Ⅲ期临床试验,是对J-ALEX研究的补充和验证。该研究共纳入303例既往未接受过治疗的ALK阳性晚期NSCLC患者。受试者随机接受艾乐替尼600 mg bid(152例)或克唑替尼250 mg bid(151例),主要终点为研究者评估的PFS。在中位随访时间结束时,艾乐替尼组有62/152例(41%)受试者发生了疾病的进展或死亡;而克唑替尼组为102/151例(68%)。艾乐替尼组对比克唑替尼组,12个月的无事件生存率为68.4%vs.48.7%,艾乐替尼组发生疾病进展或死亡的风险下降了53%,差异具有统计学意义[风险比(hazard ratio,HR)=0.47,P<0.001]。中位随访时间结束时,研究者评估的艾乐替尼组mPFS尚未达到,克唑替尼组为11.1个月;独立评审委员会评估的艾乐替尼组mPFS为25.7个月,对比克唑替尼组的10.4个月具有显著的优势(HR=0.50)。脑转移亚组的数据分析显示,艾乐替尼组有18例(12%)发生CNS转移,克唑替尼组为68例(45%)。1年内,艾乐替尼组累积出现CNS进展的发生率对比克唑替尼组为9.4%vs.41.4%(HR=0.16,P<0.0001),可见艾乐替尼对脑转移的患者具有较好的治疗及预防效果。研究发现试验期间仍未戒烟及ECOG评分为2分的亚组获益较小。在不良反应方面,艾乐替尼组对比克唑替尼组,发生3~5级严重不良事件的概率为41%vs.50%。除贫血、胆红素升高、体重增加、骨骼肌肉痛和光敏反应增高等不良反应发生率艾乐替尼组比克唑替尼组增高外,其余不良反应克唑替尼发生率均高于艾乐替尼组,克唑替尼组严重不良反应的发生率更高。在亚组分析[23]中,138例亚洲受试者得到的数据表明,其有效性及耐受性和全球研究的整体结果保持了高度的一致性。
在2018年的ASCO大会上,ALEX研究公布了其主要研究终点:艾乐替尼的mPFS长达34.8个月,而克唑替尼的mPFS为10.9个月;次要研究终点ORR为82.9%vs.75.5%;mDOR为33.3 mvs.11.1 m。在基线有CNS转移的患者中,艾乐替尼组和克唑替尼组的mPFS分别为27.7个月vs.7.4个月(HR=0.35);基线没有CNS转移的患者中,mPFS分别为34.8个月vs.14.7个月(HR=0.47)。安全性方面,3~5级严重不良反应发生率为44.7%vs.51.0%[24]。艾乐替尼之所以能取得如较好的疗效,主要有以下两个原因:第一,其血脑屏障通透性强,几乎是100%透过。正是由于这一保护作用,艾乐替尼组患者脑转移发生率明显减少。而在克唑替尼既往治疗研究中,三分之一的患者因为脑转移进展而治疗失败,艾乐替尼颅内进展的情况较少,因此PFS得以延长。第二,艾乐替尼的耐受性良好,毒性较小,因不良反应导致停药或者减量的患者明显减少。艾乐替尼已经实现了34.8个月的mPFS,期待其在OS上能有新的进展。
综上,可以看出艾乐替尼表现出了比克唑替尼更好的有效性及更低的不良反应发生率。且与JALEX研究相比,ALEX研究的基线特征基本匹配,其研究结果比J-ALEX研究更具有说服力。艾乐替尼在亚太地区的Ⅲ期临床试验名为ALESIA研究。该研究拟入组180余例包括中国、韩国及其他多个亚太国家和地区的ALK阳性NSCLC患者,目前入组已完成,已经进入到了随访阶段。ALEX研究中入组的中国患者较少,仅20余例。亚太地区的ALESIA研究结果是否能与ALEX研究结果保持一致,仍有待数据的完成。
4 艾乐替尼的耐药及耐药后的对策
Ou等[25-27]报道了3例患者分别产生G1202R突变、I1171S突变和I1171N突变,导致其对艾乐替尼耐药。另有研究[28]报道了1例ALK阳性患者接受艾乐替尼治疗后因转化为小细胞肺癌而产生耐药。Dong等[29]发现磷酸化ALK(p-ALK)、磷酸化EGFR(p-EGFR)、磷酸化胰岛素样生长因子1受体(p-IGF-1R)以及磷酸化人表皮生长因子受体3(p-HER-3)在H3122细胞系(对艾乐替尼和色瑞替尼均抵抗的NSCLC细胞株)中均过表达,需联合阿法替尼(一种EGFR-TKI)才能有效地克服这种耐药性。Gainor等[30]发现艾乐替尼的主要耐药机制是已知的ALK酪氨酸激酶域的二次突变(如G1202R和I1171T/N/S突变等)导致的,这些突变可能影响了艾乐替尼与肿瘤细胞的结合。但因激酶域突变导致耐药的患者,仍很大程度上会对其他的ALK抑制剂敏感,如第三代ALK TKI劳拉替尼(几乎全覆盖了艾乐替尼耐药的靶点),即使患者对艾乐替尼产生耐药,还可以选择劳拉替尼延长患者的OS。此外,劳拉替尼透过血脑屏障的能力更强。对于艾乐替尼耐药的患者,劳拉替尼将会是另一个的选择。此外,还有其它的ALKTKI正在研发中,例如entrectinib和ensartinib[31]。
当然,对于艾乐替尼耐药后续治疗药物的选择,主要还是基于耐药机制的类型。就目前的研究来看,第三代ALK-TKI劳拉替尼不仅可以克服克唑替尼的耐药突变,并在各期临床试验中显示出对中枢系统疾病转移的患者有较好的疗效[32]。研究发现劳拉替尼对ALK和大量ALK临床突变型表现出显著的细胞活性,其IC50范围为0.2 nM~77 nM;体内研究发现其有低血浆清除率,合理的半衰期,对低P-糖蛋白1介导的外排敏感性低,且生物利用度为100%[33]。一项Ⅰ/Ⅱ期临床研究[32]发现,使用劳拉替尼治疗既往未接受或至少接受过一种ALK TKI治疗失败的ALK阳性NSCLC患者,结果显示其ORR为46%,既往接受过≥2种TKIs治疗的患者其ORR为42%。既往接受过1种TKI的mPFS为13.5个月,既往接受过≥2种TKI的mPFS为9.2个月。Shaw等[34]发现1例患者在第一次做基因检测的时候是C1156Y突变,该患者对克唑替尼和二代ALK-TKIs均不敏感,但对劳拉替尼敏感。当该患者再次复发时,却发现其仅有L1198F突变,C1156Y突变消失。意味着该患者再次对克唑替尼敏感,当第三代药物无效时还可以有对第一代药物再次敏感的机会。此外,一项随机、双臂、Ⅲ期临床试验CROWN研究(NCT03052608)正在开展,旨在比较克唑替尼和劳拉替尼一线治疗ALK阳性晚期NSCLC的有效性及安全性。
新一代的ALK抑制剂层出不穷,为ALK阳性晚期NSCLC患者提供越来越多的治疗选择。目前对ALK阳性晚期NSCLC患者一线推荐艾乐替尼(首选)、色瑞替尼和克唑替尼,第三代药物劳拉替尼可能是一线ALK TKIs治疗失败后的一个“接力棒”。当ALK TKIs治疗失败后,应强烈建议患者再次进行耐药基因的检测,根据基因突变类型选择针对性的治疗方案。此外,ALK抑制剂与化疗或免疫治疗的联合使用是否会为患者带来更多益处以及新型ALK抑制剂耐药等一系列问题,仍有待基础和临床进一步深入地研究与验证。期待在精准靶向治疗原则的指导下,ALK阳性晚期NSCLC患者能够得到更高效、安全的治疗,进而更好地延长生存时间,改善生存质量。
