杨树切口处不同根序细根内源激素与氮代谢关键酶对断根的响应
2019-01-09刘方春马海林杜振宇马丙尧井大炜
刘方春,马海林*,杜振宇,马丙尧,井大炜
1. 山东省林业科学研究院,山东 济南 250014;2. 德州学院资源环境与规划学院,山东 德州 253023
杨树(Populus)是温带与北亚热带地区栽植面积最广且最为速生的阔叶树种之一(陈鸿鹰,2017)。但当杨树林分进入郁闭状态后,其地下根系便相互交织在一起使杨树变为“小老树”,并对根系生长具有明显的抑制效果(Du et al.,2012)。此时期的根系逐渐衰老,根毛脱落较快,显著降低了根系的吸收能力(Jing et al.,2017)。断根是通过改变根系生长来调控植物营养生长与生殖生长以及地上部与地下部过程的栽培方式(Du et al.,2012)。在经济林栽培中,为了适应果树矮化密植的需求,经常对苹果树(Fang et al.,2017)、冬枣树(Yang et al.,2012)、桃树(Jimenes et al.,2018)等采用断根措施对其营养生长加以控制。同时在水稻(汪强等,2004)、玉米(路笃旭等,2017)、小麦(Liu et al.,2017)等农作物的研究发现,适宜的断根强度有利于增强根系的吸收能力且增产效应显著。本研究团队在前期已运用断根措施对杨树郁闭林分开展了大量的探索研究(Du et al.,2012;Jing et al.,2017),发现适度断根有助于刺激切口处萌发大量细根,并对根际土壤微生态环境有明显的改善效果。目前众多学者已针对断根开展了广泛的研究(Fang et al.,2017;Jimenes et al.,2018;Yang et al.,2012),但关于杨树切口处不同根序细根的内源激素与氮代谢规律的研究还鲜见报道。
根系是林木从土壤环境中摄取营养资源的关键器官(Du et al.,2012;井大炜等,2017),既是产生植物激素的“源”,又是接受地上部产生的内源激素的“库”,因此根系能够调控地上部激素含量,进而在协调地上部茎叶与根系的生长发育过程中发挥十分重要的作用(杨喜田等,2011)。有研究表明(任雪菲等,2013),根系的生理功能绝大部分由细根(<2 mm)完成,且细根的生长特性与状况会直接影响植物个体的生长发育。随着研究的不断深入,愈来愈多的证据显示细根在植物形态结构与功能上存在明显的异质性,不同径级或根序的细根生理功能显著不同(邹宇星等,2018)。相关研究发现(李洪娜等,2015),外界因素对植物生长的影响首先是通过改变植物体内激素的含量而起作用,激素可作为林木生长的重要调控物质之一。同时,根系生长发育与细胞的分裂是分不开的,内源激素可能是整合细胞周期与根系发育的关键因子(He et al.,2017)。此外,林木的生长对氮素的需求量最大,而硝酸还原酶(NR)、谷氨酸合成酶(GOGAT)、谷氨酰胺合成酶(GS)与谷氨酸脱氢酶(GDH)是林木氮素代谢生理的关键酶(Liu et al.,2018;井大炜等,2016),影响整个氮代谢的循环体系,在调控氮素从林木体内的内部转移与再利用及提高氮素利用率方面发挥着十分重要的作用(Meng et al.,2018;杨贤均等,2017)。鉴于此,本研究以郁闭的欧美 I-107杨(Populus euramericana cv. ‘Neva’)为研究对象,探讨不同断根强度对杨树人工林切口处细根内源激素、氮代谢关键酶与材积生长的影响,并分析材积生长率与细根内源激素、氮代谢关键酶之间的相关性,旨在剖析切口处不同根序细根的内源激素和氮代谢关键酶与林木生长之间的内部联系,以期为明确杨树的增产提供实践依据,也为人工林的高产栽培提供科学参考。
1 材料与方法
1.1 试验地点与供试材料
试验地点设在山东省济南市北郊林场(117°00'E,36°40'N),春季干旱少雨,夏季温热多雨,年平均降雨量、气温分别为 650~700 mm、14 ℃。供试土壤为潮土,土壤速效氮、速效磷及速效钾含量分别为19.59、14.17及45.80 mg·kg-1,总有机碳含量为9.02 g·kg-1。所用化肥为林农习惯使用的尿素、过磷酸钙与硫酸钾,肥料用量为常规施肥量,相当于 N 208.15 kg·hm-2,P2O570.26 kg·hm-2与 K2O 56.75 kg·hm-2的施肥水平。杨树为5年生郁闭的I-107欧美杨,株行距4 m×3 m,南北行向,林木生长均匀,平均树高、胸径分别为(12.81±0.27) m、(12.43±0.30) cm。
1.2 试验设计
试验于2017年4月10日进行,采用随机区组设计,每个小区30株树,重复3次。试验共设4个处理,分别为:(1)未断根处理(CK);(2)6倍胸径两侧断根(6-2);(3)8倍胸径两侧断根(8-2);(4)10倍胸径两侧断根(10-2);各断根处理分别在距树干基部6倍、8倍与10倍胸径处的东西方向垂直地面向下切断侧根与须根。各断根处理的开沟深度与宽度分别为40 cm与100 cm,并将挖出来的土回填夯实(杨喜田等,2011)。日常管理与大田常规措施保持一致。
1.3 根系采样和分级
2017年11月6日,在每个小区去掉东西两侧的保护行与南北两端的边缘树,选择中间的12株树作为样树进行细根采集,重复3次。依据Guo et al.(2004)的完整土块法用铁铲挖取每株样树切口处萌发出的根系,并放置在湿纱布中以保持其活性。参照Pregitzer et al.(2002)的分级方法,将根系最末端的根尖定为1级根,两个1级根相交后的根定为2级根,以此类推;不同等级的根经处理后分别放入相应的玻璃皿中,并冷藏保存(熊德成等,2012),尽快进行内源激素与氮代谢关键酶的测定。
1.4 内源激素与氮代谢关键酶测定
内源激素测定:由根系浸提得到,采用高效液相色谱法,使用仪器为美国Agilent HP 1100 series型液相色谱仪,紫外检测波长254 nm,过C18柱(250 mm×4.6 mm),流动相为 V(甲醇)∶V(水,其中含 0.5%醋酸)=45∶55,进样量 20 μL,流速 1 mL·min-1。外标法定量(杨守军等,2009)。
氮代谢关键酶测定:参照Gangwar et al.(2011)的方法并做了部分改进来测定切口处不同根序细根的硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)与谷氨酸脱氢酶(GDH)活性。其中NR活性采用活体法,加入KNO3-磷酸缓冲溶液后真空干燥,然后吸取上清液并加入磺胺与 α-萘胺后,在 540 nm 波长比色测定,单位为μmol·g-1·h-1;GS 活性的测定是先加入缓冲液后研磨、水浴,加入显色剂后离心,在540 nm波长比色测定,单位为 μmol·g-1·h-1;GOGAT 活性的测定是分别加入α-酮戊二酸溶液、KCl溶液与Tris-HCl缓冲液后水浴,然后加入NADH、L-谷氨酰胺溶液,在 340 nm 波长比色测定,单位为 μmol·g-1·h-1;GDH活性的测定是先加入储备液、CaCl2溶液,水浴,然后加入NADH与酶液,在340 nm波长比色测定,单位为 μmol·g-1·h-1。
1.5 材积生长率的计算
在2017年4月10日与2017年11月6日分别测定所有试验林木的胸径d与树高h,并利用公式V=3.14 d2hf/4(f=0.42)计算材积;之后利用普雷斯勒公式(Jing et al.,2017)计算材积平均生长率:

式中,PV表示材积生长率(%);Vl、V2分别为间隔 n年前与 n年后测得的总材积(m3);n为两次测定的间隔年数。
1.6 统计分析
数据处理运用SPSS 23.0软件,采用One-way ANOVA(单因素方差分析法)与LSD(最小显著法)在α=0.05水平下检验不同断根处理或不同根序之间杨树切口处细根内源激素与氮代谢关键酶等指标的变化规律。图 1~4中的数据为平均值±标准差。
2 结果与分析
2.1 内源激素含量
由图1可知,随着根序的增加,杨树切口处不同根序细根的IAA含量呈逐渐降低的趋势,且各序级之间的差异均达显著水平。与CK相比,8-2处理1~5级根的IAA含量显著升高,其平均值分别较CK、6-2与10-2处理显著提高22.89%、36.04%与21.76%;6-2处理1~2级根的 IAA含量显著低于CK,而3~5级根与CK差异不显著;10-2处理1~5级根与CK差异未达显著水平。

图1 断根对杨树切口处不同根序细根内源激素含量的影响Fig. 1 Effect of root pruning on the contents of endogenous hormone in different orders of fine root in poplar incision数据为平均值±标准差(n=3),同一处理不同小写字母表示根序间差异显著(P<0.05)。下同Data is average value±standard deviation (n=3). Different lowercase letters in the same treatment mean significant difference among different root orders(P<0.05). The same as below
GA、ZT与ABA含量呈现出基本一致的变化趋势,其含量随着根序等级的增加而升高。其中GA、ZT含量在不同根序之间的差异均达显著水平,而ABA含量在1~2级根之间的差异不显著,而3~5级根之间差异达显著水平。同时可见,8-2处理1~5级根的GA和ZT含量均最高,并显著高于其他处理,其中GA的平均值相比CK、6-2与10-2处理分别高出20.74%、28.92%与17.50%;10-2处理1~5级根的GA、ZT含量与CK无显著性差异,而6-2处理1~5级根的GA、ZT含量明显低于CK。从图1还可知,6-2处理1~5级根的ABA含量最高,并显著高于其他处理;其次为CK与10-2处理,二者无显著性差异,但均显著高于8-2处理。数据分析可知,断根对杨树切口处不同根序细根的内源激素含量具有明显的影响效果,其中8-2处理能显著提高各序级细根的IAA、GA与ZT含量,并降低ABA含量。
2.2 IAA/ABA、GA/ABA和ZT/ABA
植物的生长发育不仅与激素含量有关,更重要的是激素之间的相互作用,尤其是生长促进激素与生长抑制激素之间的比例与平衡(邹晓霞等,2018)。从图2可知,随着根序等级的增加,各处理的 IAA/ABA比值呈逐渐降低的变化趋势,而GA/ABA和 ZT/ABA呈逐渐升高的趋势。同 CK相比,10-2处理1~5级根的IAA/ABA、GA/ABA和ZT/ABA比值变化较小,6-2处理 1~5级根的IAA/ABA、GA/ABA和ZT/ABA比值显著降低,而 8-2处理 1~5级根的 IAA/ABA、GA/ABA和ZT/ABA比值则明显升高,其中8-2处理不同根序细根IAA/ABA比值的平均值较CK、6-2和10-2处理显著高出 45.96%、141.85%和 46.09%。同时可见,各处理1~2级根的IAA/ABA比值最高,并显著高于GA/ABA和ZT/ABA比值;而GA/ABA比值在 3~5级根达最高值,且与 IAA/ABA、ZT/ABA比值差异达显著水平。由此可见,杨树切口处细根的IAA/ABA、GA/ABA与ZT/ABA比值在不同根序之间表现出明显的变化规律,其中断根对其有显著的作用效果。
2.3 氮代谢关键酶活性

图2 断根对杨树切口处不同根序细根内源激素平衡的影响Fig. 2 Effect of root pruning on the balance of endogenous hormone in different orders of fine root in poplar incision

图3 断根对杨树切口处不同根序细根氮代谢关键酶活性的影响Fig. 3 Effect of root pruning on key enzymes in nitrogen metabolism of different orders of fine root in poplar incision
由图3可知,随着根序的增加,杨树切口处细根的NR、GS、GOGAT与GDH活性基本呈逐渐降低的变化趋势。8-2处理 1~5级根的 NR、GS、GOGAT与GDH活性均为最高,并显著高于其他处理,其中8-2处理细根NR活性的平均值相比CK、6-2与10-2处理分别提高16.05%、32.06%与16.72%,GS活性的平均值分别提高 25.35%、49.72%与23.36%;10-2处理1~5级根的NR、GS、GOGAT与GDH活性相比CK均无显著性变化;6-2处理1~2级根的 NR、GOGAT和 GDH活性显著低于CK,而 3~5级根与 CK差异不显著,同时,6-2处理1~5级根的GS活性显著低于CK。从图3还可知,各处理1~5级根的GS/GDH比值波动范围为 3.21~4.84,均大于 1。同 CK相比,6-2处理1~2级根的GS/GDH比值显著升高,10-2处理变化较小,而 8-2处理则显著降低。此外,不同处理3~5级根的GS/GDH比值未呈现出明显的变化规律。以上分析可知,不同断根措施对杨树切口处不同根序细根氮代谢关键酶活性的作用效果存在显著差异,其中 8-2处理能显著增强切口处各序级细根的硝酸还原酶、谷氨酰胺脱氢酶、谷氨酸合成酶与谷氨酸脱氢酶活性。
2.4 材积生长率
从图4可知,不同处理材积生长率的变化规律表现为:8-2>10-2≈CK>6-2,其中8-2处理的材积生长率为58.96%,显著高于其他处理,较CK、6-2与 10-2处理分别显著高出 40.65%、64.46%与40.08%;其次是10-2与CK处理,材积生长率分别为42.09%与41.92%,两者之间无显著性差异,但较6-2处理分别显著提高17.41%和16.93%。数据分析表明,不同断根强度对杨树材积生长的影响具有明显差异,其中8-2处理相比6-2、10-2处理具有更显著的增产效应,这进一步验证了断根强度的选择发挥了决定性作用。

图4 断根对杨树材积生长率的影响Fig. 4 Effect of root pruning on volume growth rate of poplar
2.5 相关性分析
断根对杨树切口处细根内源激素、氮代谢关键酶与材积生长之间的相关关系(表 1)表明,材积生长率与 IAA、GA、ZT、IAA/ABA、GA/ABA、ZT/ABA呈极显著正相关,与NR、GS、GOGAT、GDH呈显著正相关,说明细根的生长促进型激素与生长抑制型激素是相互制约、相互平衡的,且它们之间的比例与平衡对杨树材积的生长具有显著的促进效应,同时,细根的氮代谢关键酶亦能对林木生长发挥明显的调控作用。这进一步表明杨树切口处不同根序细根的内源激素与氮代谢之间存在一定的内部联系,并以系统的方式共同调控细根的生长与功能发挥,也验证了细根内源激素之间的比例与平衡及氮代谢关键酶活性的增强有利于促进杨树林木的生长。
3 讨论
内源激素可作为信号分子在时间与空间上调控植物发育的一系列生理生化过程(聂恺宏等,2018)。树体的大小受到激素的显著控制,且与IAA、GA、CTK、ABA等激素有明显的直接关系(Lan et al.,2018)。一般认为,IAA、GA与ZT属于生长促进型激素,而 ABA属于生长抑制型激素(李洪娜等,2015)。邹晓霞等(2018)对花生(Arachis hypogaea)的研究认为,根系IAA、GA、ZT含量与根系形态特征存在显著或极显著的相关性。本试验结果显示,随着根序的增加,各处理的IAA含量呈递减的趋势,而GA、ZT与ABA含量呈递增趋势。分析其原因可能与IAA大多集中在生长旺盛的部位有关,而GA、ZT与ABA虽然主要在根尖合成(Lan et al.,2018),但由于细根的代谢周转较快且运输能力较强,从而在高级根中产生了一定的集聚效应。大量研究认为(李洪娜等,2015;邹晓霞等,2018;聂恺宏等,2018;Lan et al.,2018),内源激素对植物生长发育的调控不仅依赖于不同内源激素的含量,更重要的是依赖于内源激素之间的平衡,且是一个系统的调控过程。IAA/ABA、GA/ABA与ZT/ABA比值能反映植物的生长及休止状况,比值低表明抑制型激素 ABA占据优势,植物的生长势较弱;比值高则表征促进型激素占优势,可显著促进植物的生长势(He et al.,2017)。本研究中,随根序等级的增加,不同处理的IAA/ABA比值呈现出递减趋势,而 GA/ABA、ZT/ABA比值呈现出递增趋势,这与IAA、GA和ZT含量的变化规律相一致。
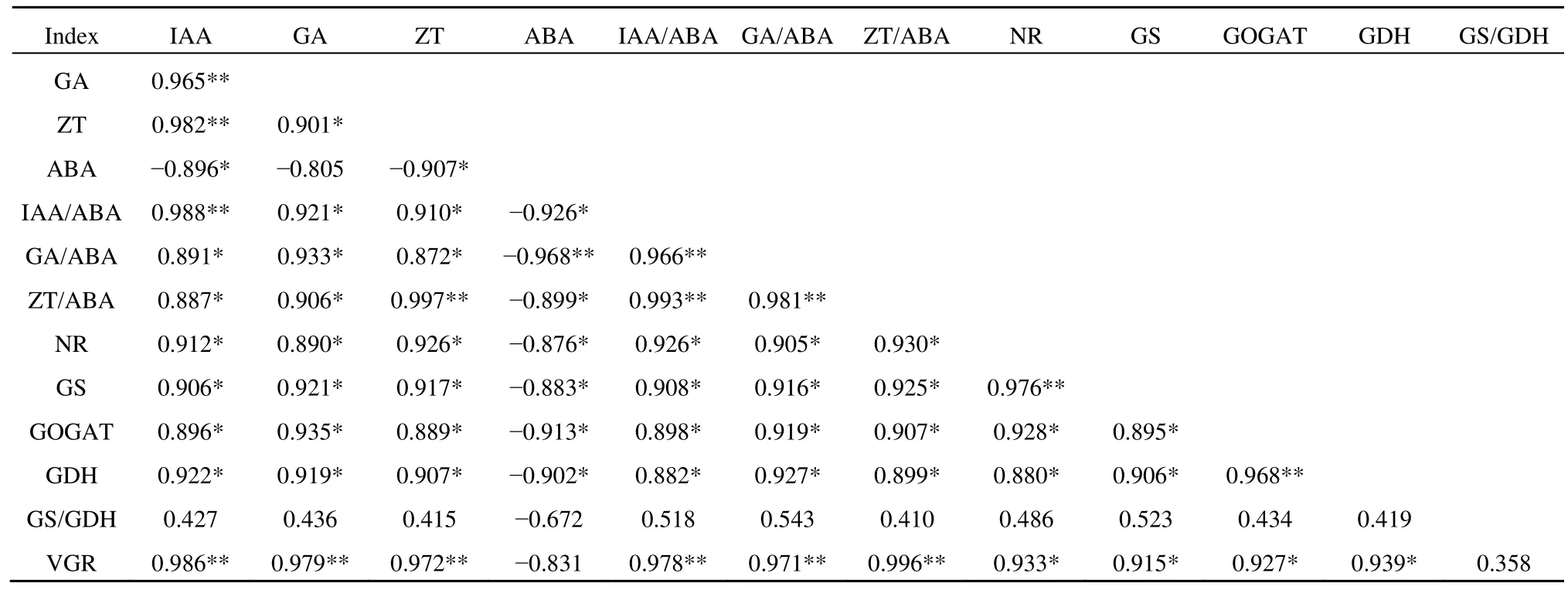
表1 杨树切口处细根的内源激素、氮代谢关键酶与材积生长的相关性分析Table 1 Correlation analysis of endogenous hormone and key enzyme in nitrogen metabolism of fine root in poplar incision, and volume growth of poplar
在断根处理中,8-2处理1~5级根的IAA、GA、ZT含量及IAA/ABA、GA/ABA、ZT/ABA比值均显著高于其他处理,可能是由于8-2处理能显著增强切口处细根的吸收能力与运输功能,促使根尖的活性增强,进而更利于刺激GA和ZT的产生,且对地上部的顶端组织亦有显著的激发效应。这表明8-2处理更利于促进切口处不同根序细根的生长势,也进一步说明8-2处理能通过改变IAA/ABA、GA/ABA与ZT/ABA的比值来调控切口处新根的生长发育。有研究认为(李洪娜等,2015),较高的内源IAA与ZT含量有助于不定根的分化,对根的生长有显著的促进作用。同时发现,8-2处理 1~5级根的ABA含量为最低值,这可能是8-2处理细根的IAA/ABA、GA/ABA与ZT/ABA比值较高的主要机理之一;也表明该处理能有效增加生长促进型激素含量,并降低生长抑制型激素含量,进而有助于根系的生长。
此外,10-2处理1~5级根的内源激素含量和对应的比值较对照无显著性变化,究其原因与 10-2处理的断根距离树干较远,断根强度较弱,致使断根对切口处的刺激作用很有限有关(Jing et al.,2017)。而 6-2处理的 IAA、GA和 ZT含量及IAA/ABA、GA/ABA与ZT/ABA比值均为最低,其原因与 6-2处理的断根对杨树自身造成的伤害较大,使切口处的恢复明显滞后(Du et al.,2012),导致萌发新根的数量较少有一定关联;同时,6-2处理的 ABA含量最高亦是引起 IAA/ABA、GA/ABA与ZT/ABA比值较低的原因之一。
以上分析可知,切口处细根的萌发与生长发育以及功能的发挥实际上是促进生根的激素与抑制生根的激素之间相互制约、相互平衡的过程,即激素是以系统的方式来调控切口处细根的形态建成与功能(陈鸿鹰,2017)。
NR是植物氮同化过程中的关键酶,能生成NH4+与不同的含氮化合物;GS与GOGAT组成的循环是高等植物氨同化的一个重要途径;而 GDH途径是植物氨同化的重要支路之一,能在缓解或解除高氨对植物毒害方面发挥特有的生理效应(张红敏等,2014)。本试验中,随根序的增加,各处理的 NR、GS、GOGAT活性呈现出递减的趋势,且1~2级根显著高于3~5级根,这表明1~2级根有助于增强氮素的同化吸收能力,这与前人针对山定子(Malus baccata Borkh.)和平邑甜茶(Malus hupehensis Rehd.)幼苗根系氮代谢酶的研究结果相类似(王英等,2010)。有研究发现(Gajewska et al.,2018),GS与GOGAT活性的同向变化可能与反应产物的正反馈调节有一定关联,说明GOGAT活性变化可能是林木对其体内GS活性变化的一种适应机制。同时,不同处理1~2级根的GDH活性显著高于3~5级根。GDH有利于TCA循环中间体氧化为α-酮戊二酸,进而调控林木体内铵同化吸收过程中的碳供应状况(井大炜等,2016)。
各处理不同根序细根的GS/GDH比值均大于1,这说明在高等植物体内,虽然 GS/GOGAT与GDH两条氮同化途径同时存在,但杨树切口处细根的氮代谢以GS/GOGAT途径为主,断根并未改变根系氮代谢途径。分析可知,6-2处理1~2根的GS/GDH比值较对照明显升高,而 8-2处理则显著降低。说明6-2处理使GDH途径在1~2级根氮代谢中的作用有所减弱,而8-2处理能增强GDH途径在细根氮代谢中的作用。可见,6-2处理可能会减弱切口处细根解除氨中毒的能力,故易发生氨中毒现象,而8-2处理则相反。此外,8-2处理1~5级根的氮代谢关键酶活性均显著高于其他处理,其原因可能与内源激素的调控有一定联系;也可能与 8-2处理能有效调节氮素的供应强度有关,可能更接近于杨树的需肥规律,进而更利于氮素的同化吸收。
许多因素会综合影响杨树的生长发育。与其他处理相比,8-2处理能明显促进杨树材积的生长,且对材积生长率的提高幅度最大。相关性分析可知,材积生长率与 IAA、GA、ZT、IAA/ABA、GA/ABA、ZT/ABA达极显著相关关系,与 NR、GS、GOGAT、GDH达显著相关关系,这表明内源激素之间的比例与平衡及氮代谢关键酶活性的增强有助于促进杨树林木的生长。陈鸿鹰(2017)采用外源酚酸对欧美杨‘I-107’扦插苗的研究亦得出了相似的结果。也有报道表明(Gu et al.,2018),氮代谢关键酶活性与土壤的供肥能力密切相关,并直接影响根系的生长与再分配。由此可知,切口处不同根序细根的内源激素含量与平衡及氮代谢关键酶活性是促使杨树增产的内在机理之一。
4 结论
8-2处理(8倍胸径两侧)处理1~5级根的IAA、GA、ZT含量及 IAA/ABA、GA/ABA和 ZT/ABA比值均显著高于对照、6-2(6倍胸径两侧)和10-2(10倍胸径两侧)处理,而ABA含量明显低于其他处理。随根序的升高,各处理细根的IAA含量和IAA/ABA比值逐渐降低,而GA、ZT、ABA含量和GA/ABA、ZT/ABA比值呈递增趋势。同时,不同处理细根的NR、GS、GOGAT和GDH活性随根序的增加而呈递减趋势;8-2处理1~5级根的这4种酶活性均显著高于其他处理,而 1~2级根的GS/GDH比值最低。此外,8-2处理的材积生长率最高,并与其他处理差异达显著水平。
综合分析认为,8倍胸径两侧的断根方式可通过调节各级细根的内源激素含量与平衡,以及增强氮代谢关键酶活性来提升切口处细根的活性,进而促进林木材积的增长。
