复合手术治疗慢性症状性颈内动脉闭塞
2019-01-09王梦宇王兵吴斐卢维龙潘锦轩许恒
王梦宇,王兵,吴斐,卢维龙,潘锦轩,许恒
(郑州大学第五附属医院 血管外科,河南 郑州 450052)
颈动脉内膜剥脱术(carotid endarterectomy,CEA)和颈动脉支架成形术(carotid artery stenting,CAS)治疗颈动脉狭窄、预防缺血性脑卒中发生的安全性和有效性已经得到广泛证实[1-2]。然而,对于慢性颈内动脉闭塞(internal carotid arteryocclusion,ICAO)长段闭塞的治疗,目前认识有限,尚缺乏统一诊疗标准。我科近期采用复合技术治疗9例慢性症状性颈内动脉长段闭塞患者,短期随访取得满意的临床效果,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年12月—2018年3月我科治疗的颈内动脉闭塞患者9例,其中男7例,女2例;年龄47~67岁,中位年龄58岁;合并2型糖尿病4例,高血压病8例,冠心病2例,长期吸烟史5例。患者其他一般资料及手术方式见表1。
所有患者均存在责任血管相关的临床症状,包括短暂性脑缺血发作(TIA)、进行性视力下降(视物模糊)、缺血性脑卒中引起的肢体活动障碍等。患者术前均接受头颈部多普勒超声、CT血管成像(CTA)或数字减影血管造影(DSA)明确病变血管闭塞范围、颅内侧支代偿情况;接受头颅CT或MRI了解颅内梗死部位及范围;接受MR灌注成像(PWI)检查,了解血流动力学指标脑血流量(cerebral blood flow,CBF)、达峰时间(time to peak,TTP)、平均通过时间(mean transit time,MTT)情况。
纳入标准:(1)影像学检查证实颈内动脉长段闭塞,闭塞段自起始段至C3破裂孔段及以上,未超过C7交通段;(2)闭塞段以远血管包括大脑中动脉无严重狭窄或闭塞;(3)存在责任血管相关的临床症状,术前改良Rankin量表(modified rankin scale,mRS)评分≤3分;(4)PWI提示存在血流动力学障碍,CBF存在不同程度下降,TTP、MTT均较正常范围或对侧延长; (5)术前经规范内科治疗仍有反复缺血症状发生;(6)排除新发脑梗死病灶(≥4周);⑺ 初发病变,病变侧血管既往未行任何血管外科手术治疗。排除标准:(1)全身情况差,不能耐受手术或麻醉;(2)存在抗血小板、抗凝治疗禁忌证或造影剂过敏;(3)存在急性颈动脉栓塞或急性血栓形成。根据Bouthillier等[3]提出的分类方法,颈内动脉解剖上分为7段:C1颈段、C2岩骨段、C3破裂孔段、C4海绵窦段、C5床段、C6眼段、C7交通段。本研究颈动脉狭窄程度依据北美症状性颈动脉内膜切除实验(North American Symptomatic Carotid Endarterectomy,NASCET)[4]标准进行测定。
1.2 治疗方式
术前口服氯吡格雷75 mg/d或阿司匹林100 mg/d,3~5 d。手术于全麻下取颈部胸锁乳突肌内侧缘斜行切口,依次游离并阻断颈总动脉、颈内动脉、颈外动脉及甲状腺上动脉,全身肝素化(0.8 mg/kg)后纵行切开颈总动脉及颈内动脉,完整剥脱颈内动脉起始段内膜及斑块。经肝素盐水反复冲洗后直视下经颈内动脉切口引入微导丝及微导管,两者配合下超选择至同侧大脑中动脉,造影明确大脑中动脉显影情况;送入交换微导丝,术前颈部彩超提示颈动脉窦部动脉粥样硬化斑块闭塞血栓延长者引入2 F/3 F Fogarty导管试行取栓;取栓后仍反流不佳者,超选择造影明确导丝位于血管真腔,引入球囊全程扩张颈内动脉颅内闭塞段;扩张由远及近进行,扩张后于存在明显狭窄、夹层处行支架植入,复查造影观察颈内动脉自起始段至大脑中动脉全程显影状况,存在限流性狭窄时行普通球囊支架内后扩张,造影证实残余狭窄≤30%时结束操作(图1)。
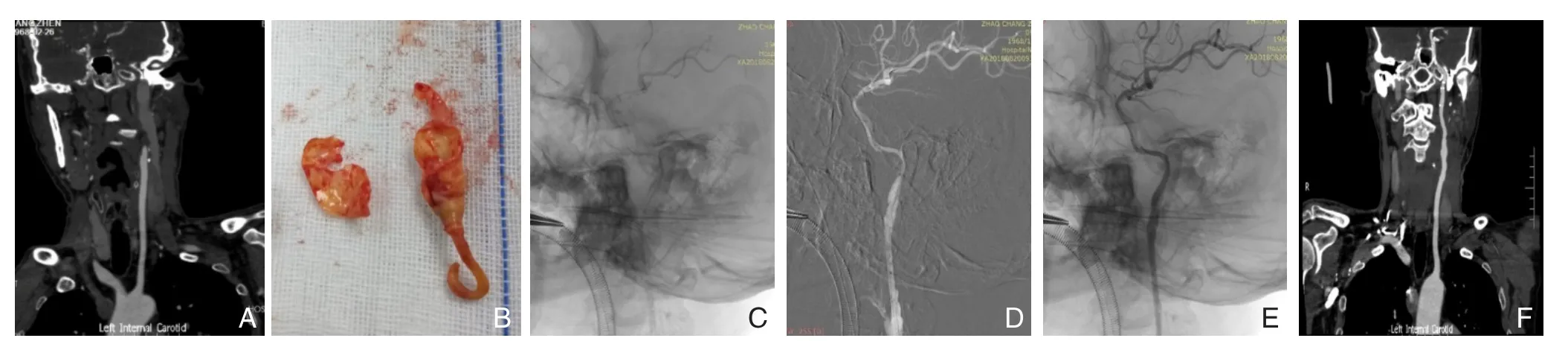
图1 复合手术开通闭塞颈内动脉 A:术前CTA示左侧颈内动脉闭塞;B:术中完整剥脱颈内动脉起始段内膜及斑块;C:术中造影示大脑中动脉显影良好;D:路径图下于局部残留重度狭窄处植入Neuroform自膨式支架3枚;E:术中造影示颈内动脉恢复通畅血流;F:术后6个月复查CTA示左侧颈内动脉通畅
1.3 术后处理
术后当日行常规抗凝治疗,低分子肝素4000 U皮下注射(12 h/次,3 d);行双抗抗血小板药物治疗(氯吡格雷75 mg/d和阿司匹林100 mg/d)6个月,后改行单抗治疗终生服用。术后严格控制血压,使收缩压≤120 mmHg(1 mmHg=0.133 kPa)或较基础血压下降20%。
1.4 观察指标及随访
技术成功标准定义为术后即刻血管造影显示闭塞血管通畅,管腔残余狭窄≤30%。再闭塞定义为术后随访影像学检查提示开通靶血管再发狭窄≥70%或血流无显影[5]。围手术期主要并发症包括术后30 d内出现的神经或心血管事件。术后密切观察患者头晕、头痛、意识变化等非特异性临床症状及肢体活动、TIA发作频数等。术后1周复查PWI,记录血流动力学指标(CBF、TTP、MTT)。术后1、3、6个月进行随访,了解患者一般状况及神经功能情况,记录mRS评分;术后3~6个月复查彩超、CTA或DSA,观察术后靶血管通畅情况;如出现神经系统症状随时复诊。
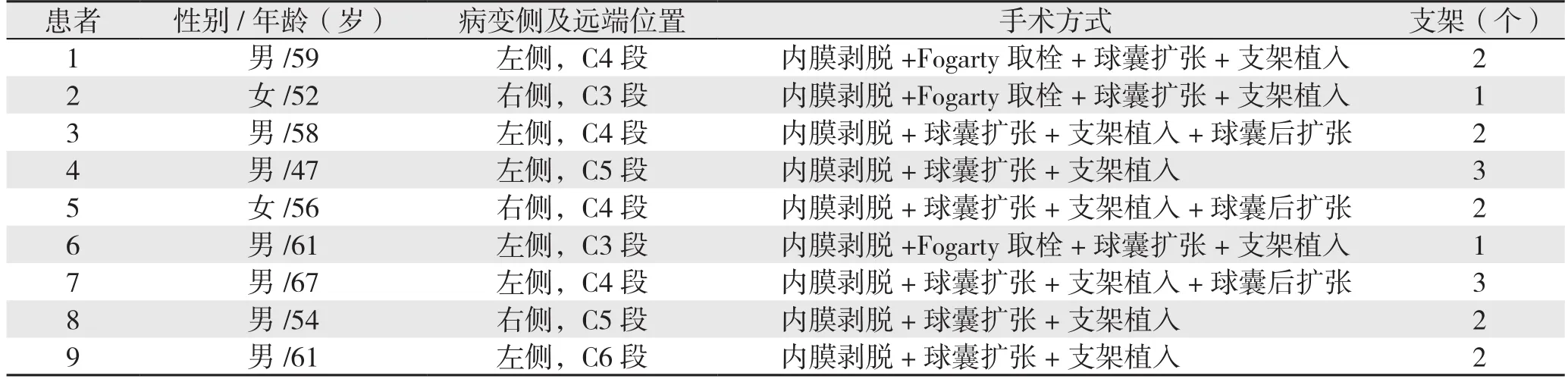
表1 9例患者一般资料及手术情况
2 结 果
2.1 手术结果
9例患者均成功开通闭塞段血管,技术成功率100%。围手术期无症状性卒中发生,无死亡患者。3例患者术中行Fogarty导管取栓,取栓后不同程度减轻闭塞段血栓负荷;9例患者中植入支架3枚者2例,2枚者5例,1枚者2例,平均植入支架2个;3例患者支架植入后行球囊后扩张;9例患者术后临床症状均有不同程度改善,TIA频次减少或消失,肢体功能好转;术后复查PWI提示血流动力学指标(CBF、TTP、MTT)均较术前均明显改善(图2)。2例患者出现高灌注表现,表现为头痛、烦躁,经控制血压、降颅压、镇静治疗后于出院前症状消失。

图2 术前、术后MR灌注成像(PWI)改善情况 A:术前左侧大脑半球达峰时间(TTP)较右侧明显延长;B:术前脑血流量(CBF)明显下降;C:术后左侧大脑半球达峰时间(TTP)与右侧相近;D:术后脑血流量(CBF)较术前明显好转
2.2 随访结果
9例患者均获得随访,随访6~13个月,中位随访时间8个月。随访期间无新发脑卒中或死亡,mRS评分结果较术前均好转,改善均≥1分(表2)。1例患者于术后6个月时TIA症状频发,复查CTA示术侧颈内动脉再发闭塞,拒绝再次手术干预,药物治疗后症状稍缓解;余8例患者临床症状均得到改善,未出现神经功能的恶化。术后3、6个月再闭塞率为0%、11.1%,提示总体通畅良好。
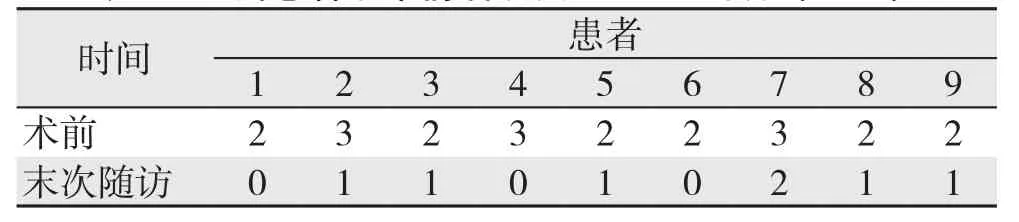
表2 9例患者手术前后改良Rankin评分(n=9)
3 讨 论
既往研究[6]表明,慢性颈内动脉闭塞患者的脑血流情况可能正常或严重受损,这取决于大脑侧支循环的改变及大脑血供的自我调节。对于脑血流储备受损、存在血流动力学障碍的患者,1年卒中风险为5%~6%[7],3年卒中发生风险可达30%[8],此类患者需要采取积极的临床干预措施。强化的药物治疗和旁路手术并不能使患者明显获益,两项著名的多中心、前瞻性研究颅内-颅外旁路试验(EC-EI)[9]和北美颈动脉调查(COSS)[10]均未证明其预防中远期脑卒中发生具有优势。两种治疗方式(旁路手术vs.药物治疗)均具有较高的卒中发生率:2年22.7%vs.21.0%,5年31.0%vs.29.0%。旁路手术未取得满意效果可能与颞浅动脉至大脑中动脉的旁路是一种低流量血运通道有关,术后血管旁路不能够提供足量的分流血量[9-11]。
近年来多个血管诊疗中心对颈内动脉长段闭塞的腔内治疗进行了可行性探索,证实了介入再通可成功恢复脑血流灌注,有助于降低中远期脑卒中发生率和改善神经认知功能[12]。但是,腔内介入再通在技术上具有挑战性,文献[13-14]报道的再通成功率一般为61%~73%,导致介入再通成功率不理想的原因主要是导丝常难以完全通过较长的闭塞段,致使部分患者术中可能出现严重并发症或由于操作难度过大而放弃开通。而基于病变的进一步研究表明,多数长段闭塞的病变起始于颈总动脉分叉处的近端,同时相较于整个闭塞段,该部位往往钙化较重。因此,导丝成功通过闭塞的起始端理论上是实现血运再通的关键所在。
复合手术可能更能代表目前的治疗趋势,复合手术最早应用于主动脉疾病的治疗[15],近年来广泛应用于下肢动脉硬化闭塞性疾病的治疗,疗效确切[16]。在长段颈内动脉闭塞病变中应用复合手术,是指首先在动脉闭塞的起始部位行颈动脉内膜剥脱术,然后通过颈总动脉将导引导管等介入器械放入手术区域,并在X线辅助下进行腔内介入操作,包括取栓、球囊扩张和支架植入等直到血运再通[17-18]。由于CEA可以消除起始部钙化较重的动脉粥样硬化斑块,使导丝很容易通过其余闭塞段,降低了后续介入再通的技术难度。Shih等[19]2013年首次报道了3例复合手术应用于颈内动脉闭塞的症状性患者,其中1例为闭塞远端位于C6眼动脉段而腔内介入治疗失败;术中均未使用脑保护装置,无并发症出现;术后脑血流灌注改善明显,随访6个月脑缺血症状均未复发。薛绛宇等[20]报道了应用复合手术治疗24例颈内动脉长节段闭塞患者,开通成功率100%,其中20例闭塞远端达C5床突段,术后3个月影像学检查提示颈内动脉通畅良好。本研究中9例患者均顺利开通长段闭塞,术后脑血流灌注改善明显,临床症状均得到缓解;术后3、6个月再闭塞率为0%、11.1%,提示总体通畅率良好。
术中血栓移位脱落、术后高灌注是慢性颈内动脉闭塞血运再通手术中常见问题。介入操作术中血栓移位脱落发生率超过50%[21],而复合手术相对安全,能够最大程度地解决此类问题的发生,因为CEA切口是开放的,脱落的陈旧血栓和碎片可经逆行血流从颈内动脉近端手术区域滤出,有效避免了远端栓塞的发生[19]。Chen等[13]报道的138例患者中主要有2例迟发性高灌注出血,高灌注出血发生机制目前尚不完全清楚,可能与远端分支血管调节功能受损有关,术后严格控制血压可能会降低高灌注风险。本组中2例(22.2%)术后出现头痛、烦躁等高灌注表现,经及时控制血压、降颅压、镇静治疗后症状消失,避免发生颅内出血等恶性进展。同时,术中应避免过度扩张开通后的颈内动脉,也有助于降低术后过度灌注的风险[22]。
长段颈内动脉闭塞的血运再通的技术成功受多种因素的影响,包括闭塞残端的形态(钝性或渐变狭窄)、神经事件发生病程、颈动脉远端代偿及重建水平等[13,23]。在单纯腔内治疗中,有学者[24]通过使用加硬导丝以提高介入开通的成功率,这可能会增加导丝进入假腔及发生血管穿孔的风险,增加假性动脉瘤、海绵窦瘘、颅内出血等严重并发症的发生率[25]。而复合手术通过近端内膜剥脱及取栓后可获得相对简便的腔内介入操作,提高了导丝通过长段病变时的操控性,降低了严重并发症的发生率,本组研究中9例患者术中、术后均未出现严重手术操作相关的不良事件。需要注意的是,由于长段闭塞的存在(≥50 mm)及闭塞血管全程通常具有广泛的个体差异性,复合手术往往操作复杂,技术要求高,目前仍须在具有丰富经验的血管诊疗中心开展。同时复合手术不可避免会增加患者的医疗负担,相对繁复的介入操作也可能导致手术时间的延长带来医护人员及患者射线辐射剂量的增加。因此,通过完善的术前评估识别出风险收益比较高的患者,对于该手术的开展至关重要。
综上所述,采用复合手术即近端颈动脉内膜剥脱术联合远端颈内动脉的血管成形术,是治疗慢性症状性颈内动脉长段闭塞的可行性替代方案,短期随访结果满意。但是本研究具有一定的局限性,由于纳入研究的样本数较少,总体技术成功率可能被高估,同时随访时间较短,再通血管的远期通畅情况尚需要进行长期随访获得,该手术的安全性和有效性仍需要更多的临床实践进行验证。
