帕金森病细胞模型中维生素C调控SIRT3影响自噬水平的研究
2019-01-09王元欣岳康异鱼洋武秀权孙季冬张磊
王元欣 岳康异 鱼洋 武秀权 孙季冬 张磊*
(1扶风县人民医院神经外科,陕西 宝鸡 722200; 2空军军医大学西京医院神经外科,陕西 西安 710032)
作为一种严重影响人类健康的神经系统变性疾病,帕金森病(Parkinson's disease, PD)的发病率越来越高,大量研究提示其发病主要与中脑黑质多巴胺能神经元代谢异常有关,但具体病理机制尚不清楚[1]。新近发现的线粒体表达分子沉默信息调节转录因子3(silent information regulator transcription3, SIRT3),在大脑等代谢活跃的组织高表达,是神经元能量代谢和线粒体功能的中心环节,在氧化应激介导的听力减退、肿瘤及衰老等起着重要的细胞保护作用[2-3],但其是否参与PD发生发展还有待研究。文献报道,维生素C(vitamin C, Vit C)参与维持细胞正常能量代谢、拮抗氧化应激、消除自由基等许多重要生理活动[4-5]。但是,有关Vit C通过何种机制、能否有效治疗PD的研究还较少见。肾上腺嗜铬细胞瘤PC12细胞株是一种交感神经系统的肿瘤,经神经生长因子诱导分化后,很接近中脑多巴胺能神经元所合成的酶类、表达的受体以及合成的神经递质[6-7]。因此,本实验利用PC12细胞系,建立1-甲基-4-苯基-四氢吡啶离子(1-methyl-4-phenyl 1, 2, 3, 6-tetrahydropyridine, MPP+)致PD体外模型[8],深入探讨Vit C通过调控SIRT3影响PD细胞模型中PC12细胞自噬的作用机制,为Vit C在PD治疗及作用机制方面研究奠定实验基础。
材料与方法
一、主要试剂和细胞株
Vit C、MPP+(Sigma公司),兔源一抗SIRT3、LC3B、β-actin(Abcam公司),鼠源一抗LC3B(武汉三鹰);山羊抗兔IgG/辣根酶标记二抗(中杉金桥);驴抗兔荧光二抗、驴抗鼠荧光二抗(Thermo公司);细胞增殖-毒性检测试剂盒(cell counting Kit-8,CCK-8)由武汉博士德生物工程有限公司提供;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自上海西唐生物科技有限公司。PC12购自中国科学院上海生命科学研究院细胞资源中心。
二、PC12细胞培养
PC12细胞经复苏、培养和扩增后,诱导其向交感神经元样细胞分化:取传五代以上PC12细胞,经消化分散后,制成5×105c/mL细胞悬液,接种于塑料培养皿中,置于培养箱内进行培养。
三、MPP+致PD体外模型的制作及分组
取形态类似于交感神经元的PC12细胞,对照组不做任何处理,Vit C组加入400 μmol/L Vit C孵育, Vit C+MPP+组加入400 μmol/L Vit C孵育6 h后加入700 μmol/L MPP+,MPP+组加入700 μmoL MPP+继续孵育48 h,体外模拟帕金森病的神经损伤。
四、CCK-8试剂盒检测细胞活力
96孔板以3 000 c/孔的密度接种PC12细胞,处理同上,每100 μL培养液中加入10 μL CCK-8溶液,在细胞培养箱37 ℃下孵育1~4 h,酶标仪法450 nm检测吸光度。
五、LDH试剂盒检测
按照说明书,酶标仪波长490 nm。以标准品2 000、1 000、500、250、125、62.5、31.2、0 U/L为横坐标,吸光度值为纵坐标,作标准曲线。取上述4组细胞培养液,根据样品吸光度值在该曲线图上查出相应LDH含量。
六、WB检测LC3-Ⅱ和SIRT3表达
接种6孔板,分组及处理同上,提取细胞总蛋白,测定蛋白浓度,聚丙烯酰胺凝胶电泳,分离蛋白后转移到硝酸纤维素膜上,和LC3B(1 ∶3 000)、SIRT3(1 ∶500)与β-actin(1 ∶3 000)抗体结合,然后与辣根过氧化物酶标记的二抗结合,压片后显色后照相。最后用Gel-Pro analyzer软件进行灰度扫描分析。以目的蛋白与β-actin的蛋白产物条带灰度值之比作为其蛋白水平的相对量。并进行扫描图像分析仪计算蛋白条带的表达[9]。
七、免疫荧光检测LC3-Ⅱ、SIRT3表达
用4%多聚甲醛固定20 min后,将爬片固定载玻片上,0.5 % tritonX-100 通透10 min,驴血清室温封闭1 h,按比例加入鼠源一抗抗体(LC3 1 ∶50)、兔源一抗抗体(SIRT3 1 ∶400),4 ℃过夜,驴抗兔荧光二抗抗体(1 ∶1 000)和驴抗鼠荧光二抗抗体(1 ∶1 000)室温孵育3 h,洗涤后,Hoechst 染料染核10 min,抗淬灭剂封片,荧光显微镜观察后拍片。
八、统计学分析
结 果
一、PC12细胞CCK-8活力检测
各组与对照组相比,细胞活力差异明显(P<0.01)。单纯Vit C组较对照组活力增加约5.88%,MPP+组细胞存活率为48.23%±0.33%,Vit C+MPP+组细胞存活率增高至63.97%±0.65%,两组间有显著统计学意义(P<0.01,图1)。

图1 各组PC12细胞活力
Fig 1 Effect of Vit C on cell viability of MPP+-treated PC12 cells
aP<0.01,vsControl group;bP<0.01,vsMPP+group.
二、PC12细胞LDH检测结果
MPP+组与Vit C+MPP+组中LDH含量差异明显(P<0.01)。而与MPP+组LDH含量比较(165.200±5.946)U/L相比,Vit C+MPP+组PC12细胞培养液中的LDH含量(130.400±6.589)U/L减少,两组间有显著统计学意义(P<0.01)。
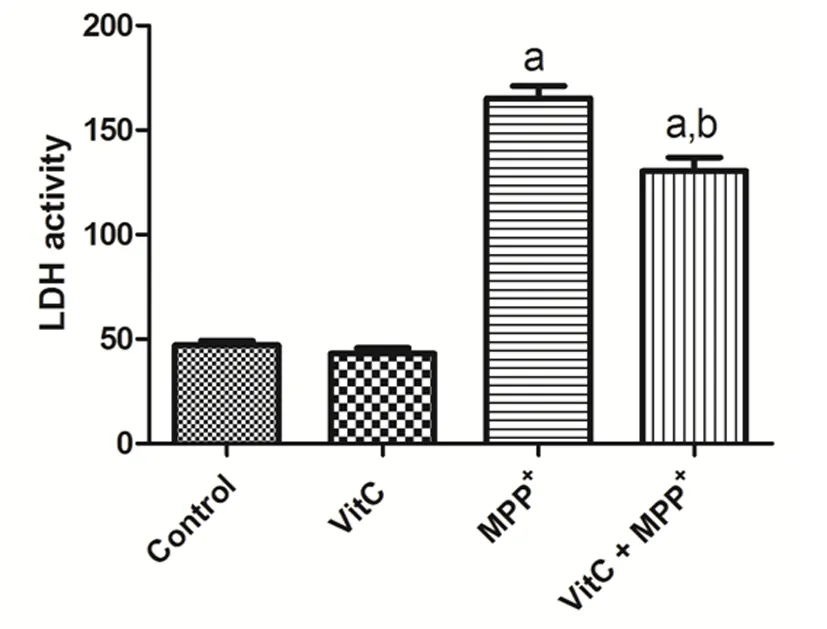
图2 各组LDH检测
Fig 2 LDH activity in each group
aP<0.01,vsControl group;bP<0.01,vsMPP+group.
三、WB检测PC12细胞LC3-Ⅱ和SIRT3表达的变化
对照组和Vit C组中LC3-Ⅱ、SIRT3少量表达,之间无统计学差异。与MPP+组比较,Vit C + MPP+组SIRT3和自噬标志分子LC3-Ⅱ表达显著升高,差异有显著统计学意义(P<0.05),见图3。
四、免疫荧光检测PC12细胞LC3-Ⅱ和SIRT3表达的结果
对照组中LC3-Ⅱ、SIRT3少量表达。与MPP+组比较,Vit C+MPP+组中中自噬相关分LC3-Ⅱ点状荧光表达增多、增强,SIRT3表达亦成斑点状、荧光强度显著增高,见图4。
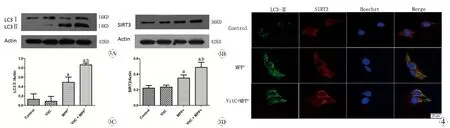
图3 Western Blot检测LC3-Ⅱ和SIRT3蛋白在各组中的表达变化
Fig 3 The expression of LC3-Ⅱand SIRT3 protein in each group detected by Western Blot
A: Statistical representation for the expression of LC3-II; B: Statistical representation for the expression of SIRT3.
aP<0.05,vsControl group;bP<0.05,vsMPP+group.
图4 荧光显微镜检测LC3-Ⅱ、SIRT3的表达(×400)
Fig 4 LC3-Ⅱand SIRT3 in of MPP+treated PC12 cell detected by immunofluorescense microscopy (×400)
讨论
最新研究发现,神经细胞的氧化应激反应和自我“清除”功能退化等多因素病因与PD的发生发展密切相关,是PD发病的核心机制。首先,Xu等[10]发现氧化应激的主要转录调节因子-Nrf2被调控线粒体自噬的DJ-1蛋白抑制,从而发挥抗氧化应激的作用;而一些对多巴胺能神经元起神经保护作用的分子,参与氧化应激反应,影响神经细胞的转归[11]。其次,在人类和动物,线粒体复合物I抑制剂可导致PD,Alvarez-Erviti等发现PD患者的黑质和杏仁核线粒体自噬功能有缺陷或退化[12]。而过度的线粒体应激或PINK1/2基因突变患者容易发生线粒体损伤累积,导致氧化应激和毒素累积损伤增加,引起多巴胺能神经元死亡继而引发PD[13]。综上所述,氧化应激反应和线粒体自噬在PD的发病机制中发挥重要作用,但具体分子病理机制仍不明确。
SIRT3主要位于线粒体,在大脑等代谢活跃的组织高表达,是神经元能量代谢和线粒体功能的中心环节[14]。本研究中,Vit C在上调SIRT3的同时,也影响自噬相关分子LC3-Ⅱ的表达,增加PC12细胞自噬的发生,提示SIRT3和LC3-Ⅱ在表达上存在正相关,但具体作用机制还有待更深入研究。
Vit C是一种广谱抗氧化物,Engelhart等[15]通过大样本调查,发现Vit C可以显著减低痴呆症的患病率,但其具体机制甚不明了。后来Berzina[16]等发现,Vit C可拮抗炎症反应,还能维持氧化和抗氧化系统的平衡,从而发挥治疗鸡肠膜炎作用。而本研究的CCK-8细胞活力检测和LDH含量检测结果发现,Vit C可以增强细胞自身活力,显著降低LDH漏出率,且具有较好的减轻损伤,保护PC12细胞的作用。Western-Blot检测LC3-Ⅱ的结果提示我们MPP+损伤可激活细胞自噬水平,但PC12细胞死亡增加,提示MPP+可能通过另外信号通路损伤神经细胞,而其激活的细胞自噬等功能活动不足以阻止其损伤作用,从而造成神经细胞的损伤,而加入Vit C后,进一步提高PC12细胞的自噬水平,达到清除损伤因素,发挥保护细胞维持正常生理功能,拮抗PD的神经损伤;深入研究发现,Vit C亦可能通过显著增加SIRT3表达,减轻MPP+损伤后的氧化应激反应。而免疫荧光结果显示,在MPP+损伤后SIRT3和LC3-ⅡC存在共定位,Vit C可以显著提高两者表达。鉴于SIRT3在PD模型中有保护神经元的作用[17],而Vit C可以激活SIRT3和提高细胞自噬水平,抑制细胞损伤,表明两者在拮抗PD的病理生理过程中发挥重要保护作用。在下一步实验中,我们将通过慢病毒转染上调和下调SIRT3表达,以期阐明VitC如何通过调控SIRT3影响细胞自噬水平的分子信号机制。
