尿对羟基苯丙氨酸和血清胃蛋白酶原检测对胃癌的诊断价值
2019-01-08王兴昌李应宏李庆科孙丽琴韩荣花杨婷仲菊年
王兴昌 李应宏 李庆科 孙丽琴 韩荣花 杨婷 仲菊年
恶性肿瘤的发病率和病死率均位居我国疾病首位,且发病率呈上升趋势。据流行病学资料显示,武威市属于胃癌高发区[1]。因此,胃癌的早发现、早诊断、早治疗,无论对个人、对家庭、对社会都有非常重要的意义。本研究对胃癌患者进行尿液对羟基苯丙氨酸(酪氨酸)和血清胃蛋白酶原(pepsinogen,PG)检测,结果显示均具有较高的敏感度和特异度,可以应用于胃癌的筛查,现报告如下。
1 资料与方法
1.1 研究对象 选取2015年1月—2018年12月甘肃省武威肿瘤医院收治的1 500例胃癌患者作为研究对象。
1.1.1 纳入标准 ① 年龄20~75岁;② 所有患者均经过影像学检查和病理诊断确诊;③ 预期生存期>3个月。
1.1.2 排除标准 ① 年龄<20岁,>75岁;② 孕妇和哺乳期妇女;③ 经期及经期前后3天;④ 黄疸患者尿液样本;⑤ 尿液样本呈红色、绿色、灰绿色者;⑥ 服用镇静类、止痛类、降压类、氨基酸、激素类药品;⑦ 服用神经系统兴奋剂、抗菌素、保健品以及高蛋白食物;⑧ 酒后、激烈运动、创伤、出血。
1.1.3 伦理学 本研究内容均符合医学伦理学的标准,经医院伦理委员会批准(审批号:2018-12)。所有患者了解知情同意书相关要求,签署知情同意书。
1.2 分组 按照就诊顺序随机分为对羟基苯丙氨酸组、PG组和联合检测组,每组各500例。对羟基苯丙氨酸组采用尿液对羟基苯丙氨酸单独检测,PG组采用血清PG单独检测,联合检测组采用尿液对羟基苯丙氨酸和血清PG联合检测。
1.3 检测方法
1.3.1 标本的采集 采用符合要求的一次性留样容器留取对羟基苯丙氨酸组患者的新鲜晨尿样本备检,所有检测均在尿液样本留取后2 h内完成;抽取PG组患者空腹静脉血3 mL,4 000 r/min离心4 min(离心半径15 cm),分离血清,-20 ℃保存,备用。
1.3.2 尿液对羟基苯丙氨酸检测 采用“预检一号”进行检测,该试剂均为江西华裕康生物科技有限公司提供的“预检一号”试剂,即对羟基苯丙氨酸(酪氨酸)尿液检测试剂(URC,生产许可证号:赣食药监械生产许20100025)进行检测。检测时实验室温度以20 ℃左右为宜,将患者新鲜清洁晨尿3 mL加入含0.53 mL URC的安剖实验瓶中,将新鲜清洁晨尿与URC充分混匀之后静置3~5 min,观察沉淀物的颜色并与标准色板对照判定结果。
1.3.3 血清PG检测 采用日立7600型全自动生化分析仪检测PG水平。检测时按照PGⅠ、PGⅡ试剂盒、临床血清肿瘤相关物质检测试剂盒要求操作,计算测定值。
1.3.4 判断标准 尿液对羟基苯丙氨酸检测采用对照标准色板,沉淀物的颜色与标准色板对照,1~3为阴性(-),4~5为弱阳性(±),6~8为阳性(+),9的颜色为干扰色(有黄疸干扰不做判断)[2]。血清PG检测则根据试剂提供及日本三木[3]报道的标准加以分级,阴性:PGⅠ>70 μg/L或PGⅠ/Ⅱ比值>3;轻度阳性:PGⅠ≤70 μg/L且PGⅠ/Ⅱ比值≤3;中度阳性:PGⅠ≤50 μg/L且PGⅠ/Ⅱ比值≤2.5;重度阳性:PGⅠ≤30 μg/L且PGⅠ/Ⅱ比值≤2.0。两种检测方法均显示阳性者为联合检测阳性。
1.4 统计学方法 采用SPSS 20.0软件处理数据,正态分布资料以均数±标准差(±s)表示,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 对羟基苯丙氨酸组男性310例,女性190例;年龄25~70岁,平均(43.5±25.2)岁。PG组男性313例,女性187例;年龄26~71岁,平均(44.1±25.2)岁。联合检测组男性312例,女性188例,年龄24~69岁,平均(42.6±26.3)岁。3组在年龄、性别等方面比较差异均无统计学意义(均P>0.05),具有可比性。
2.2 3组患者的检测阳性率比较 与对羟基苯丙氨酸组和PG组比较,联合检测组的阳性率明显升高(P<0.05);对羟基苯丙氨酸组和PG组的阳性率比较,差异无统计学意义(P>0.05)。见表1。
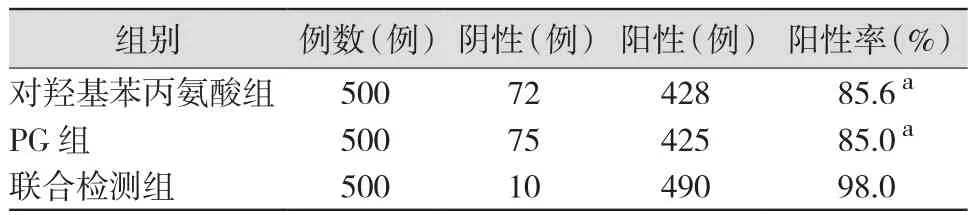
表1 3组患者的检测阳性率比较
2.3 3组患者的敏感度、特异度比较 联合检测组的特异度明显高于对羟基苯丙氨酸组和PG组,敏感度无明显差异。见表2。

表2 3种检测方法对胃癌的诊断价值
3 讨论
恶性肿瘤是目前国内病死率最高的疾病,其中消化道肿瘤占恶性肿瘤的50%左右[4]。常见的消化道恶性肿瘤有胃癌、肝癌、食管癌、胰腺癌、大肠癌,其中胃癌、肝癌在我国发病率较高,胰腺癌、大肠癌近年来发病率呈逐渐上升趋势。现代医学研究发现,消化道肿瘤的早期发现可大大提高早期消化道肿瘤的治愈率,减少病死率[5]。但是胃癌患者往往在早期没有特别典型的症状或症状轻微,故未引起重视,而耽误了早期发现和中期治疗,导致最佳治疗时机的丧失[6]。因此,研究如何早期发现及早期诊断消化道肿瘤,特别是早期胃癌显得尤为重要。随着肿瘤分子生物学的深入研究,血液和体液中游离的核酸DNA定量分析已开始大量应用于消化道等肿瘤的早期血液和体液的分子学诊断、肿瘤的个体化治疗和肿瘤的预后判断等,但因检测技术的高要求、不能大规模普及以及经济成本高等方面的原因,还无法应用于大规模恶性肿瘤筛查,尤其是胃癌的早期筛查[7]。目前临床上主要采用染色内镜法对胃癌患者进行检查,但是对胃癌早期患者的诊断率不高,极有可能出现漏诊的情况,从而耽误患者的治疗[8]。因此,发现一种操作易行、取材方便、可用于早期发现及诊断胃癌的检测手段是非常重要的[9]。
恶性肿瘤患者体内常出现氨基酸代谢异常的现象,即蛋白质分解成为氨基酸的转化过程增强,从而导致氨基酸的分解代谢随之减弱,这样就使大量氨基酸重新用于肿瘤细胞蛋白质的合成,同时多余而无法被利用的氨基酸就随之排出体外,在血液和体液中存在大量没有被利用的氨基酸。氨基酸异常代谢在肿瘤的发生早期就已经存在,一个突出的表现就是对羟基苯丙氨酸(酪氨酸)在尿液中的含量明显升高[10]。体内肿瘤细胞异常代谢越活跃,随之体内氨基酸异常代谢越显著,同时导致酪氨酸在血液和体液中的含量升高现象更加明显。根据大量的研究发现,大多数癌症患者的尿液中酪氨酸含量均会升高0.5~1.5倍[11]。URC主要用于对羟基苯丙氨酸在尿液中含量的定性检测,从而判断体内癌细胞代谢的活跃程度,进而对恶性肿瘤特别是胃癌早期进行风险评估。URC具有留取新鲜尿液样本方便、无创伤、成本低、实验操作简单、检测实验结果快速准确等特点,该实验敏感度和特异度高,因此临床上常常将尿液对羟基苯丙氨酸检测应用于恶性肿瘤特别是早期胃癌的筛查和诊断。
人体内表达两种同工酶PGⅠ和PGⅡ,PGⅠ由胃底部腺体产生,而全部胃黏膜都可分泌PGⅡ。PGⅠ由胃的主细胞合成,通常以无活性的酶原颗粒的形式贮存于细胞内。一旦细胞内充满酶原颗粒,它就会对新的酶原产生负反馈的作用。在胃酸作用下分泌入胃腔内的PG,由于小分子多肽的存在,使胃蛋白酶具有活性,被激活的胃蛋白酶同时可以激活PG。胃蛋白酶能够水解蛋白质,而蛋白质及多肽分子中存在苯丙氨酸或酪氨酸的肽键,其分解产物主要为胨,分解后产生的多肽或氨基酸数量较少。胃蛋白酶只有在强酸环境中才可以发挥生物学作用,反应最适pH为2。随着pH值的升高,使得胃蛋白酶的活性随之降低;当pH>6时,胃蛋白酶随即发生变性反应,而此时的变性反应不可逆。血清PG水平的高低反映了胃黏膜不同部位的形态特点和功能情况:胃泌酸腺细胞功能检测通常通过PGⅠ的检测表达,所以PGⅠ是胃泌酸腺细胞功能的指针;分泌的胃酸增多导致pH下降,胃液酸性增强使得PGⅠ升高,胃黏膜腺体的萎缩和分泌减少使得PGⅠ降低;胃底黏膜的病变与PGⅡ的相关性较大(相对于胃窦黏膜的变化),血清PGⅡ水平的升高与胃上皮化生、胃底腺管萎缩、异型增殖和假幽门腺化生有关;血清PGⅠ/Ⅱ比值的进行性降低同胃黏膜萎缩的进展相关[12]。因此,联合检测血清PGⅠ与血清PGⅡ,其比值对胃底腺黏膜的病变具有“血清学活检”早期胃癌标志物的作用[13]。日本从20世纪90年代开始将血清PG测定用于人群普查,以PG检测和造影联合筛查,胃癌检出率为0.28%,高于单纯造影筛查(0.10%),并且88.0%为早期胃癌。血清PG检测用于胃癌初筛具有敏感性高、易于接受、成本低等优势,适用于大面积人群普查,对于提高胃癌早期诊断率具有重要意义。
本研究显示,联合检测组的阳性率(98.0%)明显高于对羟基苯丙氨酸组(85.6%)和PG组(85.0%),提示尿液对羟基苯丙氨酸和血清PG检测对胃癌的诊断具有较高的价值,两者联合检测可进一步提高胃癌的诊断率;3组的敏感度比较差异均无统计学意义,提示尿液对羟基苯丙氨酸和血清PG检测对胃癌的诊断均具有较高的敏感度,但两者联合检测并未明显提高胃癌诊断的敏感度;联合检测组的特异度(95.6%)明显高于对羟基苯丙氨酸组(86.1%)和PG组(85.7%),提示尿液对羟基苯丙氨酸和血清PG检测对胃癌的诊断具有较高的特异度,两者联合检测可进一步提高胃癌诊断的特异度。本研究结果与文献[3,6,9-13]报道的结果基本一致。
综上所述,尿液对羟基苯丙氨酸和血清PG检测均可作为胃癌的诊断和筛查手段,两者联合检测可进一步提高胃癌诊断的阳性率和特异度。该方法具有较好的推广和应用价值。
