不同真菌固体发酵对蕨菜主要活性成分及其体外抗氧化和抗炎症作用的影响
2019-01-07吴永祥吴丽萍胡晓倩金泰完
吴永祥,吴丽萍,胡晓倩,金泰完*
(1.黄山学院生命与环境科学学院,安徽 黄山 245041;2.安东国立大学食品科学与生物技术学院,韩国 庆尚北道 安东 760749)
蕨菜(Pteridium aquilinum (Linn.) Kuhn var.latiusculum (Desv.) Underw.)又称拳头菜、龙爪菜、蕨儿菜、如意菜等,属凤尾蕨科多年生的草本植物。蕨菜广泛分布于我国东北、西北、华北、西南等,蕴藏量丰富,营养价值高,是我国优质的绿色天然健康食品,被誉为“山菜之王”。蕨菜作为药食两用植物,有很高的药用价值,有清热解毒、消肿、利水、安神、润肠通便等功效,可用于治疗高血压、糖尿病、风湿性关节炎等症状[1-2]。现代药理研究表明:蕨菜含有多糖[3]、多酚类[4]、黄酮类[5-6]、萜类[7]等多种生物活性物质,具有抑菌[8]、抗氧化[9-10]、降血脂[11]、抗肿瘤[11]及增强机体免疫[12]等功效。
真菌固体发酵是指以药(食)用真菌为发酵菌株,以具有活性成分的植物原料为药用基质,在双向发酵过程中,药用基质为真菌生长提供所需营养,真菌对药用基质进行分解与再合成,从而产生新的功效成分,提高药效[13-14]。目前已有多篇文献利用木蹄层孔菌、灵芝和裂褶菌3 种功能真菌进行固体发酵的报道:Son等[15]以灵芝菌株对茵陈蒿叶进行固体发酵,有效提高了活性成分,显著增强了其抗炎症作用;Kim等[16]利用灵芝菌株对人参进行固体发酵,显著提升了人参的免疫调节作用;Neifar等[17]利用木蹄层孔菌对橄榄油饼进行了固体发酵,使油饼中纤维素含量降低、蛋白质含量提高,从而大大提高了油饼的营养价值;邬建国等[18]利用裂褶菌对葛根渣进行固体发酵,异黄酮含量提升了70%以上。由此可见,利用3 种功能真菌进行固体发酵,不仅可以改善食品风味、增强营养价值,而且可能会提高活性成分含量或产生新的功效成分,从而提高药效。然而,目前尚鲜有关于蕨菜发酵工艺的研究,本实验以药食同源的蕨菜为药用基质,采用木蹄层孔菌、灵芝和裂褶菌进行固体发酵,对发酵前后蕨菜的主要活性物质总酚、总黄酮含量进行测定,对其抗氧化和抗炎症作用进行比较,以探讨真菌固体发酵对蕨菜活性成分及药理作用的影响,以期为蕨菜进一步的开发利用提供科学依据,并作为一个例证,为3 种真菌固体发酵在食品加工中应用提供新思路。
1 材料与方法
1.1 材料与试剂
蕨菜,2015年5月于安徽省黄山市采集;木蹄层孔菌、灵芝和裂褶菌 韩国微生物培养中心;RAW264.7细胞株 美国模式培养物集存库。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、VC、丹宁酸、Folin-Ciocalteu试剂、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、脂多糖(lipopolysaccharides,LPS)、Griess试剂美国Sigma公司;Dulbecco’s modified eagle medium(DMEM)培养液、胰蛋白酶、胎牛血清及其他细胞培养试剂 美国Gibco公司。
1.2 仪器与设备
SpectraMax-190型全波长酶标仪 美国Molecular Devices公司;EV341型旋转蒸发仪 北京莱伯泰科仪器有限公司;CP-ST50A 型CO2培养箱 长沙长锦科技有限公司;DL-CJ-1N型超净工作台 北京东联哈尔仪器制造有限公司;IX51型倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 菌种活化和菌悬液的制备
将保藏的木蹄层孔菌、灵芝和裂褶菌分别接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)斜面培养基上,于25 ℃恒温培养箱中培养7 d后再转接于PDA平板培养基上。待菌种长满平板后,在无菌操作台内用打孔器(d=6 mm)打取已活化好的菌种接种到PDA液体培养基中,于25 ℃、180 r/min摇瓶培养7 d。培养后,10 000 r/min高速搅拌10 s,即得到均匀的菌悬液[13,19]。
1.3.2 真菌固体发酵蕨菜
将蕨菜洗净晾干并切成均匀条状,于60 ℃烘干,加水混合,使其充分吸收水分,再进行高压湿热灭菌。在超净工作台上取灭菌后的蕨菜于培养皿中,分别接种5%的木蹄层孔菌、灵芝和裂褶菌的菌悬液,于25 ℃培养箱中培养7 d。
1.3.3 固体发酵前后蕨菜醇提物的制备
将固体发酵前后的蕨菜冷冻干燥,粉碎过40 目筛,得蕨菜粉末。称取蕨菜粉末50.0 g,10 倍体积分数70%乙醇溶液振荡提取3 次,每次4 h。提取液过滤后合并,减压浓缩后真空干燥成粉末,即得固体发酵前后的蕨菜醇提物。按式(1)计算各醇提物提取率:

式中:T为各醇提物提取率/%;MS为各提取物浓缩干燥后的质量/g;M0为各原料的质量,50.0 g。
1.3.4 总酚含量的测定
总酚含量的测定参考Folin-Ciocalteu法[20-21]并修改如下:取50 μL固体发酵前后的蕨菜醇提物和50 μL Folin-Ciocalteu试剂(0.25 mol/L),充分摇匀,静置3 min后加入1.0 mL 0.7 mol/L的Na2CO3溶液,室温静置1 h显色,于波长750 nm处测定吸光度。同时Folin-Ciocalteu试剂换成去离子水作为样品空白对照组。按同法用单宁酸标准品作质量浓度-吸光度的标准曲线:Y=0.002X-0.005(R2=0.997),其中总酚含量以醇提物中单宁酸当量计(mg/g)。
1.3.5 总黄酮含量的测定
总黄酮含量的测定参考铝盐显色法[22]并略作改动。取300 μL固体发酵前后的蕨菜醇提物和300 μL 2% AlCl3试剂,充分混合,室温静置1 h显色,于波长420 nm处测定吸光度。同时AlCl3试剂换成无水乙醇作为样品空白对照组。按同法用槲皮素标准品作质量浓度-吸光度的标准曲线:Y=0.009X+0.020(R2=0.995),其中总黄酮含量以醇提物中槲皮素当量计(mg/g)。
1.3.6 清除DPPH自由基能力的测定
参考文献[23]略作改动,取100 μL不同质量浓度固体发酵前后的蕨菜醇提物(0.0、0.5、1.0、2.0、5.0 mg/mL),分别加入50 μL 0.2 mmol/L DPPH-乙醇溶液,混匀,避光反应10 min,于517 nm波长处测定样品组吸光度。以VC为阳性对照,每样重复3 次,取平均值,并按式(2)计算DPPH自由基清除率:
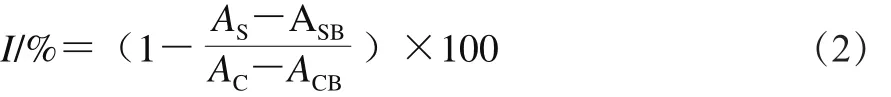
式中:I为DPPH自由基清除率/%;AS为样品组吸光度;ASB为100 μL醇提物与50 μL 99.9%乙醇溶液的吸光度;AC为100 μL 70%乙醇与50 μL DPPH溶液的吸光度;ACB为100 μL 70%乙醇与50 μL 99.9%乙醇溶液的吸光度。
1.3.7 清除ABTS+·能力的测定
参考文献[24]的方法,配制ABTS混合溶液,由7 mmol/L的ABTS溶液和2.45 mmol/L过硫酸钾溶液避光反应16 h。取50 μL不同质量浓度固体发酵前后的蕨菜醇提物(0.0、0.5、1.0、2.0、5.0 mg/mL),分别加入100 μL ABTS混合溶液,混匀,避光反应5 min,于734 nm波长处测定样品组吸光度。以VC为阳性对照,每样重复3 次,取平均值,并按式(3)计算ABTS+·清除率:
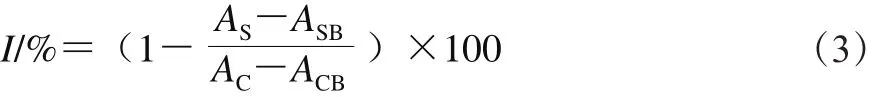
式中:I为ABTS+·清除率/%;AS为样品组吸光度;ASB为50 μL醇提物与100 μL 99.9%乙醇溶液的吸光度;AC为50 μL 70%乙醇溶液与100 μL ABTS溶液的吸光度;ACB为50 μL 70%乙醇溶液与100 μL 99.9%乙醇溶液的吸光度。
1.3.8 RAW264.7细胞的培养与传代
以含10%的胎牛血清作为基础培养基,将RAW264.7细胞置于37 ℃、5% CO2且相对饱和湿度的培养箱中培养,根据细胞生长的情况,2 d换液1次。待细胞生长至80%时,用细胞刮将细胞刮下,离心后吹打分离细胞,进行传代培养。
1.3.9 MTT法检测RAW264.7细胞的活性
取对数生长期的RAW264.7细胞,以1×105个/mL接种于96 孔板中,每孔100 μL。待细胞完全贴壁良好后(约24 h),更换含不同质量浓度固体发酵前后蕨菜醇提物(0.0、0.05、0.1、0.2 mg/mL)的培养基。培养24 h后,每孔加入MTT溶液10 μL,继续培养3 h,然后去除孔内的液体,每孔中加入200 μL二甲基亚砜使紫色结晶充分溶解,于570 nm波长处测各孔的吸光度[25]。设置不加样品的孔为空白对照组,其中每样重复3 次,取平均值,并按式(4)计算细胞相对存活率:

式中:I为细胞相对存活率/%;AS为样品组吸光度;AC为空白对照组的吸光度。
1.3.10 固体发酵前后蕨菜醇提物对LPS诱导RAW264.7细胞NO含量的影响
取对数生长期的RAW264.7细胞,以1×106个/mL接种于96 孔板中,每孔200 μL。待细胞完全贴壁良好后,更换含不同质量浓度固体发酵前后蕨菜醇提物(0.0、0.05、0.1、0.2 mg/mL)的培养基,孵育1 h后加入20 μL 1 μg/mL LPS进行诱导。设未诱导对照组、LPS组和LPS+样品组,每样重复3次,培养18 h后,用Griess法检测细胞上清液中NO含量[26]。按式(5)计算细胞上清液中NO的相对含量:

式中:I为细胞上清液中NO相对含量/%;AS为样品组吸光度;ALPS为LPS组的吸光度。
1.4 统计学分析
所得数据以 ±s表示,运用SPSS 18.0软件对实验结果进行统计分析(One-way ANOVA),利用邓肯式多重比较对差异显著性进行比较分析,P<0.05,差异显著。
2 结果与分析
2.1 固体发酵蕨菜最佳接种量的确定
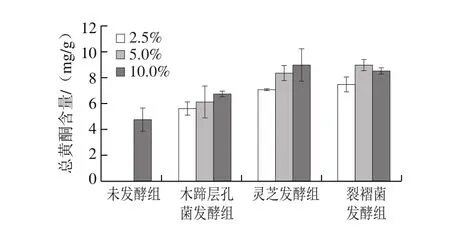
图1 接种量对总黄酮含量的影响Fig. 1 Effect of different inoculum amounts on total flavonoid content
为确定真菌固体发酵蕨菜最佳的接种量,参考文献[16,27],以质量分数2.5%、5%、10%接种于蕨菜,于25 ℃培养箱中培养7 d,由图1可知,木蹄层孔菌、灵芝和裂褶菌3 种功能真菌接种量与蕨菜发酵后总黄酮含量的变化有很大关系。3 种真菌接种量在2.5%时,总黄酮含量有所增加,但增加效果不显著,且过低接种量会使菌株生长缓慢,发酵周期延长,也使得染菌机率增大。当接种量在5%时,总黄酮含量显著增加。当接种量在10%时,相对于接种量5%,总黄酮含量增加不显著,且有降低的趋势,这可能与过高接种量造成菌株生长过快,引起培养基温度上升,影响菌株的正常代谢有关[28]。结果表明木蹄层孔菌、灵芝和裂褶菌接种量为5%时,总黄酮含量较高,故选定5%为菌种最适接种量。
2.2 固体发酵前后蕨菜醇提物的总酚、总黄酮含量的变化
由表1可知,木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物的提取率显著高于未发酵蕨菜(P<0.05),其提取率分别为24.14%、22.45%、26.63%,而未发酵蕨菜的提取率为17.56%。木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物的总酚含量明显降低,从未发酵时的(48.50±0.62)mg/g分别减少到(18.61±2.29)、(32.18±0.37)、(38.84±0.58)mg/g,表示在真菌发酵过程中分解利用了蕨菜中的总酚物质,并较少或不合成多酚类化合物。已有研究显示,微生物发酵能显著影响原料中总酚的含量,总酚含量的变化与发酵菌种、发酵方式以及发酵时间有关,即不同菌种不同发酵时间不同发酵的方式产生酶的种类、量和活力是有很大差异的,既可以提高总酚含量也可以破坏多酚类物质的结构,这些差异造成了发酵前后总酚含量的不同[29-30]。
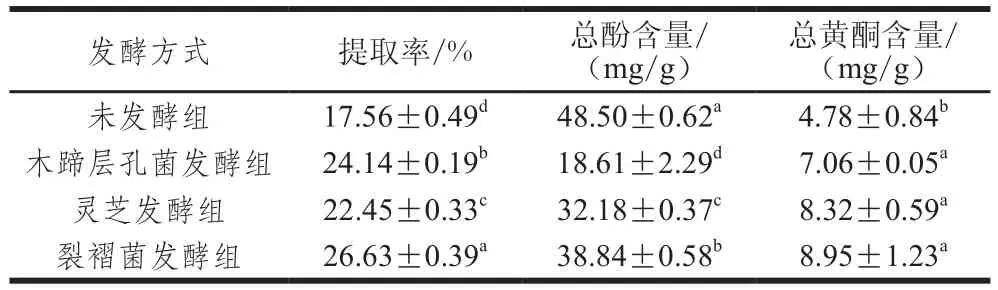
表1 发酵前后蕨菜醇提物的提取率及总酚与黄酮的含量Table 1 Extraction yields, total phenolic and flavonoid contents of native and fermented PAEE
如表1所示,不同真菌固体发酵对蕨菜中总黄酮含量的影响不同。木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物的总黄酮含量较发酵前均显著性增加(P<0.05),从未发酵时的(4.78±0.84)mg/g分别增加到(7.06±0.05)、(8.32±0.59)、(8.95±1.23)mg/g,分别提高了47.7%、74.1%、87.2%。表明3 种真菌对蕨菜进行固体发酵,可以明显提高总黄酮的含量,这可能与真菌在发酵过程中对蕨菜中的某些成分进行了转化,形成了新的黄酮类化合物;真菌在发酵过程中产生丰富的初生或次生代谢产物,这些代谢产物与蕨菜中某些物质发生了反应形成了新的黄酮类化合物[19]。另有研究表明真菌在发酵过程中能够产生较高活性的水解酶,如纤维素酶、果胶酶、淀粉酶以及蛋白酶,这些水解酶能够降解植物纤维素,降低淀粉等高分子对活性成分的包裹作用,有利于黄酮类物质的溶出[31-32]。这些结果与本研究所得的结果相一致。
2.3 固体发酵前后蕨菜醇提物对DPPH自由基清除作用的影响
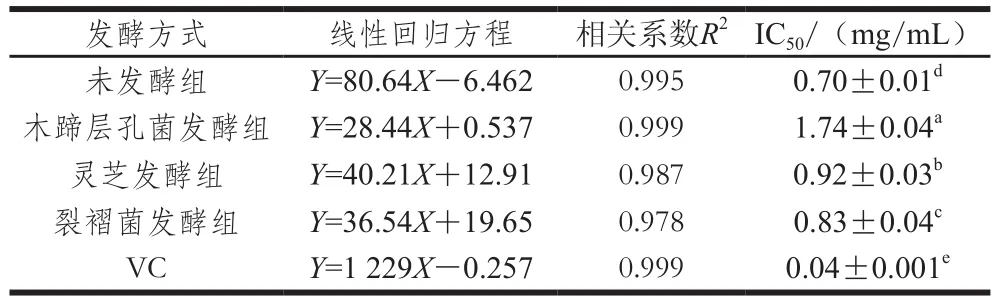
表2 发酵前后蕨菜醇提物对DPPH自由基的清除作用Table 2 DPPH radical scavenging activity of native and fermented PAEE
由表2可知,固体发酵前后蕨菜醇提物对DPPH自由基清除能力均表现出明显的量效效应,即随样品质量浓度增加,DPPH自由基清除能力随之增加。其中裂褶菌发酵的蕨菜醇提物质量浓度(X)与清除率(Y)间的回归方程为:Y=36.54X+19.65(R2=0.978);未发酵蕨菜醇提物质量浓度(X)与清除率(Y)间的回归方程为:Y=80.64X-6.462(R2=0.995);VC质量浓度(X)与清除率(Y)间的回归方程为:Y=1 229X-0.257(R2=0.999)。木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物清除DPPH自由基能力较发酵前均有所下降,对DPPH自由基清除作用的IC50值分别为(1.74±0.04)、(0.92±0.03)、(0.83±0.04)mg/mL,而阳性对照VC、未发酵蕨菜醇提物的IC50值分别为(0.04±0.001)、(0.70±0.01)mg/mL。真菌发酵后蕨菜醇提物DPPH自由基清除能力的下降,与发酵过程中总酚含量的降低有关,说明蕨菜中的总酚可能是其发挥清除DPPH自由基作用的主要活性物质。
2.4 固体发酵前后蕨菜醇提物对ABTS+·清除作用的影响

表3 发酵前后蕨菜醇提物对ABTS+·的清除作用Table 3 ABTS radical scavenging activity of native and fermented PAEE
由表3可知,固体发酵前后蕨菜醇提物对ABTS+·均有显著的清除作用,并呈现明显的量效关系。3 种真菌固体发酵后蕨菜醇提物清除ABTS+·能力较发酵前均有所下降。ABTS+·清除能力排序为阳性对照组VC>未发酵组>裂褶菌发酵组>灵芝发酵组>木蹄层孔菌发酵组,其对ABTS+·清除作用的IC50值分别为(0.05±0.001)、(0.51±0.02)、(0.92±0.01)、(1.20±0.14)、(2.69±0.01)mg/mL。结果表明,固体发酵前后蕨菜醇提物对ABTS+·清除能力的变化规律与对DPPH自由基清除能力的变化规律一致,说明蕨菜的抗氧化能力可能来自于蕨菜中的总酚物质。
2.5 固体发酵前后蕨菜醇提物对LPS诱导RAW264.7细胞释放NO的影响
由图2可知,在0.05~0.2 mg/mL质量浓度条件下,固体发酵前后蕨菜醇提物对RAW264.7细胞活性无显著影响,且无剂量效应。当质量浓度达到0.2 mg/mL时,未发酵组及木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物的细胞存活率分别为103.94%、103.48%、106.84%、102.92%,与对照组相比,无统计学差异(P>0.05)。以上说明,固体发酵前后蕨菜醇提物在0.2 mg/mL质量浓度内,对RAW264.7细胞无明显毒性作用,可用于后续实验的研究。
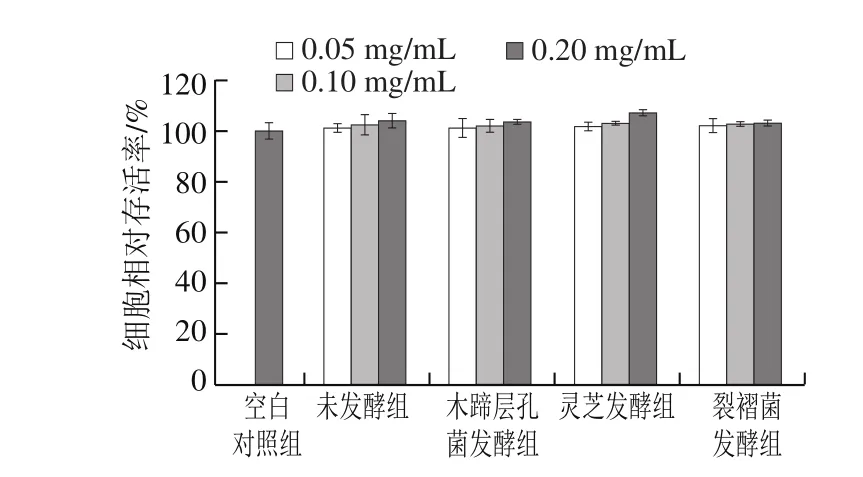
图2 发酵前后蕨菜醇提物对RAW264.7细胞活性的影响Fig. 2 Effects of native and fermented PAEE on cell viability in RAW264.7 cells
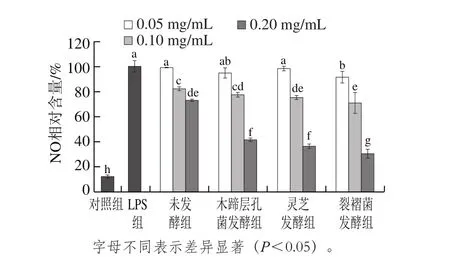
图3 发酵前后蕨菜醇提物对LPS诱导RAW264.7细胞释放NO抑制作用的影响Fig. 3 Inhibitory effects of native and fermented PAEE on LPS-induced NO production in RAW264.7 cells
由图3可知,未诱导对照组的RAW264.7细胞上清液中只含有少量的NO,给予LPS诱导后,细胞上清液中NO含量较未诱导对照组显著提高(P<0.05),表明体外RAW264.7细胞炎症模型建立成功。固体发酵前后蕨菜醇提物对LPS诱导RAW264.7细胞NO的含量均有明显的抑制作用,且随着样品浓度增加,细胞模型中NO的含量逐渐减少,与LPS组比较,差异均有统计学意义(P<0.05)。木蹄层孔菌、灵芝和裂褶菌固体发酵后蕨菜醇提物抑制NO生成的作用较发酵前显著增强,当质量浓度达到0.2 mg/mL时,对NO生成的抑制率分别为58.61%、63.57%、69.46%,而未发酵蕨菜醇提物的抑制率为27.09%。抗炎症作用排序为裂褶菌发酵组>灵芝发酵组>木蹄层孔菌发酵组>未发酵组,说明3 种真菌对蕨菜进行固体发酵,可以明显提高其抗炎症作用,这可能与发酵过程中这3 种真菌的代谢活动使蕨菜的总黄酮含量升高有关。有大量研究显示,黄酮类物质能够抑制LPS诱导RAW264.7细胞NO的释放,具有良好的抗炎症作用[33-34]。
2.6 发酵前后蕨菜醇提物的总酚、总黄酮含量与体外抗氧化、抗炎症活性的相关性分析
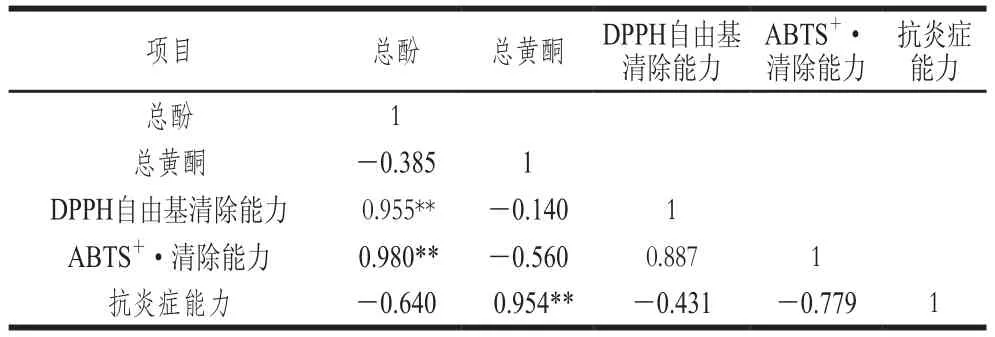
表4 发酵前后蕨菜醇提物的总酚、总黄酮含量与体外抗氧化、抗炎症活性的相关性分析Table 4 Correlation analysis between total phenolic and total flavonoid contents and antioxidant and anti-inflammatory activities of native and fermented PAEE
目前很多研究表明,植物中的化学成分含量与其生物活性之间存在着良好的相关性。陈玮玲等[35]研究表明青钱柳叶不同提取物中总酚、总黄酮含量与DPPH自由基清除能力、还原能力之间呈正相关,与总抗氧化能力呈显著负相关。黄士淇等[29]研究不同真菌发酵对墨江紫米多酚及其抗氧化性的影响,结果表明发酵前后墨江紫米的抗氧化性与总酚含量有关,而与总花色苷含量变化不相关。由表4可知,发酵前后蕨菜醇提物的总酚含量与ABTS+·清除能力具有较好的相关性,其次为DPPH自由基清除能力,与体外抗炎症作用无显著相关性,其中总酚含量与ABTS+·、DPPH自由基清除能力的相关系数分别为0.980、0.955。相关性分析显示,发酵前后蕨菜醇提物的总黄酮含量与ABTS+·、DPPH自由基清除能力无显著相关性,但与体外抗炎症作用呈显著正相关,相关性系数为0.954。
3 结 论
本研究结果表明,经过木蹄层孔菌、灵芝和裂褶菌3 种功能真菌的固体发酵,蕨菜醇提物的总酚含量、总黄酮含量以及体外抗氧化、抗炎症作用均受到显著的影响。发酵后蕨菜醇提物的总酚含量较发酵前明显下降,总黄酮含量显著增加,抗氧化能力降低,抗炎症作用得到有效提高。发酵前后蕨菜醇提物的总酚含量与其抗氧化能力有较好的相关性,总黄酮含量与抗炎症作用呈显著正相关。发酵前后蕨菜的总酚、总黄酮物质种类繁多,需进一步分离纯化,以筛选出更加明确有效的抗氧化和抗炎症活性成分。本研究结果为进一步开发和利用蕨菜资源提供科学理论依据。
