高通量测序分析不同增菌温度下冷鲜鸡肉细菌的群落多样性
2019-01-07温冬玲成淑君
温冬玲,成淑君,刘 悦,余 倩,*
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.深圳市沙井职业高级中学,广东 深圳 518100)
冷鲜鸡是指对屠宰后的鸡肉胴体严格执行兽医检验检疫制度和无公害管理,迅速对胴体进行冷却处理,使胴体温度在24 h内降低至0~4 ℃,并在后续加工、流通及销售过程中保持在这个温度范围内[1]。作为我国鸡肉未来消费的主要模式,冷鲜鸡肉在其贮藏、运输、零售等过程中虽大部分微生物的生长受到抑制,但嗜冷菌仍然能正常生长繁殖直至冷鲜鸡肉发生腐败。当冷鲜鸡肉在贮藏过程中温度控制不当时,极易引起低温下生长缓慢或不生长的嗜温菌迅速繁殖,造成冷鲜鸡肉品质下降,货架期缩短。因此,嗜冷菌和嗜温菌是影响冷鲜鸡肉腐败变质的主要菌群,尤其是嗜冷菌,是低温贮藏食品卫生检测的“指示菌”。
最初对冷鲜肉微生物多样性的研究方法多数停留在传统的分离培养和传统分子生物学方法上,且大部分集中在冷鲜牛肉、羊肉、猪肉及各种水产类研究上(鱼、虾、贝等)[2-5]。然而,近年来,随着测序技术的发展,高通量测序技术在微生物群落研究方面表现出越来越突出的优势,目前已广泛应用于医学[6]、环境水土污染[7-8]、人体胃肠道[9]等多个方面。虽然在食品领域的应用尚处于初期阶段,但在近几年来发展迅速,尤其对肉制品[10-11]、水产品[12-13]、发酵类食品[14-15]中的细菌群落多样性有着越来越多的研究。
目前对冷鲜鸡肉贮藏过程中细菌群落多样性研究报道不多,研究方法包括有传统分离培养、16S rDNA测序、高通量测序等,其中刘朏[16]、肖英平等[17]从不同贮藏温度、不同采样方法方面对冷鲜鸡肉贮藏微生物进行检测分析。然而,采用高通量测序技术对不同增菌温度下的冷鲜鸡肉细菌群落多样性的研究鲜见报道。冷鲜鸡肉样品在进行高通量测序前,首先需采集样品的细菌并提取DNA。为提取较高质量的DNA,提高细菌的检出率,需对不同贮藏时间的冷鲜鸡肉的细菌进行增菌处理,取其增菌液进行细菌总DNA提取。目前现行的标准GB 4789.2—2010《食品微生物学检验 菌落总数测定》中规定培养温度为(36±1)℃,该条件下培养所得结果只包括嗜中温性需氧微生物菌落总数。目前采取的细菌增菌温度多为37 ℃,而对于以嗜冷菌和嗜温菌为主导的低温贮藏冷鲜鸡肉来说,培养温度为(36±1)℃多为嗜温菌生长繁殖,而嗜冷菌生长在一定程度上被抑制,其所得微生物检测结果并不能完全客观地反映出冷鲜鸡肉的卫生质量[18]。倘若能对冷鲜鸡肉嗜冷菌和嗜温菌进行全面检测,并结合两者测定结果作综合评价,这样可以对冷鲜鸡肉的卫生质量有个更为完善的认识。因此,本实验选取4 ℃和37 ℃两种增菌温度,研究比较不同贮藏时间的冷鲜鸡肉群落多样性差异及菌群演替变化规律,以期为冷鲜鸡肉低温贮藏过程或贮藏温度失控情况下有效实施冷鲜鸡肉质量安全控制提供理论基础。
1 材料与方法
1.1 材料与试剂
冷鲜鸡肉购买于广州海珠区万国广场家乐福超市,置冰盒里0.5 h内送回实验室,在无菌环境下将鸡肉随机分为7 组,每组2等份,每份25 g,经保鲜袋密封包装后放置于4 ℃冰箱贮藏。以购买当天为0 d,作为对照组,其余6 组为实验组,分别贮藏2、4、6、8、10、12 d。依据冷鲜鸡肉的新鲜度分为贮藏前期(0~4 d)、中期(6~8 d)、后期(10~12 d)3 个阶段。
KAPA HiFi Polymerase、Solarbio细菌基因组DNA提取试剂盒。
1.2 仪器与设备
5418微型离心机 德国Eppendorf公司;My Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;2100生物分析仪、个人化操作基因组测序(personal genome machine,PGM)系统 美国Agilent公司。
1.3 方法
1.3.1 细菌总DNA的提取
无菌环境下,分别取不同贮藏时间的2 份冷鲜鸡肉样品25 g剪碎后放入装有225 mL 0.9%无菌生理盐水的三角瓶,充分振荡后,取1 mL菌液加入40 mL的LB肉汤中分别置于4 ℃增菌7 d和37 ℃增菌24 h。取增菌液1 mL至EP管内,采用Solarbio细菌基因组DNA提取试剂盒按照相应操作步骤进行。
1.3.2 16S rDNA V3区高通量测序
高通量测序文库的构建和Ion Torrent PGM高通量测序工作由上海伯豪生物科技有限公司完成。细菌V3可变区采用的测序引物为338F(5’-CCTACGGGAGGCAGCAG-3’),533R(5’-ATTACCGCGGCTGCTGG-3’)。对细菌16S rDNA基因V3可变区进行PCR扩增。扩增反应体系(25 μL):2×KAPA HiFi Mix 12.5 μL、引物(10 μmol/L)1 μL、DNA模板(30 ng)1 μL、ddH2O 10.5 μL。参数:98 ℃预变性45 s;98 ℃变性15 s,57 ℃退火30 s,72 ℃延伸1 min,循环20 次;72 ℃末端延伸10 min,4 ℃条件下保温。
1.4 数据分析
实验使用QIIME(http://qiime.org/scripts/assign_taxonomy.html)软件对测序原始数据进行过滤,去除低质量的序列,最后获得的高质量有效序列用于进一步的操作分类单元(operational taxonomic units,OTU)分析[19]。按97%相似性标准进行OTU聚类,然后利用RDP-classifier(https://sourceforge.net/projects/rdp-classifier/)及Silva数据库(Release119: http://www.arb-silva.de)进行物种注释和分类学分析。基于OTU的分析结果,采用对样本序列进行随机抽样的方法,计算常用的Alpha多样性指数,包括Chao I指数、ACE指数、Shannon指数、Simpson指数和Coverage值,并作出相应的稀释曲线。Chao I指数和ACE指数用于评价菌群丰富度,其数值越高表明群落物种丰富度越高;Shannon指数和Simpson指数反映物种多样性,Shannon指数与群落多样性呈正相关,Simpson指数则相反,Simpson指数越大,群落多样性越低。Coverage值是用于计算当前测序深度指标,该指数代表每个样品文库的覆盖率,Coverage值越高,表明该样本中序列没有被测出的概率较低,样本文库覆盖率越高。通过多变量统计学方法的主成分分析(principal component analysis,PCA),可以直观显示不同样品群落之间物种组成的相似性及差异性。
2 结果与分析
2.1 测序数据统计与OTU分析
由于在高通量测序过程会引入错误或者不可靠碱基等测序错误,对下游生物信息分析造成很大影响,因此需要对测序得到的原始数据进行优化处理。通过利用QIIME软件对测序得到的下机序列数,即原始序列数,进行过滤,去除低质量序列片段、错误序列、连接后引物序列以及无法与数据库中序列信息比对一致的序列后得到最终的有效序列。由表1可知,14 个样品经过测序后得到的下机序列总数为261 968 个,其中有效序列总数达154 610 个,且每个样品的有效序列数均达到10 000以上,有效序列百分比都达50%以上。这说明本次测序所得到的有效序列可以达到后续微生物多样性分析的要求。样品同一贮藏时间的冷鲜鸡肉在4 ℃得到的OTU数目普遍比37 ℃多,说明在4 ℃冷鲜鸡肉中的微生物多样性比37 ℃下更丰富。同一增菌温度下比较,不同的贮藏时间得到的OTU数目不同,其中在贮藏后期(10~12 d)得到的OTU数目较大,可能是由于在贮藏后期冷鲜鸡肉发生了腐败变质,而引起腐败变质的微生物种类较多。
稀释性曲线是通过对序列进行随机抽样,以抽到的序列数与它们所代表的OTU数目构建的曲线。它可用于说明测序数据的合理性、测序量能否涉及所有菌群。利用R语言工具作曲线图,如图1所示。随着测序量的不断增加,每个样品稀释性曲线有趋向平缓的趋势,说明实验的测序量基本反映出样品中绝大部分的物种信息。
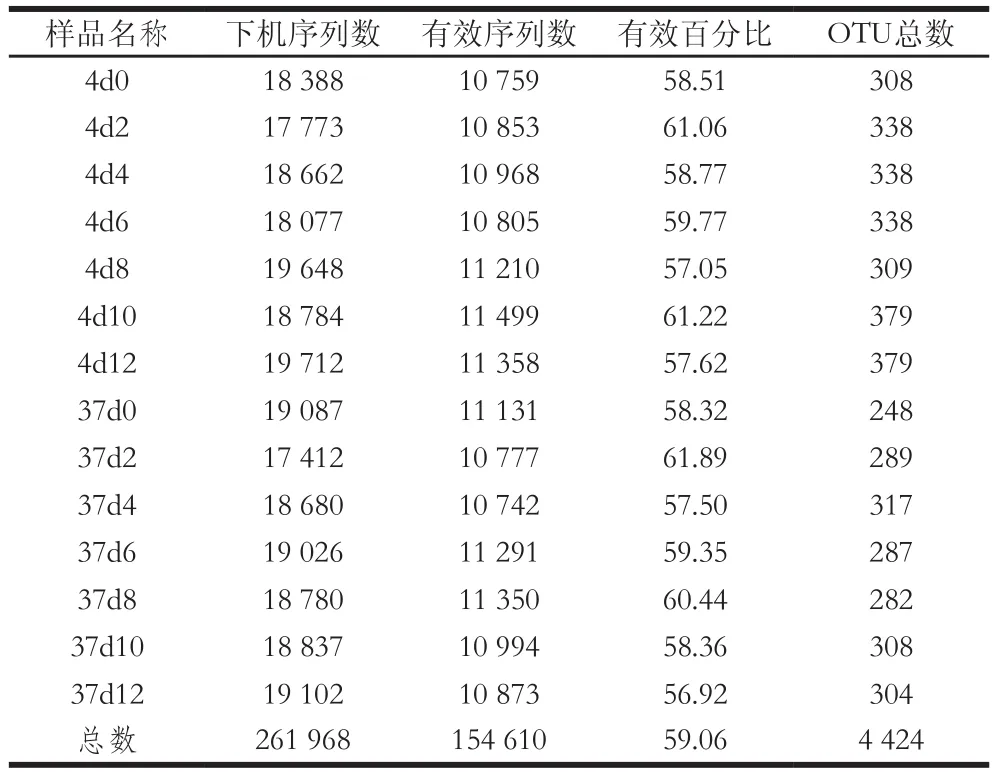
表1 测序数据统计结果Table 1 Statistic results of sequence data
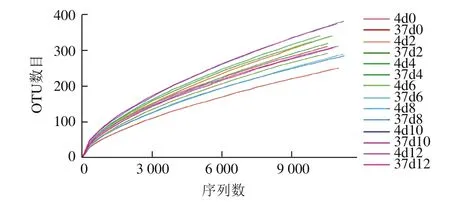
图1 14 个样品稀释性曲线Fig. 1 Rarefaction curves for 14 samples
2.2 不同增菌温度下冷鲜鸡肉细菌群落的Alpha多样性分析
根据97%相似性水平下的OTU信息,采用Alpha多样性指标的ACE、Chao I、Shannon及Simpson指数对样品微生物物种的丰富度和多样性进行评估。由表2可以看出,Chao I、ACE、Shannon指数在4 ℃数值普遍高于37 ℃的,Simpson指数刚好相反,表明在4 ℃获得的微生物群落多样性与丰富度比37 ℃高。其中Chao I、ACE指数值最大为样品4d2,其次为样品4d12,数值最小为样品37d0,说明4 ℃贮藏第2天的冷鲜鸡肉物种丰富度达到最高,可能是由于此时冷鲜鸡肉中营养成分含量较高,细菌迅速生长繁殖,甚至达到细菌的对数生长期;而贮藏第12天物种丰富度也比较高,可能是由于冷鲜鸡肉此时已沦为腐败,腐败菌含量迅速增加,占主要优势。对于Shannon指数,最大为样品4d10,其次为4d6与4d12,最小为37d0,而Simpson指数变化则相反。这说明了4 ℃冷鲜鸡肉贮藏10 d微生物多样性最高,37 ℃冷鲜鸡肉贮藏第0天微生物多样性最低。
此外,表中的Coverage值都大于97%,说明样品文库的覆盖率高,样品中序列没有被测出的概率较低,反映了本次测序结果可以代表样本的真实情况。
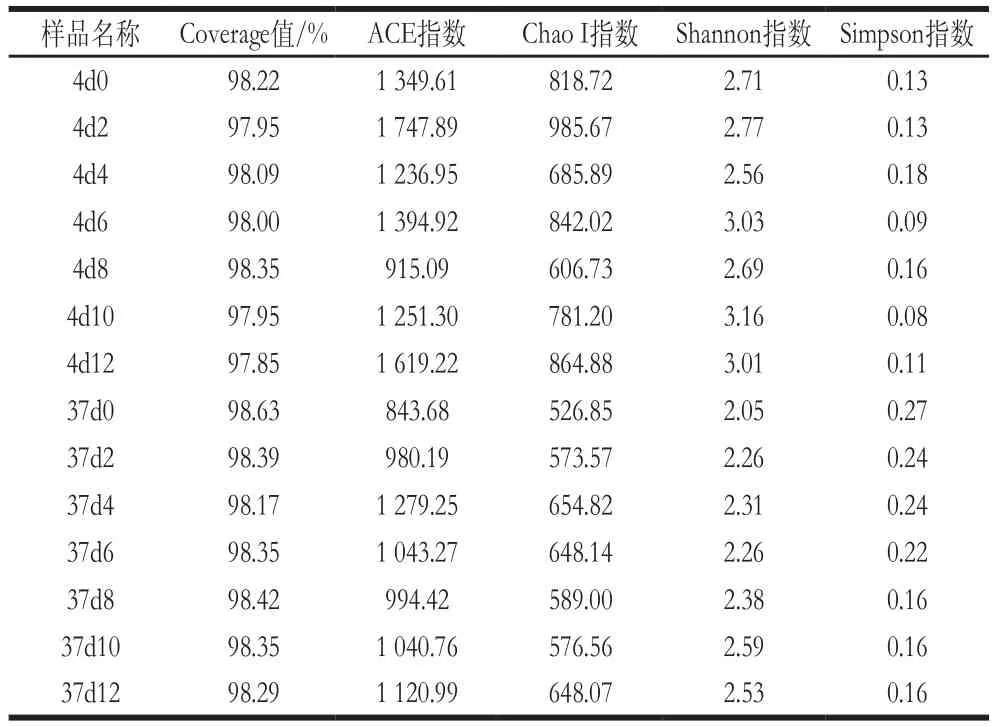
表2 Alpha多样性指数Table 2 Alpha diversity indexes
2.3 不同增菌温度下细菌群落结构分析
采用RDP-classifier对各样品中OTU进行物种注释可以鉴定到冷鲜鸡肉在贮藏过程中细菌分属于5 门、12 纲、20 目、39 科、53 属。本实验就门、属分类学水平做具体分析。
2.3.1 基于门分类水平上进行分析

图2 基于门分类水平上的样品菌群分布图Fig. 2 Bacterial community distribution at the phylum level
由图2可知,不同贮藏时间的冷鲜鸡肉微生物菌群在4 ℃和37 ℃得到的菌相主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)3 大菌门组成。根据各样品在门水平菌群比例分布图可以看出,不同贮藏时间的冷鲜鸡肉在不同增菌温度下微生物菌群组成存在较大的差异,但也存在一定的共性,其中Proteobacteria和Firmicutes广泛存在于14 个单样品中,并且占据优势。Proteobacteria相对丰度在48.97%~97.17%范围内,且不同贮藏时间及增菌温度下所占比例也不尽相同,其中在4 ℃贮藏第0、4天和37 ℃贮藏第12天所占比例较大,分别为88.71%、97.17%和88.43%。其次是Firmicutes,它在冷鲜鸡肉贮藏前期(0~4 d)总体含量较贮藏中期(6~8 d)、后期(10~12 d)高;到贮藏中期时,Bacteroidetes迅速增加,所占比例远大于Firmicutes,最高达到48.97%,成为第2大优势菌门,说明随着贮藏时间延长,Bacteroidetes对冷鲜鸡肉的腐败变质起了越来越大影响,与目前已有的相关研究结果一致[20]。除这些主要菌门外,还存在一些丰度较低的放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、其他未知分类(unclassified)以及未知细菌菌门(bacteria_unclassified),有些相对丰度不足0.01%,图2中显示不明显。这也说明了冷鲜鸡肉在贮藏过程中微生物多样性丰富,丰度比较集中的特点。
2.3.2 基于属分类水平上进行分析
不同贮藏时间的冷鲜鸡肉在4 ℃和37 ℃条件下共分离得到53 个不同的属。图3为属分类水平上相对丰度大于1%的菌群柱状分布图。在门水平上占主要优势的Proteobacteria在属的分类水平上主要包括假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanellaceae)、不动杆菌属(Acinetobacter)、柠檬酸杆菌属(Citrobacter)、变形杆菌属(Proteus)、摩根氏菌属(Morganella)、污蝇杆菌属(Wohlfahrtiimonas)等。Firmicutes在属水平上主要包括有肠球菌属(Enterococcus)、魏斯氏菌属(Weissella)、漫游球菌属(Vagococcus)、乳球菌属(Lactococcus)、肉食杆菌属(Carnobacterium)、鲁梅利杆菌属(Rummeliibacillus)等;Bacteroidetes在属水平上鉴定到的菌属主要有类香味菌属(Myroides)、拟杆菌属(Bacteroides)等。
由图3可知,在4 ℃和37 ℃微生物菌群种类和丰度大小存在较大的差异性。在4 ℃冷鲜鸡肉主要以Pseudomonas、Shewanellaceae、Acinetobacter、Myroides及其他未知菌菌属为主;其中Pseudomonas占最大的比例,最高达44.03%,为冷鲜鸡肉贮藏过程中的主要优势菌群,与目前大多数冷鲜肉优势腐败菌研究结果一致[21-23]。其次为Shewanellaceae、Acinetobacter,最高分别占菌群的38.23%、24.64%。研究报道,Pseudomonas和Pseudomonas低温环境生长能力很强,且具有很强的产生氨等腐败产物的能力,是低温贮藏冷鲜肉的优势腐败菌[17,24]。然而,这些菌在37 ℃未检出或检出量很少。Weissella在4 ℃贮藏前2d含量较大,可达26.7%,而在贮藏中期和后期丰度很低,小于0.1%。
在37 ℃条件下,Myroides、Wohlfahrtiimonas、Citrobacter、Lactococcus、Proteus和其他未知菌属(bacteria_p_other)所占的比例相对较大,其中bacteria_p_other占最大比例,但未能鉴定到具体菌属,有待进一步研究。Wohlfahrtiimonas在37 ℃检出,而4 ℃未发现或丰度很低,而且Wohlfahrtiimonas在贮藏后期所占比例逐渐增大,在第12天达到最大值30.19%,加速了冷鲜鸡肉的腐败变质。据报道,污蝇杆菌是近年来新发现的条件致病菌[25],在国内的肉类研究中鲜见报道,而2016年在国外巴西里约热内卢曾报道了从零售冷冻鸡中分离新型人畜共患病原体污蝇解壳杆菌,可见该菌在低温下也能生长[26]。因此,对于污染了Wohlfahrtiimonas的肉类应引起高度重视。Lactococcus在冷鲜鸡肉贮藏的整个过程中均存在,丰度虽不高,维持在0.84%~20.95%之间,但对冷鲜鸡肉腐败也存在较大的影响。
在4 ℃和37 ℃条件下,Myroides在贮藏前期均未检出或检出量很少,直到第6天,冷鲜鸡肉开始发生腐败变质后,其所占的比例总体上呈增加趋势,最高达41.17%,说明该菌是影响冷鲜鸡肉腐败变质的优势菌群。
Myroides原属芳香黄杆菌属,共有5个种,香味类香味菌为该属模式种,是一种条件致病菌,在自然界中广泛分布,且具有较强的耐药性[27]。近年来对该菌属在鲜肉上的污染报道逐渐增多[28-31],也有文献报道Myroides作为一种优势腐败菌出现在冷鲜肉中。其中施荷等[28]在研究冷鲜鹿肉贮藏期间菌相变化中发现,在贮藏末期棕色类香味菌(Myroides phaeus)是造成冷鲜鹿肉腐败的优势腐败菌之一。Yang Chao等[30]在研究冷鲜猪肉贮藏过程优势腐败菌中也检测出Myroides,且贮藏后期所占比例高于Pseudomonas,与本实验研究结果一致,可能是由于Myroides能产生一种碳青霉烯抗菌剂,一定程度上抑制了其他细菌的生长。

图3 基于属分类水平上的样品菌群分布Fig. 3 Bacterial community distribution at the genus level
综合以上分析也发现低温贮藏冷鲜鸡肉的主要菌群以嗜冷菌和嗜温菌为主。当冷鲜鸡肉在贮藏过程中温度失控时,嗜温菌或部分污染的致病菌会大量繁殖,加促冷鲜鸡肉腐败。结合37 ℃和4 ℃两种增菌温度分析,可以较完全地反映冷鲜鸡肉在贮藏过程中污染的细菌群落结构演替规律。
2.4 冷鲜鸡肉贮藏中不同增菌温度下细菌群落的PCA
依照不同贮藏时间将冷鲜鸡肉样品分为7 个组,每组由同一贮藏时间的4 ℃和37 ℃两种增菌温度的样品组成。样品之间距离越近,表示样品群落结构组成越相似。如图4所示,PC1与PC2的贡献率分别为40.83%和21.55%,说明这两个主成分是解释样品微生物群落结构组成差异的主要因素。不同贮藏时间及不同增菌温度下的各个样品能明显地分离,表明各个样品间微生物群落结构组成具有一定的差异,其中在PC1方向上,4 ℃和37 ℃的样品能够显著地分布在两个区域,说明细菌增菌温度在PC1水平上对样品菌群结构变化影响显著;而在PC2上,不同贮藏时间的样品区分明显,这说明不同贮藏时间在PC2水平上对样品菌群结构变化影响显著。同一增菌温度下贮藏前期(0~4 d)的样品与贮藏中期(6~8 d)、贮藏后期(10~12 d)样品之间分布距离较大,主要是由于冷鲜鸡肉在贮藏前期仍处于鲜肉与次鲜肉状态,而在贮藏中期开始发生腐败,直到贮藏后期完全腐败,进而导致冷鲜鸡肉群落结构组成发生了较大变化。然而,除了样品4d10与4d12,其他处于贮藏前期、中期、后期的各个样品间距离较小,说明同一时期的样品群落结构组成较相似。

图4 样品PCAFig. 4 PCA of bacterial communities
3 结 论
本实验对不同贮藏时间的冷鲜鸡肉细菌在4 ℃和37 ℃条件下的增菌液进行细菌基因组DNA提取,并通过基于16S rDNA基因的高通量测序技术分析。结果表明:4 ℃与37 ℃条件下微生物群落多样性与演替规律存在较大差异。共鉴定到细菌5门、12纲、20目、39科、53属。在门水平上,均以变形菌门、厚壁菌门、拟杆菌门为优势菌门。在属水平上,4 ℃增菌温度下,贮藏前期(0~4 d)冷鲜鸡肉以Pseudomonas、Shewanellaceae、Acinetobacter为主要的优势菌,其中Pseudomonas占最大的比例,最高达44.03%,为冷鲜鸡肉贮藏前期优势菌;在贮藏中后期,Myroides迅速增加,在12 d达到最大,大于Pseudomonas,成为影响冷鲜鸡肉贮藏中后期腐败变质的主要菌属。而在37 ℃条件下,Citrobacter、Proteus、Lactococcus、Bacteroides在贮藏前期含量相对较大,到贮藏中后期,主要以Myroides、Wohlfahrtiimonas为主,而Wohlfahrtiimonas在贮藏前期未检出或含量很低,在贮藏后期所占比例逐渐增大,在12 d达到最大值30.19%,加促了冷鲜鸡肉的腐败。
