复合菌剂对玉米根际土壤酶活性和微生物数量的影响
2019-01-07李海云师尚礼王国基范宇航胡鸿娇朱熙栋
李海云,姚 拓,师尚礼,王国基,唐 玉,范宇航,胡鸿娇,朱熙栋
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
玉米是世界上广泛种植的三大粮食作物之一,同时也是畜牧业生产中不可或缺的青贮饲料来源之一,其种植面积仅次于小麦和水稻。截止2015年,我国玉米种植面积达3 811.9万hm2,总产量22 463.2万t,分别占粮食种植面积和总产量的33.6%、36.1%[1]。近年来,在玉米种植过程中出现因大量施用化肥引起种植环境(土壤、空气、水源、微生物区系和多样性)污染和产量降低等一系列问题[2]。研究表明在甘肃N、P是禾本科植物生长所必需的营养元素。氮、磷素养分的来源可以通过施用化肥,但由于化肥当季利用率较低,难以满足作物对养分的吸收利用,为此现代农业在追求粮食高产和安全的前提下,在寻求一种既可以减少化肥施用量又能够保证作物不减产和粮食安全的途径。而微生物菌肥的施用则成为解决这一问题的有效途径,也是发展环境友好型、低碳化农业的必然选择[3-5]。研究发现施用微生物肥料替代部分化肥能使玉米不减产,还可以改善土壤微生境条件。黄鹏等[6]施70%~85%化肥+菌肥能够使甘肃河西绿洲灌区玉米不减产,并且氮、磷肥利用率和光能利用率分别达到31.79%~32.20%,22.07%~22.31%和0.68%~0.71%,与不施肥相比85%化肥+菌肥显著提高玉米收获期的农艺性状和产量,使株高、百粒质量、穗质量分别达358.32 cm,39.68 g,369.50 g,并使玉米的经济产量提高21.6%;在微生物肥料替代15%化肥条件下,玉米地土壤微生物生物量碳、氮含量分别提高40.0%和18.5%,且在该处理下,土壤中细菌和放线菌数量显著提高,分别达2.6×106cfu/g和1.4×106cfu/g[7]。土壤酶是土壤中重要催化物质之一,主要由微生物的细胞代谢产生,在土壤C、N、P、S循环中起着重要的催化作用;同时,它还是反应土壤微生物活性及土壤生化反应强度的指标,能表征土壤肥力、质量及其健康状况[8-12]。在油菜种植中施用微生物菌肥后发现,油菜地土壤碱解氮、速效磷和速效钾含量高于不施肥对照土壤,而且还能够提高土壤磷酸酶及脲酶活性;尤其在中低磷素水平下,加入微生物菌肥有利于土壤磷素的可持续指数上升,但要稳定提高作物产量和土壤肥力,则必须配施一定量的化学肥料(如氮肥、钾肥等)[13-17]。因此,利用从玉米根际土壤中分离的7株优良根际促生菌株作为供试菌株,制作复合微生物菌剂进行田间试验,探究复合菌剂配施减量化肥对玉米根际土壤酶活及微生物数量的影响,以期筛选出适宜该地区的最佳施肥配比,为微生物菌剂的推广应用提供数据支撑。
1 材料和方法
1.1 研究区概况
研究地位于甘肃省武威市凉州区黄羊镇农垦农场甘肃农业大学牧草试验站,地理位置N 37°52′20″,E 102°50′50″。地处甘肃河西走廊东端,属典型内陆荒漠气候区,海拔1 581 m;全年平均无霜期156 d,降水量164.4 mm,蒸发量1 919 mm,年均气温7.8℃,日照时数2 968.2 h,≥10℃年积温2 985.4℃;年太阳辐射总量504~630 kJ/cm2。供试土壤为灌漠土,耕层有机质15.71 g/kg、全氮0.87 g/kg、全磷1.02 g/kg、速效磷13.38 mg/kg、速效钾248.63 mg/kg,土壤pH8.2。
1.2 材料
供试玉米品种为金穗4号(Zeamayscv.Jinsui No.4)和先玉335(Z.mayscv.Xianyu 335);供试化肥为磷酸二铵[总养分≧64%(N∶P2O5∶K2O=18∶46∶0)]和尿素(总氮含量≧46.4%);供试载体配方参照段淇斌等[18]的方法;供试菌株为课题组分离自玉米根际的促生菌株P2-1,P4-4,P4-12,P4-15,P4-17,4N4和2N2,供试菌株信息见表1。
1.3 复合菌剂制作
菌株间的拮抗试验采用蒋永梅[19]的方法进行测试发现各菌株间均无拮抗反应。将7株优良促生菌株分别接种在LB液体培养基,28℃,150 r/min培养72 h。待菌株充分生长后,利用分光光度计测定各菌株悬浮液D(660nm)值,用无菌水调其D(660nm)>0.5(即菌株悬浮液108cell/mL),并将调好的各菌株悬浮液按特定体积比混合后备用;称取载体250 g,121℃灭菌30 min,待载体冷却后,接种混合菌株悬浮液,置于28℃培养箱中培养7~10 d,备用。
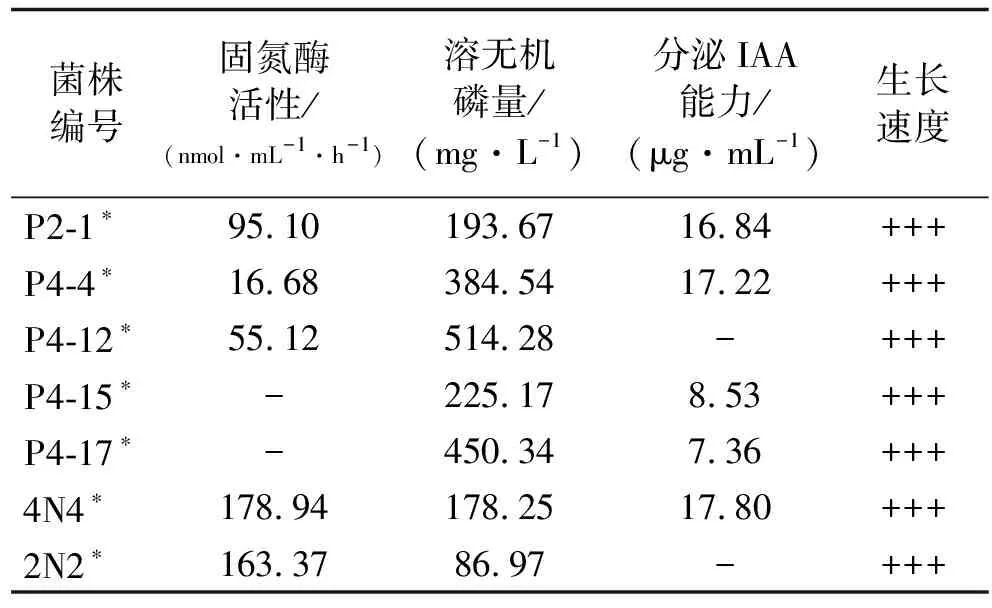
表1 供试菌株促生特性Table 1 Growth-promoting characteristics of tested strains
注:*表示待鉴定,“-”表示无,“+++”表示生长速度较快
1.4 试验设计
试验共设5个处理,处理A:全量化肥(纯氮450 kg/hm2,磷素(P2O5)225 kg/hm2,当地土壤是富钾土壤,故不施钾肥);处理B:85%化肥+复合菌剂;处理C:70%化肥+复合菌剂;处理D:复合菌剂(7.5 kg/hm2);处理E:对照(不施肥);每处理3个重复,2个玉米品种共30个小区,采用随机区组设计,每小区面积45 m2,行株距为40 cm×30 cm,密度为7.5万株/hm2。在2013年4月进行播种,播种前将种子(未包衣玉米种子)用菌肥拌种,置于阴凉、避光处0.5 h,对照处理种子用无菌水拌种。
1.5 测定指标与方法
1.5.1 根际土采集 在2013年5月(苗期)、7月(抽雄期)、8月(灌浆期)和9月(成熟期)采用5点法采集玉米根际0~25 cm土样,每个处理3个重复,将相同重复处理土样均匀混合后分成2份装入无菌塑料袋中,低温迅速带回实验室。1份土样进行土壤酶活性的测定,另1份新鲜土样迅速进行3大土壤微生物数量计数。
1.5.2 土壤酶活性测定土壤酶活性采用常规方法进行测定[20]。土壤过氧化氢酶活性测定采用容量法测定,土壤脲酶活性采用靛酚蓝比色法测定,土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定,土壤蔗糖酶测定采用3,5-二硝基水杨酸比色法。
1.5.3 土壤微生物数量测定土壤3大微生物数量测定采用平板稀释计数法,细菌数量测定采用牛肉膏蛋白胨琼脂培养基,真菌数量测定采用马丁-孟加拉红培养基,放线菌数量测定采用改良高氏一号培养基,微生物数量计算参照文献[21]的方法。
1.6 数据统计与分析
采用SPSS 19.0软件进行数据统计分析,多重比较采用Duncan法。
2 结果与分析
2.1 复合菌剂对玉米根际土壤酶活性的影响
2.1.1 复合菌剂对玉米根际土壤过氧化氢酶活性的影响 在2个玉米品种根际土壤中,土壤过氧化氢酶活性在玉米生育期呈现出先增高后降低的趋势,在灌浆期,过氧化氢酶活性达最大值,并且土壤过氧化氢酶活性呈现出金穗4号>先玉335(除苗期外)(图1)。土壤过氧化氢酶在玉米苗期不同施肥处理下表现为:处理A>B>C>D>E,其中,B和C相比对照分别提高18%、15%(先玉335)和8%、7%(金穗4号)。在抽雄期不同施肥处理下均表现为:处理B>C>A>D>E,处理B较A、E提高5%、17%(先玉335)和6%、18%(金穗4号)。在喇叭口期不同施肥处理下表现为:处理B>C>A>D>E,且处理B分别比A提高3.6%和5.8%,比处理E提高11.2%和16.2%。在成熟期不同施肥处理中,酶活性较灌浆期有所下降,表现为:处理B>C>A>D>E,处理B相较于A和E分别提高2.8%,11%(先玉335)和4.7%、14.7%(金穗4号)。
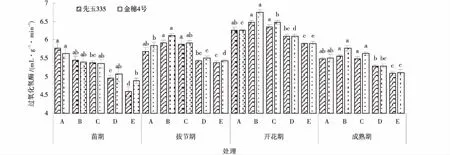
图1 不同施肥处理对玉米不同生育期土壤过氧化氢酶影响Fig.1 Effect of different fertilization treatments on soil catalase in different growth stages of maize注:图中不同小写字母表示同一生育期、不同处理差异显著(P<0.05),下同
2.1.2 复合菌剂对玉米根际土壤脲酶活性的影响 玉米生育期中根际土壤脲酶活性在不同施肥处理下均表现出:抽雄期>灌浆期>苗期>成熟期,且各生育期金穗4号土壤脲酶活性高于先玉335(除抽雄期外)。不同施肥处理间为:处理B>C>A>D>E,苗期不同施肥处理下,处理B比A分别提高8.9%(先玉335)和6.1%(金穗4号),比处理E分别显著提高14%和21%。抽雄期时,B处理分别较A、E提高了7.4%、23.4%(先玉335)和7.5%、21.3%(金穗4号);金穗4号处理B显著高于其他处理,先玉335处理B与C间差异不显著,与A,D和E间差异显著(P<0.05)。灌浆期时,不同施肥处理脲酶活性均达到最高值,处理B分别比A、E提高5.2%、21.6%(先玉335)和5.0%、21.2%(金穗4号)。成熟期时,脲酶活性在各处理中均有所下降,处理B分别较A、E提高9.3%、6.3%和17.5%、27.5%(图2)。
2.1.3 复合菌剂对玉米根际土壤碱性磷酸酶活性的影响 不同施肥处理下,2个玉米品种根际土壤碱性磷酸酶活性在生育期呈现出:抽雄期>灌浆期>苗期>成熟期;抽雄期与灌浆期均呈现出金穗4号>先玉335,苗期和成熟期不同处理表现各异。抽雄期时,2个玉米品种表现为:B>C>A>D>E,处理B比A,E处理分别提高19.7%、53%(先玉335)和8.5%、31.9%(金穗4号)(图3)。
2.1.4 复合菌剂对玉米根际土壤蔗糖酶活性的影响 不同施肥处理,2个玉米品种在生育期根际土壤蔗糖酶活性呈现出:灌浆期>抽雄期>成熟期>苗期(图4);在抽雄期和灌浆期,处理A和D蔗糖酶活性表现为金穗4号>先玉335,其他处理则表现为先玉335>金穗4号。在灌浆期,2个品种土壤蔗糖酶活性为:处理B>C>A>D>E,土壤蔗糖酶活性处理B比A和E分别提高24.5%,80.3%(先玉335)和13.7%、65.1%(金穗4号)。

图2 不同施肥处理下玉米不同生育期土壤脲酶的含量Fig.2 Effect of different fertilizer treatments on soil urease in different growth stages of maize

图3 不同施肥处理下玉米不同生育期土壤碱性磷酸酶的含量Fig.3 Effect of different fertilizer treatments on soil alkaline phosphatase in different growth stages of maize

图4 不同施肥处理下玉米不同生育期土壤蔗糖酶的含量Fig.4 Effects of different fertilizer treatments on soil invertase in different growth stages of maize
2.2 复合菌剂对玉米根际土壤微生物数量的影响
2.2.1 对玉米根际土壤细菌的影响 减量化肥处理B,C对玉米根际土壤细菌的影响显著大于其他处理(表2)。对于先玉335处理,除全量化肥与复合微生物菌剂(D)无显著差异,其他处理间细菌数量均差异显著(P<0.05),处理效果最佳的是B,较A、E处理分别增加1.310和3.705倍。对于金穗4号,各处理间均差异显著(P<0.05),表现出处理B>C>A>D>E的趋势,且处理B分别较处理A和E提高1.94和4.8倍。且先玉335的根际细菌数量高于金穗4号。
2.2.2 对玉米根际土壤真菌的影响 玉米根际土壤真菌以不施肥(E)含量最多,但金穗4号较先玉335增加9%;整体而言,金穗4号土壤真菌较先玉335高,其中在复合菌剂处理下(B、C、D),金穗4号和先玉335根际土壤真菌较未施复合菌剂(A、E)含量减少;对复合菌剂+减量化肥而言(B、C),先玉335处理之间差异不显著(P>0.05),金穗4号差异显著(P<0.05);在复合菌剂(D)处理下金穗4号和先玉335土壤根际真菌含量一致,均为4.5×105cfu/g(表2)。
2.2.3 对玉米根际土壤放线菌的影响 玉米根际土壤放线菌数量均表现为处理B>A>C>D>E(表2)。处理B土壤放线菌数量分别较处理E提高了2.0(先玉335)和1.9倍(金穗4号),较处理A分别提高1.0(先玉335)和1.25倍(金穗4号)。
2.2.4 对玉米根际土壤3大微生物总数的影响 各处理均以复合菌剂+减量化肥(B、C)含量最多,但处理B均高于处理C,与全量化肥(A)处理相比,先玉335增加121.5%,金穗4号增加88.6%;全量化肥(A)和复合菌剂(D)相比,微生物总量以全量化肥(A)高于只施用复合菌剂(D)的处理;因此,微生物菌剂和化肥减量配施可以提高玉米根际微生物总量,但以85%化肥+复合菌剂对微生物总量的影响最为明显。

表2 不同施肥处理下玉米土壤微生物的数量Table 2 Effect of different fertilizer treatments on the number of soil microbes in maize cfu/g
注:同列不同小写字母表示差异显著(P<0.05)
3 讨论
随着人类对土壤学研究的深入及绿色无污染农业的全面认识,微生物菌剂在农业生产中的作用越来越受到重视,微生物菌剂含有的固氮菌能够将空气中游离的氮气转化为植物可吸收利用的氮素增加土壤总氮含量;一些具有分泌植物生长素的菌株通过代谢作用分泌植物激素被根系吸收,可促进植物的生长;溶磷菌能够将土壤中难溶性的磷转化为植物可吸收利用的有效磷供作物吸收,以此提高作物产量。土壤微生物也是土壤酶的来源之一,而土壤酶被认为是衡量土壤质量的指标,因土壤酶检测方便,常用来间接衡量微生物的变化[22]。同时,微生物也是物质能量转化的推动者,施用菌剂会影响土壤酶活性和养分元素含量[23]。施用复合PGPR接种剂能够显著提高土壤的速效养分和土壤蔗糖酶、过氧化氢酶和脲酶的活性[24-25]。也有研究报道,接种自生固氮菌对玉米根际土壤酶活性及细菌群落功能多样性都有显著影响,在接种褐球固氮菌和类芽孢杆菌后玉米根际脲酶活性较对照分别提高了20.55%和9.58%[26];白菜根际土壤蔗糖酶、过氧化氢酶、脲酶和磷酸酶活性较对照分别提高11.97、0.43、75.68和8.63倍,使土壤可培养细菌、真菌、放线菌数量较对照增加8.59,3.00和0.24倍[27]。研究均与试验结果相类似,原因是(1)PGPR菌剂中含有的菌株具有一定的溶解无机磷的能力,可将土壤中难溶性磷转化成可溶性磷;(2)菌株分泌IAA还能够刺激植物根系生长,促进植物根系分泌作用,影响根际微生物活性和数量,间接或直接促进土壤酶活性的升高[28];(3)PGPR菌剂的施用可以直接提高土壤中可培养微生物的数量[29],且土壤酶活性与土壤中微生物数量显著相关[22],从而提高土壤酶活性。试验发现在玉米各生育期,土壤酶活性总体表现为:处理B(菌肥+85%化肥)>处理C(菌肥+70%化肥)>处理A(全量化肥)>处理D(菌肥)>处理E(对照),其中在抽雄期和灌浆期达到峰值。其原因可能是接种PGPR菌剂能够有效改变植物的根系形态和根际细菌群落结构,促使根系分泌更多的含碳化合物,含碳化合物进而促进根际PGPR的生命活动[30-33]。全量化肥的施用可能会抑制土壤微生物的数量[31-33],而单施微生物菌剂,可能是由于土壤中养分元素供给不足使菌株不能很好的定殖,造成土壤酶活性在不同处理之间差异性变化[34]。土壤微生物是维持土壤活力的主要指标,试验采用传统稀释平板法测定玉米成熟期3大土壤微生物,结果表明增施菌肥对玉米根际微生物影响比较显著,且以细菌最为明显,其中处理B(复合菌剂+85%化肥)效果最佳,处理C(复合菌剂+70%化肥)次之,表明施用复合菌肥能够大幅度增加土壤中微生物优势菌群的数量[35]。且施用复合微生态菌剂后,前期可提高土壤中细菌和放线菌的数量,但随生育期延长效果变弱[28]。土壤是一个巨大、复杂且稳定的生境,微生物活性与群落结构受到较多因素影响,使得接种外源微生物后对土壤土著微生物影响很小[35-36],不宜于外来菌种微生物的成功定殖并发挥功效。研究发现施用菌肥可引起土壤微生物区系发生变化,除与接种外源微生物有关外,至于具体影响因素,有待于进一步研究。
4 结论
(1)不同施肥处理对2个玉米品种先玉335、金穗4号根际4种土壤酶活性均有不同程度影响,差异显著(P<0.05)。在各生育期,土壤酶活性总体表现为:处理B(菌肥+85%化肥)>处理C(菌肥+70%化肥)>处理A(全量化肥)>处理D(全量菌肥)>处理E(对照),其中在抽雄期和灌浆期达到峰值。
(2)施用复合微生物菌剂对2个玉米品种(先玉335、金穗4号)根际中土壤3大类微生物数量均有显著影响,以细菌数量变化最为显著。
(3)复合菌剂+85%化肥处理为适宜该地区的最佳施肥配比。
