腹腔镜右半结肠切除尾侧入路与头侧入路的前瞻性随机对照研究
2019-01-07肖荷芳陈子文刘红权方传发刘传渊赖承治
肖荷芳 陈子文 刘红权 方传发 刘传渊 赖承治 钟 武
随着微创技术的不断发展,腹腔镜手术已经成为了结直肠癌根治术的金标准[1]。当前,腹腔镜右半结肠癌根治术多采用中间入路[2]。腹腔镜根治性右半结肠切除术分为头侧(腹侧面,即前面)入路与尾侧(腹侧面和背侧面,即前面或后面)中间入路。 哪一入路更易学习掌握行完整结肠系膜切除术(Complete Mesocolic Excision,CME)存在争议[3]。赣州市人民医院胃肠外科2010年起开展中间入路腹腔镜右半结肠切除术,积累了一定的经验并度过了学习曲线,2016年1月—2018年7月,采用前瞻性随机对照研究的方法,将入院拟行手术治疗的38例右半结肠癌患者分别行尾侧中间入路和头侧中间入路腹腔镜右半结肠切除术,对比两种入路在腹腔镜右半结肠切除术治疗中的近期疗效。
1 资料与方法
1.1 课题设计
本课题比较对象是手术入路,两种入路法在根治原则及淋巴结清扫范围方面理论上是一致的,故主要对比结果为手术时间、手术出血量,次要对比结果为术中及术后并发症,淋巴结清扫情况。
1.2 研究对象
1.2.1 入组标准 ①电子结肠镜提示单发肿瘤,临床分期为Ⅰ、Ⅱ、Ⅲ期的右半结肠癌;②肿瘤直径在8 cm以下;③术前影像学证实肿瘤未累及邻近脏器;④年龄为35~70岁;⑤美国麻醉医师协会(ASA)评分小于或等于3;⑥体质量指数(BMI)小于或等于30 kg/m2;⑦卡氏评分大于或等于80。
1.2.2 出组标准 ①肿瘤出现远处转移;②肿瘤累及邻近脏器;③右半结肠癌合并肠梗阻或者肠穿孔;④合并多发性结肠息肉病;⑤既往腹部手术史;⑥既往有溃疡性结肠炎或者克罗恩病。
1.3 课题实施
经医院伦理委员会审核同意后,自2017年1月—2018年7月,38例符合上述条件的右半结肠癌患者(肠镜活检报告为腺癌)入组。右半结肠癌采用术前常规检查结合超声内镜和胸腹部螺旋CT确定TNM术前临床分期。
按入院顺序,对符合条件并签署知情同意书的患者按随机数字表随机抽样分为两组,每组19例,手术由同一组外科医生操作(课题实施前1年该组医生已分别完成腹腔镜右半结肠切除头侧中间人路及尾侧中间入路20例以上,已熟练掌握两种入路术式),尾侧入路和头侧入路两组对比指标包括:患者性别、年龄、体质量指数、卡式评分、ASA分级、肿瘤直径、术前肿瘤TNM临床分期、肿瘤部位、肿瘤形态、手术时间、术中出血量、术中血管损伤例数、中转开腹例数、淋巴结清扫枚数、术后病理标本评价、术后并发症、术后病理分期,其中主要对比指标为手术时间及术中出血量。
1.4 手术入路方法
1.4.1 尾侧入路[4]手术要点 ①患者放置于头低脚高约30 °,左侧倾斜位约15 °,将大网膜、回肠等腹腔脏器移置左上腹部,充分显露末端回肠系膜根部与后腹膜的“黄白交界线”, 后方有输尿管、右侧髂血管;以十二指肠水平段下方的“黄白交界线”为切入点,切开并进入融合筋膜间隙,适当充分拓展融合筋膜间隙,右侧至生殖血管,内侧至肠系膜上静脉左侧,上侧显露胰头部及十二指肠各段,由尾侧至头侧解剖并分离肠系膜上静脉及其属支。②翻转至右结肠系膜前方,充分显露肠系膜上静脉在系膜表面的投影,在外科干远端右侧切开腹膜,并与已游离的右结肠后间隙相贯通,在系膜前方由尾侧向头侧解剖肠系膜上血管及其属支,并分别结扎相应血管。③视野转向横结肠上方,于胃网膜右血管弓外(扩大右半结肠切除时行胃网膜右血管弓内切除)离断胃结肠韧带,进入小网膜囊,分离右侧横结肠后间隙,与已游离的右结肠后间隙贯通,继续逆时针方向分离肝结肠韧带、升结肠侧韧带,进而完成整个右半结肠及系膜的充分游离。随后在患者体外完成右半结肠切除和回肠结肠吻合术。
1.4.2 头侧入路[5]手术要点 ①全面探查腹腔,牵拉大网膜,离断胃结肠韧带(胃网膜右血管弓外或扩大右半结肠切除行弓内切除)及大网膜右侧份,显露横结肠系膜前叶;于胰颈部沿胰腺下缘自左向右切开横结肠系膜前叶,进入融合筋膜间隙。 显露结肠中静脉、胃网膜右静脉、右结肠静脉和胰十二指肠前上静脉、外科干及胰颈下方肠系膜上静脉。施行腹腔镜右半切除术患者于与胃网膜右静脉汇合处离断右结肠静脉,结扎并切断结肠中血管右支;施行腹腔镜扩大右半结肠切除患者自根部游离并切断胃网膜右动脉,显露胰十二指肠前上静脉与胃网膜右静脉汇合处,并于根部切断十二指肠前上静脉,右结肠静脉与胃网膜右静脉汇合形成外科干留待后续处理,根部离断结肠中静脉。 ②视野转向横结肠下方。垂直提起横结肠系膜,游离并显露结肠中动脉和右结肠动脉,根部切断结肠中动脉(或其右支)和右动脉。依预定切除范围裁剪横结肠系膜,离断横结肠边缘弓血管。 横结肠系膜上下会师全程显露肠系膜上静脉外科干,施行腹腔镜扩大右半切除术患者于直视下根部结扎离断外科干。③辨识并提起回结肠血管,于其下方切开系膜,稍加分离,部分显露右侧融合筋膜间隙。游离并显露回结肠动静脉,并于根部分别结扎后切断;按预定切线离断末段回肠系膜及边缘血管。 进而沿融合筋膜间隙向外侧完成右侧结肠充分游离。随后在患者体外完成右半结肠切除和回肠结肠吻合术。
1.5 统计学处理
2 结果
2.1 两组患者术前一般资料的比较
两组患者术前一般资料的比较见表1。两组患者性别、年龄、体质量指数、卡式评分、ASA分级、肿瘤直径、术前肿瘤TNM临床分期、肿瘤部位、肿瘤形态数据统计学分析无显著差异,没有统计学意义(P>0.05)。

表1 两组患者术前一般资料的比较 (n=19)
2.2 两组患者术中及术后临床指标的比较
尾侧入路组手术时间明显少于头侧入路组,术中出血量也较头侧入路组少,两组差异有统计学意义(P<0.05)。见表2。尾侧入路组1例因损伤回结肠动脉出血而中转开腹,头侧入路组1例因肠系膜上静脉损伤出血而中转开腹,术中均无生殖血管损伤、输尿管损伤和十二指肠损伤。尾侧入路组 19例患者切除标本 CME 质量评价均为C 级,而头侧入路组有1例患者因胰头前区出血导致系膜切除不完整,CME 质量评价为 B级,18例为C 级。术后病理TNM分期:尾侧入路组Ⅰ期1例,Ⅱ期8例,Ⅲ期10例;头侧入路组Ⅰ期1例,Ⅱ期10例,Ⅲ期8例。尾侧入路组术后出现2例并发症,分别为切口感染和肺部感染,头侧入路组术后出现1例并发症,为术后淋巴管瘘,两组患者均无吻合口并发症和泌尿系并发症出现,均无围手术期死亡病例。两组患者术中血管损伤、中转开腹、标本质量评价、术后病理分期及术后并发症差异均无统计学意义(P>0.05)。
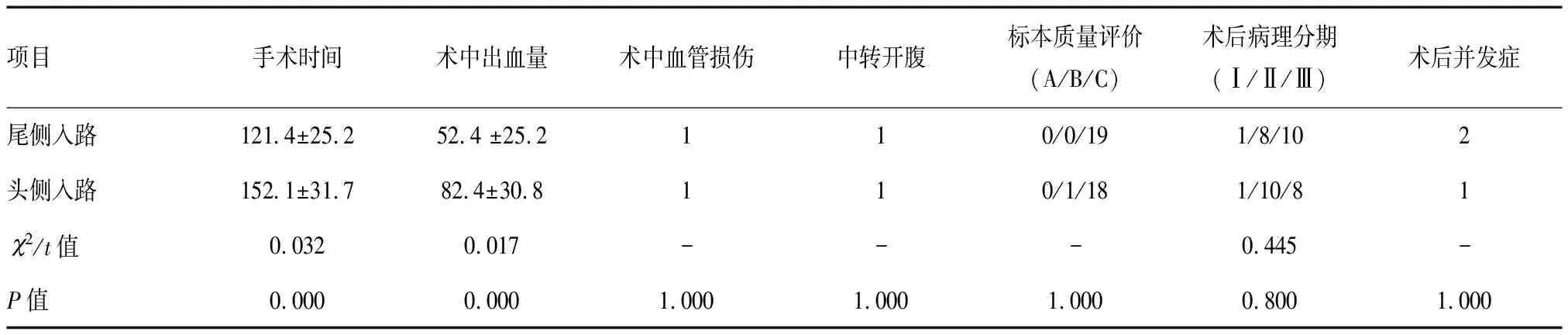
表2 两组患者术中及术后临床指标比较 (n=19)
3 讨论
在我国的肿瘤谱中,结肠恶性肿瘤有逐年增高趋势,发病多数与结肠的息肉、腺瘤及长期炎症、高胆固醇、脂肪、缺少纤维的饮食习惯、遗传等有关。随着腹腔镜微创技术的不断发展,与传统的开放式腹部手术相比,腹腔镜右半结肠切除术具有出血少、疼痛轻、胃肠道功能恢复快和术后住院时间短等明显优势,国内外大量研究结果表明,腹腔镜手术已经成为了结直肠癌根治术的金标准[1,6-7]。2009年,德国人Hohenberger等提出CME(Complete Mesocolic Excision)的概念,CME要求手术完整切除结肠系膜,从血管根部显露结扎血管,从而彻底清扫区域淋巴结。但哪一入路更易学习掌握行完整结肠系膜切除术存在争议[3]。
腹腔镜手术的关键在于合理的入路及手术平面。当前,腹腔镜右半结肠癌根治术多采用中间入路[2],也被认为目前较符合肿瘤学原则的手术入路方法[8]。由于腹腔镜右半结肠切除术涉及脏器多,右半结肠血管变异较大,手术风险高,技术难度大,中间入路法是由浅入深切开结肠系膜进入结肠系膜后叶与肾前筋膜的融合筋膜间隙,在解剖过程中无法预知深部结构,容易造成副损伤,容易进入错误的解剖间隙,深则可能误伤输尿管等腹膜后器官。浅则可能在结肠系膜内分离,容易引起出血和破坏结肠系膜的完整性。腹腔镜手术需要较长的学习曲线[9],因此,腹腔镜右半结肠切除术标准化,是缩短学习曲线的有效途径。众多外科医生对手术入路展开研究,试图寻找更佳的手术入路方案,使手术难度降低,更快更安全地完成手术。腹腔镜根治性右半结肠切除术分为头侧(腹侧面,即前面)入路与尾侧(腹侧面和背侧面,即前面或后面)中间入路[3]。
在腹腔镜右半结肠切除术中,如何更快和更准确地进入解剖平面,显露胃结肠干及胰腺分支,是手术的关键。头侧入路通常沿胃大弯中点前下横行切开大网膜前叶,进入网膜囊,显露横结肠系膜前叶;于胰颈部沿胰腺下缘自左向右切开横结肠系膜前叶,进入融合筋膜间隙。显露结肠中静脉、胃网膜右静脉、右结肠静脉和胰十二指肠前上静脉、外科干及胰颈下方肠系膜上静脉。右结肠静脉与胃网膜右静脉汇合形成外科干留待后续处理,根部离断结肠中静脉。视野转向横结肠下方。垂直提起横结肠系膜,游离并显露结肠中动脉和右结肠动脉,根部切断结肠中动脉(或其右支)和右动脉。依预定切除范围裁剪横结肠系膜,离断横结肠边缘弓血管。 横结肠系膜上下会师全程显露肠系膜上静脉外科干,施行腹腔镜扩大右半切除术患者于直视下根部结扎离断外科干。郑波波等[5]研究认为头侧入路更符合肿瘤学“NO TOUCH”原则;分离和切断结肠中静脉,可有效预防在分离结肠中动脉时发生意外损伤出血;由于约半数患者存在右结肠动脉,大多从前方跨过肠系膜上静脉,位于胃结肠静脉干的前下方,故先离断右结肠动脉有利于胰头前区的显露;充分显露胰头前区域(显露胃结肠静脉干),即以胰头前区域为中心的“耳型”解剖方案,可有效避免血管损伤,即使发生出血,亦容易判断来源并妥善处理,防止出现难以控制的大出血。但池畔[3]却认为头侧入路显露十二指肠降部与胰头,稍不慎可能扯断右结肠静脉,造成难以控制的大出血,亦可能损伤外科干其他分支,在止血过程中损伤肠系膜上静脉。因为其根部发出点通常距离胰颈下方2 cm,这个区域常有肠系膜上静脉向左分支至胰颈或小肠,在寻找解剖过程中如不慎损伤,常造成难以控制的大出血;且难以彻底清扫胰颈至结肠中动脉根部间的淋巴脂肪组织。如行扩大右半结肠切除术须经胃大弯弓上由内向外、由上向下分离,手术难度更大一些。
小肠系膜与右半结肠系膜是一个以肠系膜上动静脉为中心旋转的延续整体[10-11],系膜根部由左上方向右下方呈扇形附着于后腹壁,系膜后方是一层天然的、无血管的融合筋膜间隙,后方有输尿管、右侧髂血管;适当充分拓展融合筋膜间隙,肠系膜上动静脉及其属支在结肠系膜后方极易寻找,由尾侧至头侧解剖并分离肠系膜上静脉及其属支。融合筋膜间隙及横结肠系膜与胰十二指肠前筋膜间隙是两个重要的外科平面。利用腹腔镜的可旋转视角,我们先进入融合筋膜间隙,以肠系膜上血管为中心,由尾侧到头侧先解剖它的后方,再由尾侧向头侧解剖它的前方,从而达到游离与根治右半结肠的方法即为尾侧入路法。尾侧入路法由于坚持由远及近,非直接接触肿瘤的原则,符合肿瘤学原则,虽然一开始优先进入融合筋膜间隙,但其目的还是为了处理肠系膜上动静脉的属支做好前提准备,降低了手术难度及风险,尾侧入路组的手术时间、术中出血量均少于头侧入路组,可能与迅速进入融合筋膜间隙并明确肠系膜血管局部解剖有关,以小肠系膜和后腹膜的“黄白交界线”为入口,第一刀切开后便可直接进入融合筋膜间隙,而无需刻意去寻找融合筋膜间隙,从而最大限度保留所要切除系膜的完整,尾侧入路组CME 质量评价均为C级。
本前瞻性随机对照研究显示,两组入路法均是有效的手术方式,均可达到肿瘤根治性手术治疗目的,其中两组在中转开腹率、平均淋巴结清扫个数、术后标本质量评价及术后并发症上差异均无统计学意义。但是尾侧入路法较头侧入路法明显缩短手术时间并减少术中出血量,差异有统计学意义。我们认为腹腔镜胃肠外科医师在熟悉局部解剖和熟练掌握腹腔镜技能的前提下,尾侧中间入路较头侧中间入路简便、安全和易掌握[3],应积极采用尾侧入路法行腹腔镜右半结肠切除术,值得临床进一步推广、应用。
