腹主动脉瘤切除术和Bentall手术自体输血的应用分析
2019-01-07林静霞贺秋兰高旖鑫罗宏山周振海
林静霞 贺秋兰 任 俊 高旖鑫 罗宏山 周振海
根据国家、广东省、广州市卫健委的整体部署,自2018年3月31日开始全面停止临床用血互助献血。此时,自体输血(Autologous Blood Transfusion),尤其术中回收式自身输血的重要性越加明显。由于医疗技术的不断进步,更高难度或更具风险的手术也逐渐开展,意味着出现更多出血量大的情况,更加应该注重术中血液保护,尽可能选用自体输血[1]。自体输血的意义也是异体输血所不具有的,避免被动输入供血者的病原体和避免发生输血不良反应。本文针对目前腹主动脉瘤切除术伴人工血管置换术和Bentall手术的自体输血情况进行研究分析,探寻自体输血技术的更广泛和合理应用。
1 资料与方法
1.1 一般资料
选取中山大学附属第一医院2014年9月—2018年5月进行腹主动脉瘤切除术伴人工血管置换术和Bentall手术的患者。
1.2 方法
根据这两类手术术中失血情况,输注自体血或异体血情况,比较分析输注疗效。
1.3 两类心脏大血管手术
血管外科腹主动脉瘤几乎全由动脉粥样硬化引起,内膜增厚、变粗、溃破以及中膜的退行性变,使动脉壁不能耐受血流的不断冲击而逐渐膨胀、凸出,形成动脉瘤。手术是唯一有效的治疗。原则上所有情况良好的腹主动脉瘤患者都应手术,大多进行腹主动脉瘤切除术伴人工血管置换术。心脏外科主动脉夹层、马凡氏综合征、升主动脉瘤患者大多进行带主动脉瓣人工血管升主动脉替换术(Bentall手术),即应用带瓣人造血管替代升主动脉根部和主动脉瓣膜,并移植左右冠状动脉的手术[2]。这两类手术术中失血量较大,可以选用回收式自身输血。
1.4 主要观察指标
术中失血量、回输血量以及异体血输注量,术前和术后血常规中的红细胞计数(RBC)、血红蛋白(Hb)、血细胞比容(Hct)、白细胞计数(WBC)、血小板计数(PLT)的数据,出凝血功能中的凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fbg)的数据,肾功能的肌酐(Cr)数据。
1. 5 统计学方法
2 结果
2.1 腹主动脉瘤切除手术伴人工血管置换术或Bentall手术患者一般情况分析
我院2014年9月—2018年5月进行腹主动脉瘤切除手术伴人工血管置换术53例,5例患者进行单纯自体输血,17例患者进行自体加异体输血,19例进行单纯异体输血,12例零输血。其中,男44例,女9例;年龄17~81岁;体质量43~90 kg;手术时长140~930 min;术后住院时间7~48 d,其中2例于术后1天和5天后死亡;术中出血量100~14 000 mL;血型A型Rh(D)阳性10例,B型Rh(D)阳性10例,O型Rh(D)阳性28例,AB型Rh(D)阳性5例。见表1。进行Bentall手术40例,23例患者进行自体加异体输血,17例进行异体输血。其中,男28例,女12例;年龄21~70岁;体质量48~100 kg;手术时长285~1 020 min;术后住院时间9~67 d,其中1例于术后3天自动出院,出院情况极差,5例于术后2~32 d后死亡;术中出血量500~7 600 mL;血型A型Rh(D)阳性7例,B型Rh(D)阳性16例,O型Rh(D)阳性16例,AB型Rh(D)阳性1例。见表2。

表1 腹主动脉瘤切除手术伴人工血管置换术患者一般情况

表2 进行Bentall手术患者一般情况
2.2 腹主动脉瘤切除手术伴人工血管置换术患者自体输血和异体输血输注效果分析
进行腹主动脉瘤切除手术伴人工血管置换术患者分自体输血组(单纯自体输血或者自体加异体输血患者)22例和异体输血组(单纯异体输血组)19例。自体输血组,尽管术中平均失血量较大,进行自体血回输后,对异体血量需求大大减少。见表3。腹主动脉瘤切除手术伴人工血管置换术自体输血组手术前后血小板计数、出凝血指标的差异均具有统计学意义,而其他指标的差异不具有统计学意义。这一特点与异体输血组的一致,表明自体输血与异体输血对患者治疗效果方面无差异。见表4。

表3 行腹主动脉瘤切除手术伴人工血管置换术患者血量输注情况、手术时长、术后住院时间比较

表4 行腹主动脉瘤切除手术伴人工血管置换术患者血生化指标等比较
注:组内配对比较,1)t=6.539,P<0.05;2)t=-6.439,P<0.05;3)t=-3.987,P<0.05;4)t=8.047,P<0.05;5)t=8.458,P<0.05;6)t=-3.384,P<0.05;7)t=-2.561,P<0.05;8)t=6.270,P<0.05;其余均为P>0.05。RBC、WBC、PLT单位为×109/L
2.3 Bentall手术患者自体输血和异体输血输注效果分析
进行Bentall手术患者分自体输血组(自体加异体输血患者)23例和异体输血组(单纯异体输血组)17例。自体输血组,尽管术中平均失血量较大,进行自体血回输后,对异体血量需求大大减少。见表5。Bentall手术自体输血组手术前后血常规指标、出凝血指标和肾功能肌酐指标的差异均具有统计学意义。这一特点与异体输血组的基本一致,表明自体输血与异体输血对患者治疗效果方面无差异。见表6。
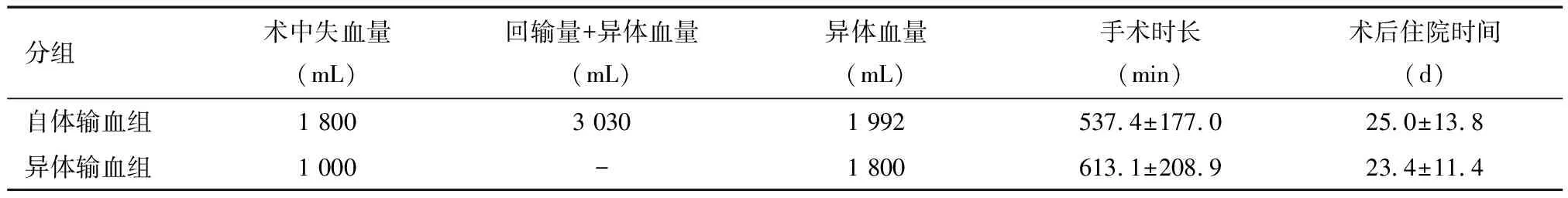
表5 行Bentall手术患者血量输注情况、手术时长、术后住院时间比较
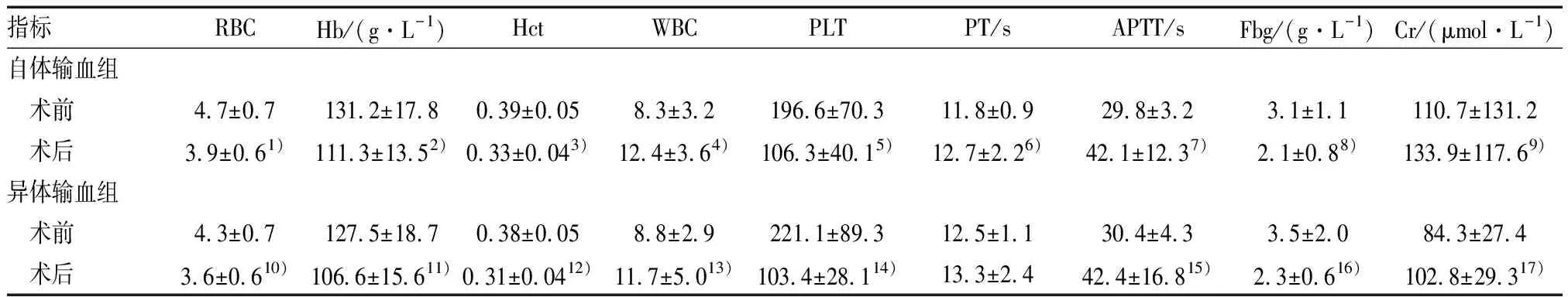
表6 行Bentall手术患者血生化指标等比较
注:组内配对比较,1)t=4.740,P<0.05;2)t=4.339,P<0.05;3)t=5.004,P<0.05;4)t=-4.351,P<0.05;5)t=8.038,P<0.05;6)t=-2.118,P<0.05;7)t=-5.132,P<0.05;8)t=4.191,P<0.05;9)t=3.944,P<0.05;10)t=3.704,P<0.05;11)t=3.536,P<0.05;12)t=4.341,P<0.05;13)t=-2.148,P<0.05;14)t=5.863,P<0.05;15)t=-3.086,P<0.05;16)t=2.582,P<0.05;17)t=-2.909,P<0.05;其余为P>0.05。RBC、WBC、PLT单位为×109/L
3 讨论
在2018年3月31日全面取消临床用血互助献血后,以及日益增长的用血需求的背景下,患者血液管理(Patient Blood Management, PBM)显得尤其重要。PBM是通过整合现有的血液保护技术和方法,包括各种药物、设备、技术、临床技巧来纠正术前贫血、减少围手术期失血和输血,达到最终改善患者预后的目的[3]。PBM,自2010年已经被世界卫生组织推荐,强调多学科联合实施血液保护管理措施。血液保护采用各种非药理的方法或联合应用多种技术保护(保存)患者自身的血液,以达到少输异体血、不输异体血的目的[4]。
血液保护最主要的方法是自身输血。自身输血是指采集或收集患者自身的血液或血液成分,经适当的保存或处理后回输给患者本人,以满足手术或紧急情况需要的一种临床输血治疗。自身输血操作简便、易行,可以缓解血液供应紧张,减少同种异体输血,还可避免输血传播疾病和同种异体免疫性输血反应,是一种合理、安全的输血技术。可分为储存式、回收式、稀释式自身输血三种。术中自体血回收是最常用的血液保护方法[5-6]。其中我院采用的方法为术中洗涤回收式自身输血:用负压吸引装置从创面将血液吸引至贮存器中,并用枸橼酸钠或肝素抗凝,然后经滤器过滤除去脂肪、组织碎片、游离血红蛋白等异物,当回收血液达到一定容积后给予离心、分离红细胞与血浆,然后用生理盐水洗涤收集的红细胞,移至血袋中,回输给患者。其洗涤废弃了血浆成分及异物,可以显著减少非洗涤方法以溶血为主的并发症。回收式自身输血适用范围广,对于估计胸腔、腹腔内积血或手术视野出血量超过1 000 mL者,均适合回收式自身输血,如心血管外科、胸腔外科、腹部外科、整形外科、骨科等手术术中失血量较大的患者,大动脉瘤破裂、异位妊娠、肝脏破裂、肝移植等大量内出血的患者,血液供应不足的战伤、外伤手术等[7]。也有禁忌症,如开放性创伤超过4 h的积血,或有明显的细菌、脓液、内毒素、胆汁及其他污染者不宜回收,恶性肿瘤、内脏穿孔、肝功能障碍等患者,在创面使用胶原止血剂的血液不宜回收。但是目前自体输血推广方面还存在以下问题:宣传力度不够;患者认知度较低; 耗材费用较贵,暂不能报销;住院时间可能延长;也可能出现输血感染的问题,导致自体输血接受度较低,自体输血率上升不明显。需要进一步提高医生和患者的认知度,同时要制定相应的政策进一步激励推广自体输血技术[8]。
随着医疗技术的不断进步以及设备的更新改良,体外循环(Extracorporeal Circulation,ECC)心脏手术的安全性越来越高,但其对红细胞、血小板以及凝血因子等血液成分的损坏仍无法避免[9],人体的血液经过体外循环转流,转流过程中各种物理、化学因素均可使血液的有形成分遭到不同程度的破坏,血液与异物界面接触且经过机器管道的挤压,细胞脆性增加,进而碎裂。我院心脏手术大多在体外循环下完成,手术时间长,患者失血量多,对血液的依赖程度高,尤其对于一些心脏大手术,主动脉夹层、马凡氏综合征、升主动脉瘤患者大多进行带主动脉瓣人工血管升主动脉替换术(Bentall手术),术中失血量更大,消耗大量的血液成分,输血总量平均达2 700 mL,另一类大血管手术,腹主动脉瘤患者大多进行腹主动脉瘤切除术伴人工血管置换术,术中失血量也较大,腹主动脉瘤破裂时需消耗大量的血液成分,输血总量平均达1 500 mL,而血液资源严重短缺的局面导致血源持续紧张,引发用血供需矛盾,此时自体输血的作用和意义凸显重要。近年来,人们也深入认识到异体输血潜在危险,自体输血也得到进一步推广。自体血回输不仅能够在一定程度上满足患者自身手术的用血需求,而且可以适当缓解血源短缺的压力,防止异体输血可能引发的输血不良反应和感染性疾病,具有重要的临床应用价值[10]。
心脏和血管外科的发展,心脏大血管手术数量逐年增加,临床用血供需矛盾日益突出,尤其对于稀有血型病例,或者一些疑难配型者,更是临床上的一大难题。因此,若自体血液回收技术能在临床上广泛采用,可以部分解决这些血源难题,降低手术备血风险。术中进行自体血回收适合于出血量较大的心脏大血管外科手术、腹胸腔内出血手术等[11-12],一般仅能回输术后6 h内的引流血液,大量回输时应适当补充凝血因子。有研究表明:术中自体血回输应用于外科手术患者中,有助于减少输血量,术中自体血回输量<1 200 mL时较为安全,若>1 200 mL则需给予必要止血措施,避免凝血功能出现障碍[13-14]。另有研究表明:心脏术后输血需求(TRACS)研究在心脏手术的患者中比较了限制性输血策略和自由输血策略的安全性,结果显示输血是临床并发症和30 d死亡率的独立危险因素,因此提倡限制性输血策略(Hb<70 g/L才输血)[15],采用限制性输血策略可以更有效地节约血液资源,降低输血不良反应、术后并发症以及死亡风险,值得临床医生大力推广应用[16]。
我院心脏和大血管病患者,如腹主动脉瘤切除术伴人工血管置换术、Bentall手术,很大可能出现大出血,失血量中位数达800或1 250 mL,应常规在手术中使用血液回收机,给患者回输自身血液,可以大大减少对异体血液的需求,且自体输血效果与异体输血效果无差异。目前这两种手术应用自体回收机的比例分别为41.5%和57.5%,使用率有待提高。术中回收式自体输血病例一般为出血量较大的患者,在回输自体血的基础上还需根据患者情况补充异体血液。
本研究自体血液回输与异体输血对比,具有以下优势:①大大节省了异体血液,这部分异体血液可以用于更有需要的贫血或不宜回输自体血患者,有限的血液资源得以更合理分配;②有利于血液有形成分的保护,库存红细胞悬液中几乎不含有凝血因子和血小板成分,而自体血中各种成分基本保持稳定,回输后可立即发挥携氧和止血功能,保护患者心肺功能,促进病情较快恢复;③自体输血比异体血液更安全,手续更简便,自体血液回输不会出现输错血型这个问题,同时可解决稀有或疑难血型病例的供血问题,避免了输注库存血液引起的输血不良反应以及血液感染性疾病等风险。
综上所述,针对术中出血量大且符合自体输血指征的手术,应常规应用血液回收机进行术中回收式自体输血,节约血液,保护患者免受输血不良反应和感染性疾病的危险,且治疗效果不比异体输血的差,提倡手术科室和麻醉科术中积极应用自体输血技术。
