胰岛素抵抗住院患者颈动脉斑块相关危险因素分析
2019-01-05杨丽红周欢欢孔维敏沈建平徐书杭楼青青
杨丽红,周欢欢,孔维敏,沈建平,支 灏,徐书杭,楼青青
1.南京中医药大学附属中西医结合医院健康教育科、心血管内科、内分泌代谢病区(南京210028);2.江苏省常州市第一人民医院心胸外科(常州213003);3.江苏省盐城市第一人民医院心内科(盐城224001)
我国心血管病患病率及病死率处于上升阶段,占居民疾病死亡构成的 40% 以上,为我国居民的首位死因[1]。胰岛素抵抗(Insulin resistance,IR)是指各种原因造成的胰岛素促进葡萄糖摄取和转化的效率降低,机体为保持血糖稳定代偿性地分泌过多的胰岛素,导致高胰岛素血症。已有研究表明,在糖耐量异常之前,IR与动脉硬化已有关联[2]。颈动脉斑块形成则是动脉硬化的典型标志,可反映动脉粥样硬化的程度[3],在其形成过程中,IR起到重要作用[4-7]。因此,胰岛素抵抗合并颈动脉斑块的动脉粥样硬化性心血管疾病风险极高,早期发现IR十分重要。本研究按照胰岛素抵抗指数(Homeostasis model assessment of insulin resistance,HOMA-IR)予以分组,旨在探讨胰岛素抵抗与颈动脉斑块之间的关系,为临床防治颈动脉斑块、预防大血管并发症的发生、发展提供参考意见。
对象与方法
1 研究对象 选自2014年9月至2015年7月在南京中医药大学附属中西医结合医院心血管内科行颈动脉超声的住院患者240例,其中男117例,女123例;年龄24~93岁,平均年龄(61.0±12.1)岁;有斑块者144例。排除心力衰竭急性加重期、急性心肌梗死、无严重肝、肾功能不全及感染性疾病、无恶性肿瘤、血液病、慢性结缔组织病及免疫性疾病。该项调查已征得受检者同意,并签署知情同意书。
2 检查方法
2.1 颈动脉超声检查:采用 PhiliPs iE-33 彩色超声诊断仪,探头频率 3~11MHz。研究对象于上午空腹进行颈动脉超声检查,取仰卧位,右侧自无名动脉分叉处、左侧从主动脉弓起始处开始,连续观察颈总动脉、颈内外动脉分叉处、颈内动脉、颈外动脉主干及分支。颈动脉内中膜厚度(Intima-media thickness,IMT)定义为腔内膜交界面至外膜上层之间的距离,以后壁值为标准,取六点平均值为IMT[8]。观察血管走行,管壁光滑程度,测量IMT,观察有无斑块。动脉粥样硬化所致血管壁结构的病理改变在二维超声显像下主要表现为:血管壁增厚及斑块形成。IMT≥1.2 mm且局部向腔内突出者定义为斑块[9]。
2.2 检测指标:所有患者入组后测量身高、体重、血压、血脂、空腹血糖(Fasting plasma glucose,FPG)及空腹血清胰岛素(Fasting serum insulin,FINS)浓度,行OGTT糖耐量实验。计算身体质量指数(BMI)、HOMA-IR和HOMA-β。HOMA-IR =空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22. 5,HOMA-β=20×空腹胰岛素水平mIU/L)/[空腹血糖水平(mmol/L)-3.5](%)。本研究采用HOMA-IR评估IR,80例糖耐量正常人群HOMA-IR上1/4位点值2.22来判定IR,HOMA-IR≥2.22判定为IR,HOMA-IR<2.22判定为无胰岛素抵抗。

结 果
1 一般资料比较 各组性别组成、年龄、身高、收缩压、舒张压、HOMA-β、TC、LDL-C、高血压、冠心病、中风、吸烟和喝酒差异均无统计学意义(P>0.05 );IR组的体重、BMI、2h血糖餐后2hPG、FPG、FINS、HOMA-IR、甘油三酯(TG)、斑块检出率、糖尿病、脂肪肝和高血糖均高于无IR组(P<0.05);IR组的HDL-C则低于无IR组 (P<0.05)。见表1。

表1 两组一般临床资料比较
2 颈动脉斑块与代谢指标的关系 见表2。显示颈动脉斑块与年龄、高血压发生率、冠心病、中风、糖代谢异常、空腹血清胰岛素和HOMA-IR呈正相关(P<0.05),即年龄越大、空腹血清胰岛素越高、胰岛素抵抗指数越高,糖代谢水平越差,颈动脉斑块发生率越高。
3 回归分析 以有无动脉斑块(无颈部斑块赋值0,有颈部斑块赋值1)为因变量,年龄、有无IR(无IR赋值0,有IR赋值1)、高血压、空腹血糖、空腹胰岛素和LDL-C作为自变量进行二元Logistic回归分析,结果显示与无IR人群相比,IR人群发生颈动脉斑块的OR值是1.960 (95%CI,1.119-3.431,P<0.05)。见表3。同时,年龄是颈动脉斑块形成的独立危险因素(OR,1.056,95%CI,1.029-1.084,P<0.001)。
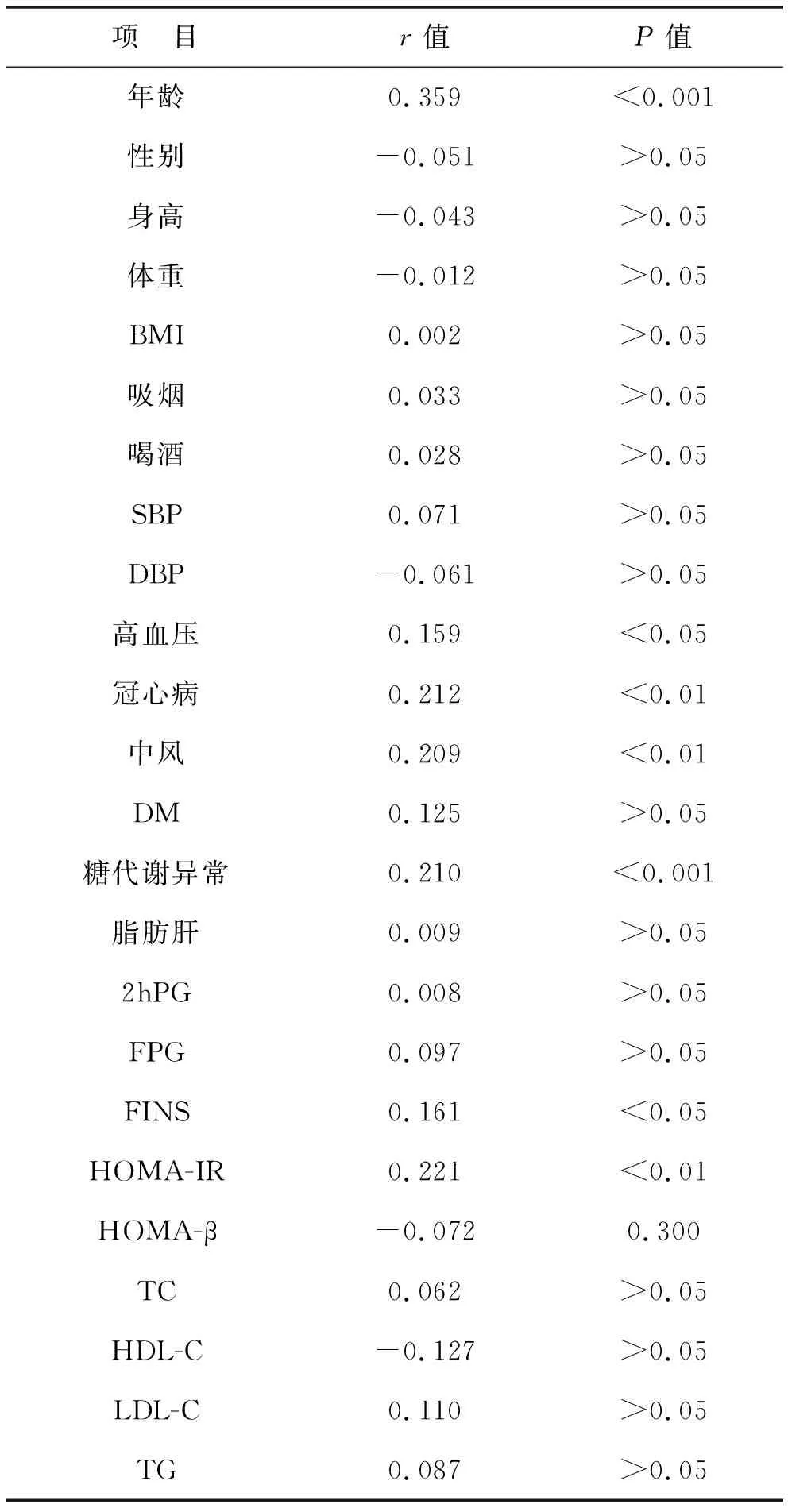
表2 颈动脉斑块与代谢指标的相关性
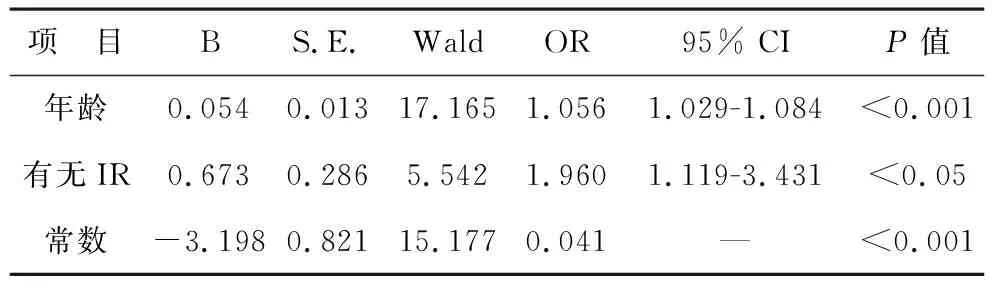
表3 颈动脉斑块与相关因素二元Logistic回归分析(n=240)
4 颈动脉斑块的危险因素 在无IR组,以有无颈动脉斑块为因变量,以年龄、高血压、HOMA-IR、血脂和糖尿病为自变量进行二元回归分析,结果显示年龄和LDL-C是无IR人群颈动脉斑块形成的独立危险因素,见表4;在IR组(n=110),以有无颈动脉斑块为因变量,以年龄、高血压、HOMA-IR、血脂和糖尿病为自变量,结果显示年龄、HOMA-IR和HDL-C是IR人群颈动脉斑块形成的独立危险因素,见表5。
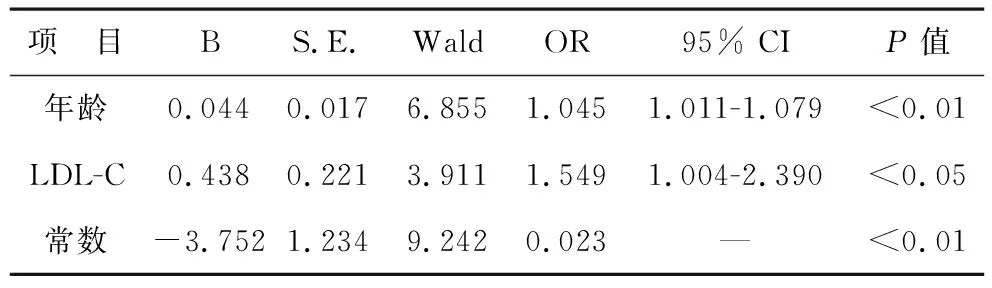
表4 无IR人群颈动脉斑块与相关因素 二元Logistic回归分析(n=130)
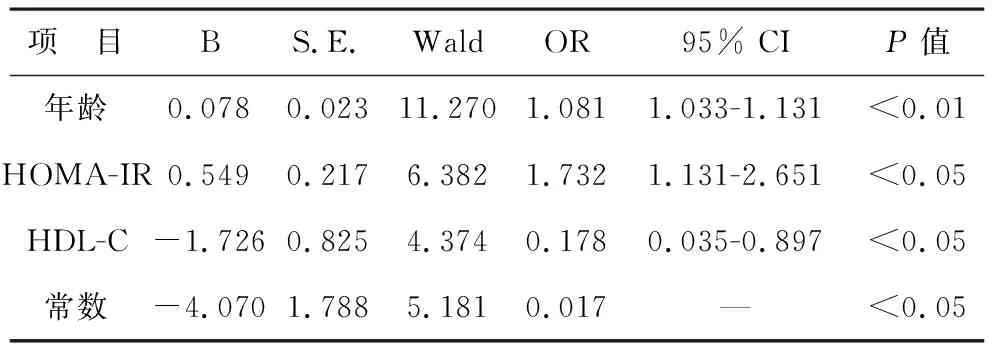
表5 IR人群颈动脉斑块与相关因素 二元Logistic回归分析(n=110)
讨 论
本研究显示,在胰岛素抵抗人群中,颈动脉斑块发生率为67.3%,高于Plichart等[10]研究的44.3%。这可能与本研究选择的研究对象人群不同有关,法国的多中心研究选择的是社区居民,而本研究选择的是住院的心血管内科和神经内科住院患者,合并多种心血管疾病,颈动脉斑块发生率相对较高;除此之外,还可能与样本量大小以及生活条件等因素有关。
进一步的Logistic回归分析发现,年龄不仅是IR人群,而且是无IR人群颈动脉斑块形成的重要独立危险因素。这与前人的研究结果一致[11-12]。提示老年人不管是否存在IR,体检时均应行颈动脉超声检查,及早发现 IMT增厚及颈动脉斑块,及早干预,降低动脉硬化性心血管疾病的发生风险。本研究进一步发现,IR人群发生颈动脉斑块是无IR人群的1.960倍,这说明胰岛素抵抗和年龄一样是颈动脉斑块形成的独立危险因素[4]。同时,本研究IR人群发生颈动脉斑块的OR值1.960高于Ishizaka等[13]研究的1.19,一方面可能与胰岛素抵抗程度值有关,本研究的HOMA-IR值是2.5±1.8,明显高于日本研究的1.57±1.20;另一方面可能与选择的人群有关,本研究选择的人群,糖代谢异常人群占66.7%,而Ishizaka等的研究选择的人群是糖代谢正常的人群。
本研究发现LDL-C是无IR人群颈动脉斑块形成的独立危险因素,降低的HDL-C是IR人群颈动脉斑块形成的独立危险因素,这表明高血脂和年龄、高血压、糖尿病一样是心血管疾病传统的独立危险因素[14]。本研究未发现HOMA-IR是无IR人群颈动脉斑块形成的危险因素,这与2000年的一项研究结果相反[15],这可能与研究样本量大小有关。然而,在IR人群中,HOMA-IR是颈动脉斑块形成的重要预测因素,OR值是1.732高于Ho等[12]研究1.48 (95%CI,1.11 -1.97,P<0.01),近似于Park等[16]研究发现的1.72 (95%CI,1.10-1.86),低于Xu等[17]的2.34 (95% CI,1.01-5.43,P= 0.047)。这一方面可能与所选样本人群不同有关,本研究人群选择的人群是包括糖代谢正常人群、糖尿病前期人群和糖尿病人群,而Ho等选择的人群是糖尿病前期人群;另一方面可能与年龄不同有关,本研究人群年龄是(61.0±12.1)岁高于Xu等的(52.8±4.4)岁;除此之外还可能与HOMA-IR值、BMI高低有关。
综上所述,本研究表明IR住院患者颈动脉斑块发生率高,IR人群颈动脉斑块发生风险是无IR人群的1.960倍。目前中医药治疗胰岛素抵抗在国内具有广泛的应用基础,多种复方或成药能在受体后缺陷多方面改善胰岛素抵抗[18]。因此,中药复方疗效不可忽视,为开展临床验证提供依据。无论是否存在胰岛素抵抗,年龄是不可控制的颈部斑块形成的危险因素。同时,除了升高的LDL-C和降低的HDL-C,HOMA-IR也参与了颈动脉斑块的形成。因此,除了关注年龄、高血脂这些传统的心血管疾病独立危险因素,筛查IR也可作为预防颈动脉斑块的指标。本研究是一项横断面调查,样本量偏少。今后仍需较大样本量证实研究结果。但本文为深入探讨胰岛素抵抗与颈动脉斑块提供了新的参考。
