华蟾酥毒基通过FAK/PI3K/Akt通路抑制食管癌Kyse-520细胞迁移和侵袭
2019-01-05盛杰霞王志美代二庆邓全军
盛杰霞,邓 旭,包 军,王志美,代二庆,邓全军
(1. 锦州医科大学中国人民武装警察部队后勤学院附属医院研究生培养基地,天津 300162;中国人民武装警察部队后勤学院附属医院2. 军人医疗保健中心、3. 消化内科,天津 300162)
食管癌是中国主要的公共卫生问题,是全球第八大常见癌症,也是癌症死亡的第六大常见原因[1],具有起病隐匿、进展迅速、治愈率差等特点[2]。早期手术切除是食管癌主要的治疗手段,大部分患者确诊时已进展至晚期,经常伴随全身多处转移,已错失最佳手术机会,因此,寻找有效防治食管癌侵袭和转移的药物刻不容缓。近年来,研究发现,许多传统中药的有效成分均有明显的抗肿瘤活性。中药蟾酥是中华大蟾蜍或黑眶蟾蜍耳后及皮肤分泌物经加工干燥而成,具有止痛、强心、抗菌、局部麻醉和抗肿瘤作用。华蟾酥毒基是来自蟾蜍皮肤的主要活性化合物,现有数据表明,华蟾酥毒基具有抗乳腺癌、肺癌、胰腺癌、结肠癌和肝癌的抗肿瘤活性[3-4],但是它在食管癌中的抗肿瘤机制少见报道。PI3K/Akt信号通路失衡是介导食管癌细胞发生侵袭迁移的重要分子机制[5],通过激活Akt调节下游信号分子,影响肿瘤细胞运动性和血管生成,局部黏着斑激酶(focal adhesion kinase, FAK)在这一过程中起调控作用[6]。因此,本研究以人食管鳞癌细胞株Kyse-520为研究对象,观察华蟾酥毒基对食管癌细胞体外增殖、侵袭和转移的影响,并探讨其作用机制是否与FAK/PI3K/Akt通路有关。
1 材料与方法
1.1材料
1.1.1细胞与试剂 人食管鳞癌细胞株Kyse-520购自中国科学院细胞库。华蟾酥毒基(批号3070,质量分数 ≥ 98%)购自上海诗丹得生物技术有限公司;CCK-8试剂盒(上海东仁化学科技有限公司);逆转录试剂盒、SYBR Mixture(康为世纪生物科技有限公司);胎牛血清(fetal bovine serum, FBS)、RPMI 1640培养基(美国Gibco);Matrigel胶、Transwell小室(Corning公司);总RNA提取试剂RNAiso Plus(北京宝日医生物技术有限公司);ECL化学发光试剂(美国伯乐公司);BCA蛋白定量试剂盒(索莱宝生物技术有限公司);FAK、PTEN兔抗人多克隆抗体、β-actin鼠抗人单克隆抗体、HRP标记的二抗(美国Proteintech公司);p-FAK(Tyr397)、Akt、p-Akt(Ser473)、血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)、基质金属蛋白酶9(matrix metalloprotein 9, MMP-9)、MMP-2兔抗人单克隆抗体(Abcam公司)。
1.1.2仪器 JuLITMStage实时细胞记录仪(韩国NanoEnTek公司);超微量分光光度计NP80(德国IMPLEN公司);PCR TCR0096(美国Thermo公司);M2型全波长酶标仪(美国MD公司);Power Pac Basic电泳仪、ChemiDocTMXRS+凝胶成像系统(美国伯乐公司)。
1.2方法
1.2.1CCK-8法检测细胞增殖活性 Kyse-520细胞按常规方法消化传代,并置于37 ℃、含5% CO2的培养箱中孵育。经预实验证实,含0.1%溶媒(DMSO)的培养液对细胞生长无明显影响。在96孔培养板中,每孔接种对数生长期的细胞悬液100 μL,设立对照组、药物组和仅含培养基的空白组,每组设5个复孔并孵育过夜。然后,空白组和对照组每孔补充新鲜的完全培养基100 μL,药物组每孔加入100 μL含有不同浓度华蟾酥毒基(0.025、0.1、0.4、1.6、6.4 μmol·L-1)的培养基,置于培养箱中分别孵育12、24、48 h。每孔加入10 μL CCK-8溶液,孵育4 h后,酶标仪测定450 nm处吸光度(A)值。按照公式计算细胞增殖率,细胞增殖率=(A药物组-A空白组)/(A对照组-A空白组)×100%。利用直线回归方程计算华蟾酥毒基不同作用时间的半数抑制浓度(IC50)值。实验独立重复3次。
1.2.2划痕愈合实验检测细胞运动性 Kyse-520细胞分别设立对照组和华蟾酥毒基(25、50、100 μmol·L-1)组,将密度为1×105·L-1的细胞均匀铺于6孔板中,培养箱中孵育16~24 h使其形成单层细胞。含1% FBS的培养基饥饿12 h后,用10 μL枪头在单层细胞中间划3条平行直线。PBS洗净划伤细胞,按实验分组加入含不同药物浓度的完全培养基,每孔选取5个固定位点进行实时监测,实时细胞记录仪置于含5% CO2的37 ℃培养箱中,设置6 h为1个循环,监测9个循环后,利用JuLITMStage系统软件进行开放伤口面积测量和百分比计算[7]。
1.2.3Transwell小室法检测细胞侵袭迁移能力 对数生长期的Kyse-520细胞,用含1% FBS的培养基饥饿12 h,然后加入含有不同浓度华蟾酥毒基(0、25、50、100 nmol·L-1)的完全培养基干预24 h。在Transwell迁移实验中,将孔径为8.0 μm的Transwell小室置于24孔板中。常规消化各组细胞,用无血清培养基制备细胞悬浮液,并以5×104/孔的细胞密度接种在Transwell上室中,同时在下室中加入600 μL含15% FBS的完全培养基。37 ℃培养24 h后,用镊子取出Transwell小室,PBS洗涤3次,100%甲醇室温固定30 min,0.1%结晶紫染色20 min,然后用湿棉签擦去滤膜上表面的未迁移细胞。在显微镜下,随机选取5个视野计数,计算迁移细胞数目的平均值,并进行统计学分析。
在侵袭实验中,Transwell小室上底面需要均匀涂覆60 μL用无血清RPMI 1640培养基1 ∶4稀释后的基质胶,置于培养箱中凝固1 h。其余步骤与Transwell迁移实验一致。所有实验独立重复3次。
1.2.4RT-qPCR检测基因mRNA表达水平 将Kyse-520细胞以5×105·L-1密度接种在6孔培养皿中,培养箱中继续孵育24 h。然后分别加入2 mL含有不同浓度华蟾酥毒基(0、25、50、100 nmol·L-1)的完全培养基干预24 h。收集各组细胞,采用TRIzol法提取细胞总RNA,应用超微量分光光度计NP80测定RNA纯度及浓度[8]。引物由上海生工生物工程有限公司设计合成(Tab 1)。按实验说明书进行cDNA合成,采用20 μL体系进行PCR扩增:2 μL cDNA,10 μL 2×UltraSYBR Mixture,6.8 μL RNase ddH2O和0.6 μL两种特异性引物(10 μmol·L-1);反应条件:95 ℃ 10 min预变性,95 ℃ 15 s和60 ℃ 1 min,进行40个PCR循环。反应结束时进行熔解曲线分析,以评估扩增的特异性。每个cDNA样本设置3个复孔,实验结果采用2-ΔΔCt进行相对定量,与对照组相比的倍数变化作为mRNA相对表达量。所有实验独立重复3次。

Tab 1 Primers used for RT-qPCR
1.2.5Western blot检测蛋白表达水平 融合度达80%的Kyse-520细胞用含不同浓度华蟾酥毒基(0、25、50、100 nmol·L-1)的完全培养基干预24 h。加入200 μL RIPA裂解液与1×酶抑制剂的混合液,冰上裂解30 min后,收集上清液。BCA法测定蛋白浓度,40 μg总蛋白加入12% SDS-PAGE凝胶中电泳分离。采用半干转膜法将蛋白转至PVDF膜,5%脱脂奶粉或5% BSA室温封闭1 h,分别加入1 ∶1 000~1 ∶2 000稀释的FAK、p-FAK,Akt、p-Akt、PTEN、VEGF-A、MMP-2、MMP-9和β-actin抗体,4 ℃孵育过夜,TBST洗涤3次后,加入相应HRP标记的二抗(1 ∶10 000稀释),室温孵育1 h。在成像系统上化学发光并对条带进行灰度值分析,β-actin作为内参,目的蛋白与内参灰度值的比值作为蛋白相对表达量。所有实验独立重复3次。

2 结果
2.1华蟾酥毒基抑制食管癌Kyse-520细胞增殖活性Fig 1的CCK-8结果显示,华蟾酥毒基以时间和浓度依赖的方式抑制食管癌细胞的增殖(P<0.05),其作用Kyse-520细胞12、24、48 h的IC50值分别是6.002、0.625、0.079 μmol·L-1。同时发现,同一作用时间下,华蟾酥毒基浓度低于0.1 μmol·L-1时细胞增殖活性下降较少,因此,选取25、50、100 nmol·L-1的华蟾酥毒基进行后续实验,以探讨其对Kyse-520细胞侵袭迁移能力的影响[9]。
2.2华蟾酥毒基抑制食管癌Kyse-520细胞的迁移癌细胞的迁移能力与肿瘤的侵袭和转移呈正相关[9]。划痕愈合实验结果表明(Tab 2、Fig 2),无论是6 h,还是48 h,各浓度华蟾酥毒基均能明显缩小划痕愈合面积(P<0.01),且随着时间的延长和药物浓度的增加,“伤口”逐渐增大,提示华蟾酥毒基抑制食管癌细胞的“二维”平面迁移,且该效应呈浓度和时间依赖性。不同浓度华蟾酥毒基干预24 h后,Transwell迁移实验结果显示(Fig 3),随着药物浓度的增加,Kyse-520细胞穿膜细胞数明显减少(P<0.01),提示华蟾酥毒基可明显抑制食管癌细胞的“三维”平面迁移,且存在明显的量效关系。
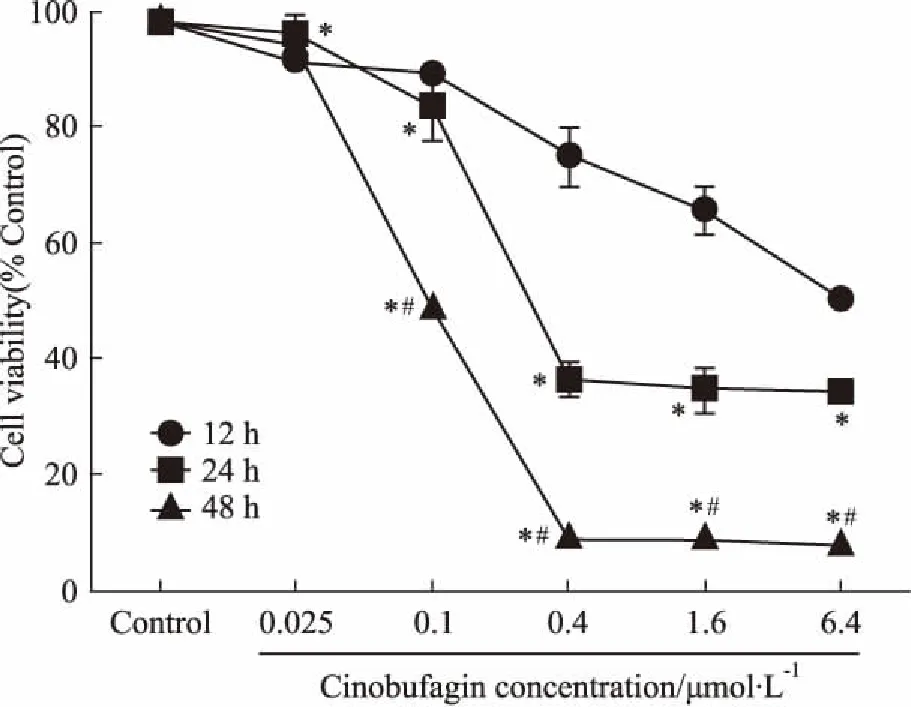
Fig 1 Effect of cinobufagin onproliferation of Kyse-520
*P<0.05vs12 h group at same concentration;#P<0.05vs24 h group at same concentration
2.3华蟾酥毒基抑制食管癌Kyse-520细胞的侵袭Matrigel基质胶可以一定程度上模拟癌细胞在体内侵袭环境中的细胞外基质[10],Transwell侵袭实验可以用来评估华蟾酥毒基对Kyse-520细胞侵袭能力的影响。Fig 3结果显示,与对照组相比,经25、50、100 nmol·L-1的华蟾酥毒基处理24 h后,Kyse-520的穿膜细胞数明显减少(P<0.05,P<0.01),且呈浓度依赖的方式,提示华蟾酥毒基可明显抑制食管癌细胞的侵袭能力。
2.4华蟾酥毒基对食管癌Kyse-520细胞中FAK/PI3K/Akt信号通路和侵袭转移相关蛋白mRNA表达的影响Tab 3的RT-qPCR结果显示,当华蟾酥毒基的浓度为50、100 nmol·L-1时,VEGF-A、MMP-2、MMP-9 mRNA表达明显下调,PTEN mRNA表达明显上调,与对照组相比差异有显著性(P<0.01),且呈一定的浓度依赖性,而FAK、Akt mRNA表达改变不明显。

Tab 2 Effect of cinobufagin on migration of Kyse-520 cells detected by wound healing
**P<0.01vscontrol group at the same time

Fig 2 Effect of cinobufagin on migration of Kyse-520 cells(×40)
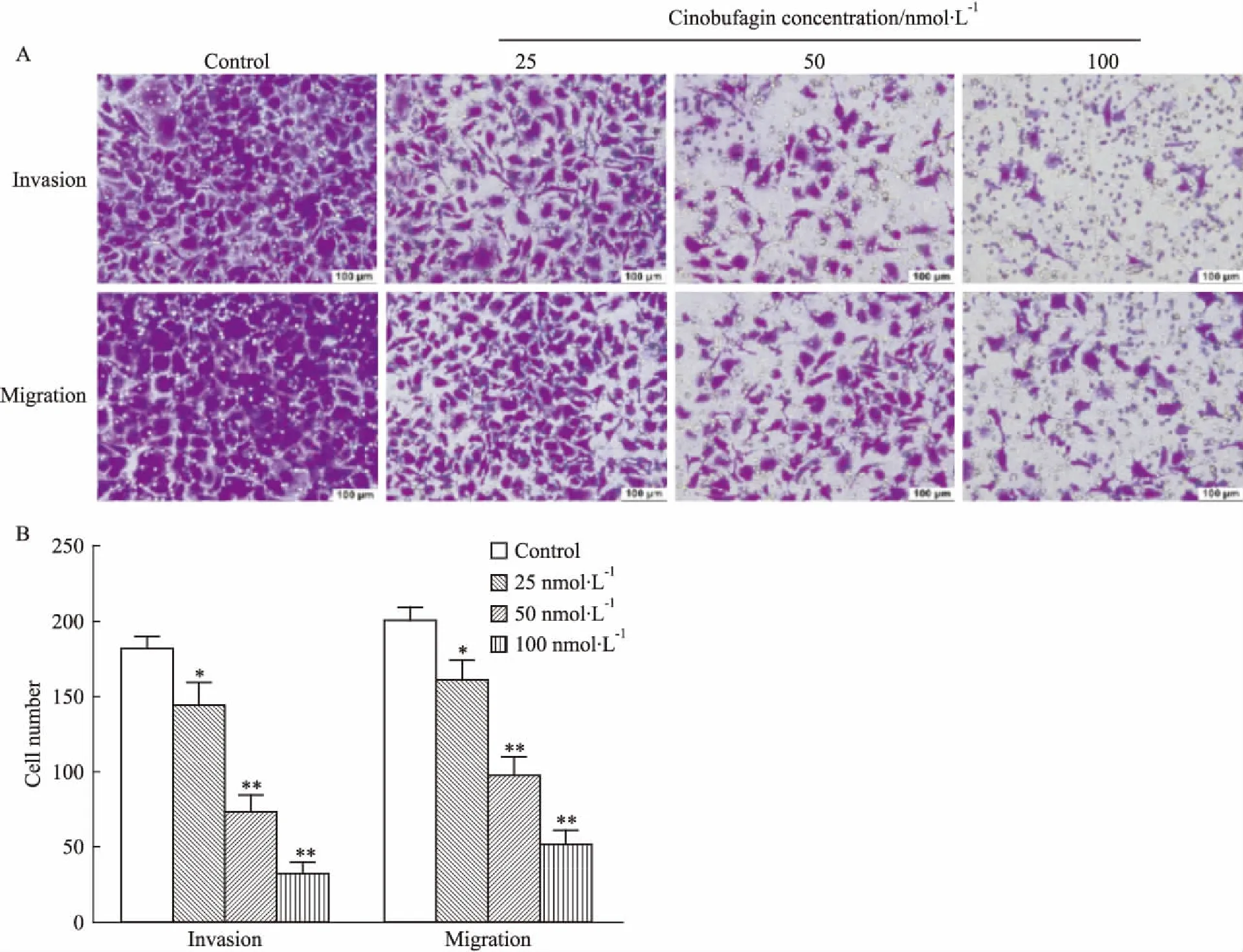
Fig3EffectofcinobufaginoninvasionandmigrationofKyse-520cells
*P<0.05,**P<0.01vscontrol group

Tab 3 Effect of cinobufagin on mRNA expression levels of FAK, Akt, PTEN, MMP-2, MMP-9 and VEGF-A in Kyse-520
*P<0.05,**P<0.01vscontrol group

Fig 4 Effect of cinobufagin on expression levels of relative proteins in Kyse-520 vs control group
2.5华蟾酥毒基对食管癌Kyse-520细胞中FAK/PI3K/Akt信号通路和侵袭转移相关蛋白表达的影响如Fig 4所示,当华蟾酥毒基的浓度为50、100 nmol·L-1时,与对照组相比,VEGF-A、MMP-2、MMP-9蛋白表达明显减少(P<0.05,P<0.01),PTEN蛋白表达明显上升(P<0.05),FAK和Akt总蛋白表达无明显变化。由于FAK/PI3K/Akt信号通路主要是通过磷酸化发挥作用[6],因此,Western blot检测了p-FAK(Tyr397)、p-Akt(Ser473)的表达,发现随着药物浓度的增加,二者磷酸化水平均明显下调(P<0.05,P<0.01),提示华蟾酥毒基可明显抑制FAK/PI3K/Akt信号通路。
3 讨论
食管癌是一种常见的消化道恶性肿瘤,进展迅速,并且经常伴随淋巴结和远端器官的转移。侵袭和转移是癌细胞最具代表性的生物学特性,它的发生包括多个复杂的过程,涉及众多信号通路,并且受到转录因子、生长因子、微环境等影响[11]。靶向抑制诱导癌细胞侵袭转移的信号途径作为治疗肿瘤的一个新的策略已被广大学者认同,这也可能是很多天然药物阻止或切断食管癌转移进程的作用机制。临床资料显示,华蟾酥注射液、片剂、胶囊等制剂针对恶性肿瘤的治疗取得很好疗效。大量实验室研究表明,其主要活性成分华蟾酥毒基的抗肿瘤机制可总结为抑制细胞增殖,诱导分化,促进凋亡,引起周期阻滞,抑制肿瘤血管生成,逆转多药耐药和调节免疫反应等[12]。同时体内外实验表明,华蟾酥毒基可以抑制结肠癌、骨肉瘤等恶性肿瘤的侵袭转移[3,13]。本研究也发现,华蟾酥毒基体外可明显抑制人食管癌Kyse-520细胞的增殖,即使是对细胞增殖活性影响较弱的浓度也可明显缩小划痕愈合面积,减少迁移和侵袭穿膜细胞数,提示其对食管癌细胞的迁移和转移具有明显抑制作用。
大量研究已经证实,抑制PI3K/Akt通路可以降低肿瘤细胞的侵袭迁移能力[14]。PI3K是由110 ku催化亚基和85 ku调节亚基组成的异二聚体酶,活化的PI3K磷酸化PIP2以产生PIP3,随后,PIP3积累并将Akt/PKB和PDK1募集到细胞膜上,被激活的Akt会使大量下游底物磷酸化,进而调控细胞迁移、周期进程、存活和代谢[15]。FAK是一种细胞质酪氨酸激酶,高水平的FAK诱导转移,并且与食管癌的不良预后相关。本研究采用RT-qPCR和Western blot检测华蟾酥毒基处理的Kyse-520细胞中FAK和Akt的表达水平,结果显示,FAK和Akt总蛋白及mRNA表达无明显变化,进一步检测其磷酸化水平,发现华蟾酥毒基可明显下调p-FAK(Tyr397)和p-Akt(Ser473)。众所周知,基质金属蛋白酶可以降解基底膜和细胞外基质,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用,MMP-2和MMP-9是其中最重要的一类。VEGF家族直接或间接地与肿瘤转移有关,而VEGF-A可以激活静息血管内皮细胞,诱发血管生成并促进肿瘤细胞迁移。有研究证实,FAK通过激活PI3K/Akt通路,调节VEGF-A、MMP-2和MMP-9的活性,促进血管生成、细胞迁移和侵袭[8]。本研究也发现,华蟾酥毒基浓度依赖性地降低VEGF-A、MMP-2和MMP-9的转录和翻译水平。上述结果提示,华蟾酥毒基通过FAK/PI3K/Akt信号通路,下调VEGF-A、MMP-2和MMP-9的表达,进而抑制食管癌的迁移和侵袭。
PTEN是一种双重脂质蛋白磷酸酶,是FAK/PI3K/Akt信号通路负调控因子。正常情况下,PTEN与PI3K的功能相反,可以通过去磷酸化将PIP3转变为PIP2;同时,PTEN还具有特异性蛋白磷酸酶功能,通过下调FAK酪氨酸磷酸化,抑制整合素介导的细胞浸润、转移及生长,进而抑制癌细胞迁移扩散和黏附[10]。在鼠胚胎干细胞或人癌细胞系中,PTEN功能的丧失导致PIP3的积累,模拟PI3K激活的作用,并激活其下游效应物PDK1、Akt和Rac1/CDC42[15]。本研究也显示,华蟾酥毒基在削弱FAK磷酸化和抑制PI3K/Akt活化的同时,明显增加Kyse-520细胞中PTEN的表达。
综上所述,华蟾酥毒基通过诱导PTEN表达,负调控FAK/PI3K/Akt途径,下调VEGF-A、MMP-2和MMP-9的表达,进而抑制食管癌细胞的迁移和侵袭。
(致谢:本实验在武警后勤学院附属医院救援医学研究所完成,感谢课题组老师同学们的协助。)
