TGF-α作为体-肺分流性肺动脉高压诊断生物标志物的研究
2019-01-05孟刘坤郑美丽刘晓艳
袁 雯,孟刘坤,李 君,郑美丽,李 鹰,刘晓艳
(1. 首都医科大学附属北京朝阳医院医学研究中心,北京 100020;2.中国医学科学院北京协和医学院国家心血管病中心阜外医院心血管疾病国家重点实验室,北京 100037;3. 首都医科大学附属北京朝阳医院心脏中心,北京 100020)
人体的血液循环包括两部分,即体循环和肺循环。生理状态下,体循环为高压系统,肺循环属于低压系统,尽管两者的起点和终点都是心脏,但两者的血流在心脏内并无直接的交通和分流。在心脏和大动脉出现畸形和缺损时,可发生体-肺循环分流和继发肺动脉高压(pulmonary arterial hypertension, PAH)。体-肺分流性PAH是一种肺循环血流量增多引起肺小动脉收缩、进行性重构的致死性疾病[1]。一直到目前,右心导管仍然是评价体-肺分流性先天性心脏病相关PAH (congenital heart diaseas associated PAH, CHD-PAH)及血流动力学改变的金标准,但是,右心导管是有创检查,可能引发严重的并发症,存在一定的风险。超声心动图虽是一种无创检测方法,然而其估测的肺动脉压力值存在较大的误差。因此,寻找能协助诊断先天性心脏病PAH的生物标志物意义重大。
转化生长因子α(transforming growth factor alpha, TGF-α)是由50个氨基酸残基组成的糖蛋白,可由巨噬细胞、肺泡隔细胞、气道上皮细胞、成纤维细胞、血管内皮细胞、平滑肌细胞等合成和分泌[2-4]。TGF-α属于表皮生长因子(epidermal growth factor, EGF)家族的一员,与细胞表面的表皮生长因子受体(epidermal growth factor receptor, EGFR)结合后,激活受体上的酪氨酸激酶,促使细胞内DNA的合成,从而引起细胞增殖、分化等一系列反应。我们近期研究发现其在分流性PAH大鼠及CHD-PAH病人血浆中的浓度均较对照组明显升高,有望成为体肺分流性PAH的诊断生物标志物。
1 材料与方法
1.1实验动物♂SD大鼠, 体质量(280±20)g, 30只, 购于北京维通利华实验动物技术有限公司,生产许可证号: 2016-0006。术前、术后所有实验动物均在北京朝阳医院实验动物中心清洁级动物房中饲养。
1.2体-肺分流性PAH大鼠模型的构建体-肺分流性PAH大鼠模型的构建方法同之前的报道[5-6]。20只SD大鼠随机分为联合手术8周组(combined surgery group reserving for 8 weeks postoperatively, CSG-8W,n=10)和联合手术12周组(combined surgery group reserving for 12 weeks postoperatively, CSG-12W,n=10),腹腔注射戊巴比妥钠(35 mg·kg-1)进行麻醉。
右肺动脉结扎:大鼠取左侧卧位,经口气管插管(16号套管针,BD公司)呼吸机(Inspria ASVP, Harvard Apparatus, Hilliston, Mass, America)辅助呼吸,右侧第3肋间入胸腔,仔细解剖出右肺动脉并结扎,逐层关胸;停止呼吸机辅助呼吸,带气管插管自主呼吸。大鼠呼吸平稳后,拔出气管插管。
左侧颈部分流:右肺动脉结扎术1周后,行左侧颈部分流术。仰卧位固定大鼠,分离并暴露左颈总动脉和颈外静脉;用显微缝合线将颈外静脉悬吊到邻近的颈部肌肉上以阻断静脉血回流;用微血管钳夹住颈总动脉近心端,结扎远心端;在分叉前截断颈总动脉,并立即用肝素生理盐水(105U·L-1)冲洗,断端用10/0显微缝线缝合一针做牵引线,牵引左侧颈总动脉穿过长约2 mm的18G套管(18号套管针,BD公司),然后翻转固定于套管;将颈总动脉残端通过颈外静脉前壁的横向切口旋转并插入腔内,结扎;通过分流部位的持续震颤、明显扩张和颈外静脉近端部分的颜色变化,直观地判断分流部位血流的通畅。最后,将悬垂的缝线和血管夹按顺序移除,逐层缝合切口。
1.3假手术组假手术组(sham operation group, SOG,n=10)大鼠的处理也分两个步骤,除了不结扎右肺动脉和不进行左侧颈部分流术外,其余操作完全同CSG-8W与CSG-12W组。
1.4术后处理分流术后d 2开始给予阿司匹林(北京曙光药业有限责任公司生产,75 mg·kg-1·d-1)和氢氯噻嗪(天津力生制药股份有限公司生产,25 mg·d-1)以防止吻合口闭塞和肺水肿。
1.5肺血流动力学指标的测量在分流术后8周、12周行肺血流动力学指标的检测。使用生理记录仪(Power Lab 16/30,AD Instruments, New Zealand)测量大鼠肺动脉压力的改变[7],将13 cm长、尖端弯曲的聚乙烯右心导管(外径0.9 mm)用肝素生理盐水预充后,一端连于Powerlab16/30,一端缓慢送入右侧颈外静脉;逆时针缓慢旋转右心导管,缓慢推进,逐渐进入右心房,右心室和肺动脉主干,右心导管的具体位置以典型压力波形和波幅来确定;测量过程中,同时记录右心室收缩压(right ventricular systolic pressure, RVSP)、肺动脉收缩压(pulmonary arterial systolic pressure, PASP)、平均肺动脉压(mean pulmonary arterial pressure , mPAP)。
1.6大鼠静脉血的采集与储存右心导管测压完成后,用采血针和EDTA抗凝采血管从下腔静脉采血4~5 mL;4 ℃静置0.5 h后,3 000 r·min-1离心15 min;吸取上清,分装并保存于-80 ℃冰箱备用。
1.7右室肥厚指数的计算取出心脏,用生理盐水冲洗,把左、右心房及相连的大血管去除,将右心室(right ventricular, RV)、左心室(left ventricular, LV)及室间隔(interventricular septum, IVS)剪下来,滤纸吸干表面水分后称重。右室肥厚指数(right ventricular hypertrophy index, RVHI)的计算公式如下:RVHI=RV/(LV+IVS)。
1.8先天性心脏病病人血液标本的收集与储存病人纳入标准:纳入阜外心血管病医院2013年7月至2016年1月入院治疗,并经超声心动图证实的先天性心脏病患者49例,其中不合并PAH患者(CHD组)24例,合并PAH(CHD-PAH组)患者25例。PAH的诊断标准为静息状态下经右心导管检测的平均肺动脉压≥25 kPa。同时入选20例年龄、性别相匹配的健康志愿者作为对照组(CON组,病人基本信息见Tab 1)。所有病人及健康志愿者均签署知情同意书。静脉抽取CON组志愿者、CHD和CHD-PAH组患者2 mL血液,4 ℃静置0.5 h后,3 000 r·min-1离心15 min;吸取上清,分装并保存于-80 ℃冰箱备用。
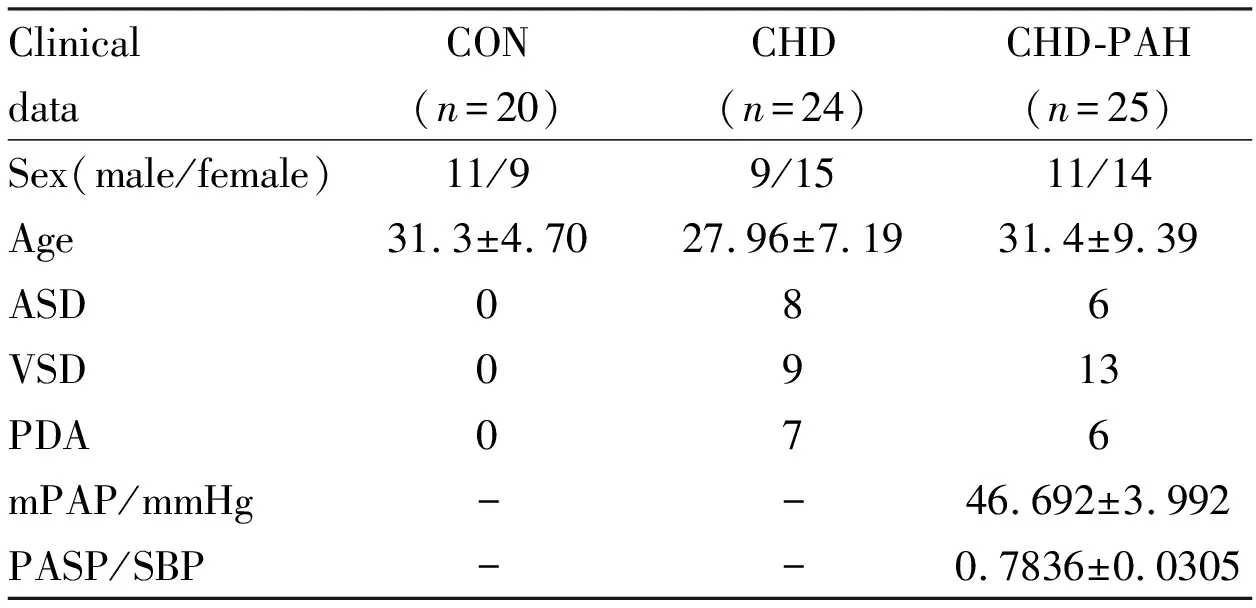
Tab 1 Characteristics of patients involved in this study
ASD:atrial septal defect;VSD:ventricular septal defect;PDA:patent ductus arteriosus;PASP/SBP:pulmonary artery systolic pressure/systolic blood pressure
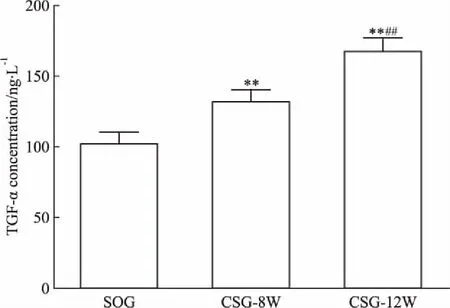
Fig 1 Plasma concentration of TGF-α increased withprogression of systemic-to-pulmonary shunt-induced PAH
**P<0.01vsSOG;##P<0.01vsCSG-8W

Tab 2 Hemodynamics and right ventricular hypertrophy index of rats
**P<0.01vsSOG;##P<0.01vsCSG-8W
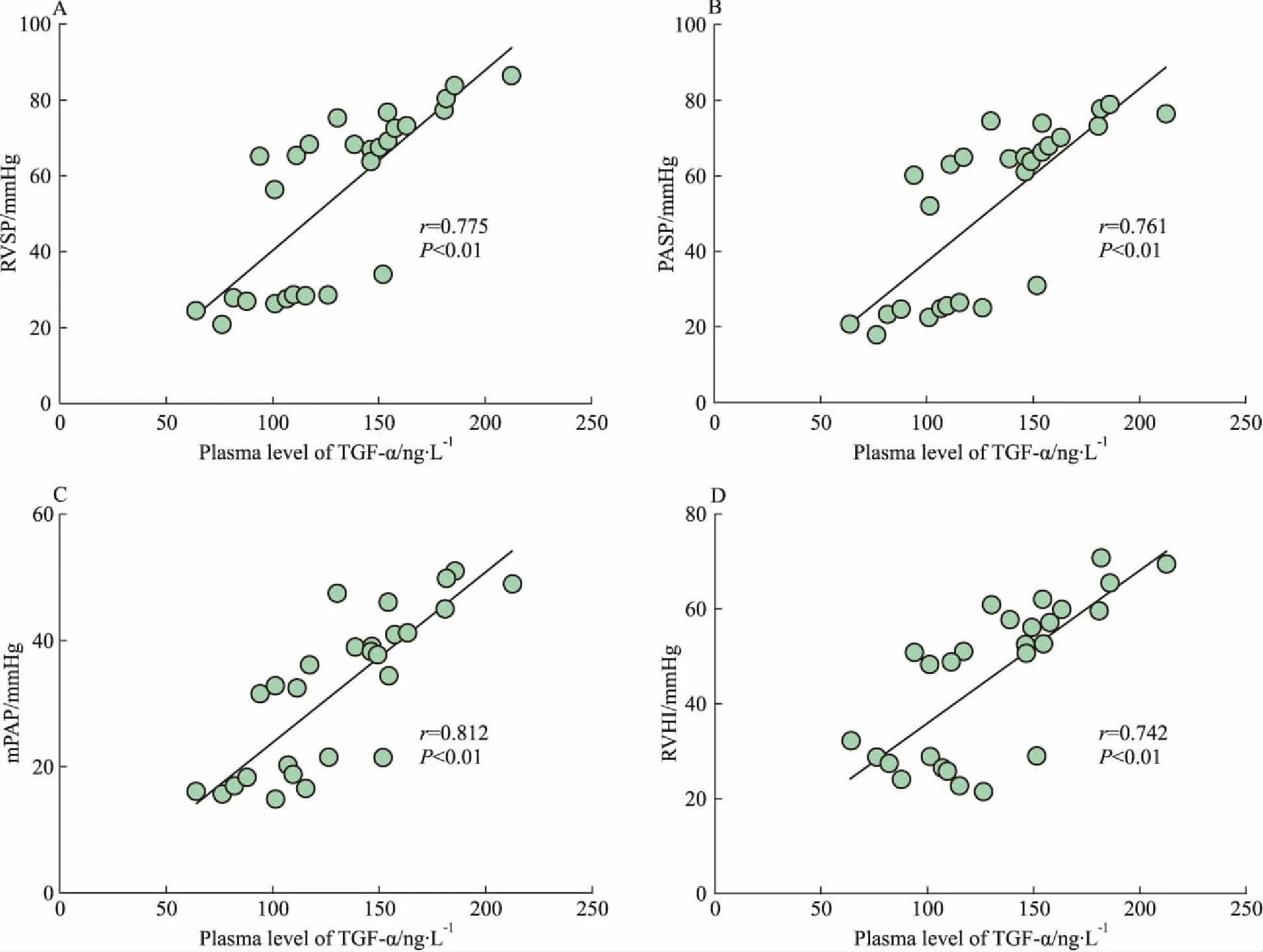
Fig 2 Plasma TGF-α concentration correlated with RVSP, PASP, mPAP and RVHI in rats
A: RVSP; B: PASP; C: mPAP; D: RVHI,1 mmHg=0.133 kPa
1.9大鼠血浆TGF-α浓度的测定大鼠血浆TGF-α浓度的测定使用CUSABIO公司的双抗体夹心法ELISA试剂盒(货号:CSB-E07289r),检测范围3.12~200 ng·L-1。具体操作按照试剂盒说明书进行。
1.10人血浆TGF-a浓度的测定病人血浆中TGF-α浓度的测定使用Abcam公司的双抗体夹心法ELISA试剂盒(货号:ab100646),检测范围1 370~106pg·L-1。具体操作按照试剂盒说明书进行。

2 结果
2.1动物存活情况动物造模过程中未发生手术操作相关死亡。术后有3只大鼠死亡,其中CSG-8W组1只,CSG-12W组2只,尸检发现此3只大鼠是由于右心衰竭。其余动物均存活至实验终点。
2.2模型大鼠血流动力学和右室肥厚指数的评估颈部手术完成后8周(CSG-8W组)和12周(CSG-12W组),与SOG组比较,CSG-8W和CSG-12W组的RVSP、PASP及mPAP均明显升高,且这种升高表现为一种分流时间依赖性(Tab 2)。此外,与SOG组相比,CSG组的右室肥厚指数表现出明显的分流时间相关性的升高,说明联合手术的方式能明显诱导肺血流动力学指标的升高和右心室的肥厚,动物模型构建成功。
2.3TGF-α在分流性PAH大鼠血浆中的表达变化ELISA结果显示,TGF-α在体-肺分流性PAH大鼠血浆中的浓度较假手术组明显升高,具有分流时间依赖性(Fig 1)。Spearman线性回归分析显示,大鼠血浆TGF-α浓度与右心导管测定的右室收缩压(r=0.775,P<0.01,Fig 2A)、肺动脉收缩压(r=0.761,P<0.01,Fig 2B)、平均肺动脉压(r=0.812,P<0.01,Fig 2C)及右室肥厚指数(r=0.742,P<0.01,Fig 2D)均呈明显正相关。
2.4TGF-α在体-肺分流性CHD-PAH病人血浆中的表达变化ELISA检测结果表明,TGF-α的血浆浓度在先天性心脏病合并PAH组(CHD-PAH)较先天性心脏心病不合并PAH组(CHD)及正常对照组(CON)均明显升高,而CHD组与CON组之间TGF-α的血浆浓度差异无显著性(Fig 3A)。血浆TGF-α的浓度为314 ng·L-1时,诊断CHD-PAH的敏感度为0.760,特异度为0.750,ROC曲线下面积0.895(P<0.01,Fig 3B)。
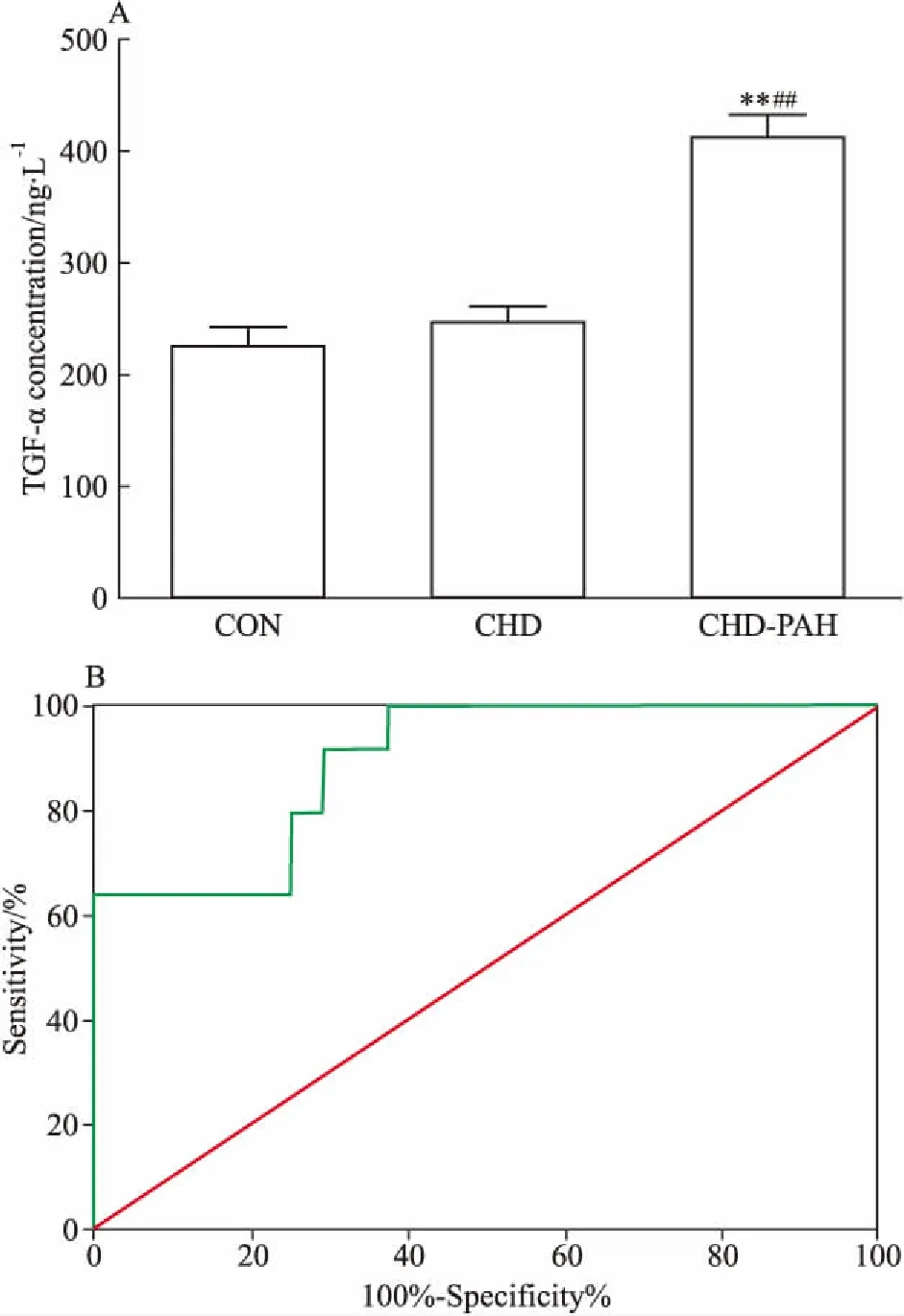
Fig 3 Plasma concentration of TGF-α in CHD patients
A:The plasma concentration of TGF-α in CHD-PAH patients was significantly higher than that of CON and CHD group, while there was no significant difference between CON and CHD group.**P<0.01vsCON group;##P<0.01vsCHD group. B: Receiver operating characteristic(ROC) curve for TGF-α in diagnosis of CHD-PAH.
3 讨论
CHD-PAH主要是由体-肺循环分流导致的肺循环血流量增多,引起肺小动脉收缩、进行性重构的致死性疾病,病变范围涉及血管全层,以肺血管阻力渐进性升高和肺小血管丛状病变为特征,并逐渐导致右心负荷过重、衰竭和死亡。CHD-PAH 在各种原因引起的PAH中占10%~20%[9],是继特发性PAH、结缔组织病相关PAH后的第三大类PAH,严重威胁着人类的健康。右心导管是诊断PAH的金标准,然而,导管是一种有创的技术,会增加病人的风险。因此,寻找一种无创、可靠的CHD-PAH诊断方法是CHD-PAH基础及临床研究中亟待解决的问题。
作为一种分泌型的蛋白质,TGF-α可作为多种肿瘤相关疾病的生物标志物。Nievergall等[10]发现,血浆TGF-α的水平可以鉴别在治疗的第1年未能获得早期分子反应或进展的慢性骨髓性白血病病人。当TGF-α与肿瘤坏死因子受体II(tumor necrosis factor receptor Ⅱ, TNFR-Ⅱ)、基质金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase 1, TIMP-1)和 C反应蛋白(C-reactive protein ,CRP)合用时,这4个因子是高危黑色素瘤病人生存率重要的预测因素[11]。在晚期非小细胞肺癌病人中,血浆高浓度TGF-α预示了埃罗替尼治疗对病人是无益的[12]。Shim等[13]的结果表明,结直肠癌病人术前血清中TGF-α的水平明显高于对照组,而通过外科手术将肿瘤切除后,病人血清中的TGF-α水平较术前明显降低。此外,TGF-α的血清浓度在各个阶段的胃部、胰腺、结肠、直肠肿瘤病人及晚期食管癌病人中,均较健康对照组明显升高[14]。然而,TGF-α在CHD-PAH病人血浆中的浓度变化尚不明确。
为了明确TGF-α作为CHD-PAH生物标志物的可行性,我们首先用联合手术的方法构建了体-肺循环分流性PAH大鼠模型。右心导管检测的肺血流动力学指标(RVSP、PASP、mPAP)以及右室肥厚指数(RVHI)均在分流手术后8周、12周明显升高,提示动物模型构建成功。ELISA结果显示,TGF-α的血浆浓度随分流时间的延长逐渐升高,并且与肺血流动力学指标及RVHI均呈明显正相关。这些结果在动物水平表明了TGF-α的血浆浓度与PAH的程度具有正相关,可能作为分流性PAH的生物标志物。
然后,我们检测了TGF-α在CHD-PAH病人血浆中的浓度变化。与我们的预期一致,TGF-α的血浆浓度在CHD-PAH病人中较CHD组及CON组均明显升高。血浆TGF-α的浓度为314 ng·L-1时,诊断CHD-PAH的敏感度为0.760,特异度为0.750,ROC曲线下面积0.895(P<0.01)。这就进一步表明,血浆TGF-α水平很可能是诊断CHD-PAH较敏感和特异的生物标志物。
综上所述,本实验结果表明,TGF-α的血浆浓度在体-肺分流性PAH发生、发展过程中逐渐升高, 血浆中TGF-α的水平可能是诊断体-肺分流性PAH潜在的生物标志物。
(致谢:本实验完成于首都医科大学附属北京朝阳医院医学研究中心,实验过程中得到研究中心全体老师和同学的帮助,在此表示感谢。)
