UPLC法同时测定何首乌中2个蒽醌糖苷
2019-01-04母茂君李成功张海珠
母茂君,李 杨,李成功,刘 衡,谭 鹏,周 浓,张海珠,*
(1.大理大学药学与化学学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000;3.成都市食品药品检验研究院,成都 610045;4.重庆三峡学院生物与食品工程学院,重庆 404120)
何首乌又称赤首乌、马肝石等,始载于《开宝本草》,是蓼科植物何首乌PolygonummultiflorumThunb.的干燥块根,主产于湖北、贵州、四川等地。根据炮制方法不同分为生首乌和制首乌,生首乌具有截疟、润肠通便的功效;制首乌具有补肝肾、益精血的功效〔1〕。民间常用作为补肾乌发、延年益寿之药。何首乌中主要含蒽醌类、二苯乙烯苷类和磷脂类成分〔2〕。现代研究表明何首乌中的结合性蒽醌,如大黄素-8-O-β-D-葡萄糖苷具有益智、抗衰老和促进学习记忆作用〔3-4〕。目前有关何首乌药理作用及机制研究的报道较多,但是有关何首乌中蒽醌糖苷定量方法的研究较少,阻碍了何首乌的质量标准提升。
本研究基于超高效液相色谱法建立何首乌药材中大黄素-8-O-β-D-葡萄糖苷和大黄素甲醚-8-O-β-D-葡萄糖苷含量同时测定方法,并对不同产地的何首乌药材中的大黄素-8-O-β-D-葡萄糖苷和大黄素甲醚-8-O-β-D-葡萄糖苷进行了定量检测,考察其含量分布的差异性,以期为何首乌药材的质量评控提供一种新的方法。
1 仪器与试药
1.1 仪器Waters ACQUITY超高效液相色谱仪,美国Waters公司,配备有二极管阵列检测器,自动进样器,Empower 2色谱工作站;XS-205电子天平,AL-204电子天平,METTLER TOLEDO公司;超声仪,南京新辰生物科技有限公司,40 KHz。
1.2 试药大黄素-8-O-β-D-葡萄糖苷(批号23313-21-5,纯度以98.45%计,由深圳菲斯化工有限公司提供);大黄素甲醚-8-O-β-D-葡萄糖苷(批号131012,纯度以98.41%计,由成都克洛玛生物科技公司提供)。甲醇、磷酸为色谱纯,美国Fisher公司;水为超纯水,其余试剂均为分析纯。
1.3 药材16批次何首乌药材购买于不同省份,粉碎,过四号筛,备用。
2 方法与结果
2.1 色谱条件与系统适用性试验以WatersBEHC18柱(1.7 μm,2.1 mm×100 mm)为分离柱,VanGuard Pre-Column(1.7μm,2.1mm×5mm)为保护柱;以甲醇(A)-0.1%磷酸水溶液(B)为流动相;流速为0.2 mL∕min;梯度洗脱条件为:0~5 min:55→63(A),5~9 min:63→70(A);检测波长为280 nm;柱温为30℃;理论塔板数按大黄素-8-O-β-D-葡萄糖苷峰计算应不低于7 000。
2.2 对照品溶液的制备以色谱级甲醇作溶剂,精密称取大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷对照品适量,配制成浓度为66、48 μg∕mL的混合对照品溶液(先用0.5 mL二甲基亚砜溶解,再用甲醇定容至刻度)。
2.3 供试品溶液的制备取何首乌药材粉末(过四号筛)约0.2 g,精密称定,置锥形瓶中,精密加入甲醇25 mL,称定重量,超声1 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,用0.22 μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.4 仪器精密度考察取混合对照品溶液,按上述含量测定方法连续进样6次,每次2 μL,记录峰面积,计算RSD值。结果大黄素-8-O-β-D-葡萄糖苷峰面积RSD为0.53%,大黄素甲醚-8-O-β-D-葡萄糖苷峰面积RSD为1.15%,表明仪器的精密度良好。
2.5 线性关系考察取混合对照品溶液,分别精密吸取对照品混合液0.5、1.0、1.5、2.0、2.5、3.0 μL注入液相色谱仪,按上述色谱条件测得峰面积。以进样量(μg)为横坐标(X),峰面积(A)为纵坐标(Y)绘制标准曲线。结果表明,大黄素-8-O-β-D-葡萄糖苷一次进样量在0.033~0.198 μg范围内与峰面积呈良好的线性关系,回归方程和相关系数为Y=9.8×105X-1 462,r=0.999 5;大黄素甲醚-8-O-β-D-葡萄糖苷进样量在0.024~0.144 μg范围内与峰面积呈良好的线性关系,回归方程和相关系数为:Y=6.4×105X-1 148,r=0.999 1。
2.6 重复性考察取同一批供试品(6号供试品)粉末0.20 g,共6份,精密称定,按“2.3”项下制备供试品溶液,进样测定,每次2 μL,记录峰面积,计算含量。结果样品中大黄素-8-O-β-D-葡萄糖苷含量的平均值为0.42%,RSD为1.27%;大黄素甲醚-8-O-β-D-葡萄糖苷含量的平均值为0.18%,RSD为1.86%;表明供试品含量测定重复性良好。
2.7 准确度考察(加样回收率试验)取锥形瓶6个,分别精密加入新配制的大黄素-8-O-β-D-葡萄糖苷对照品溶液(66 μg∕mL)6.36 mL、大黄素甲醚-8-O-β-D-葡萄糖苷对照品溶液(48 μg∕mL)3.75 mL,减压回收溶剂至干,再精密称取已知含量供试品(6号供试品粉末,大黄素-8-O-β-D-葡萄糖苷含量为4.2 mg∕g,大黄素甲醚-8-O-β-D-葡萄糖含量为1.8 mg∕g),各称取约0.10 g,分别精密称定,按“2.3”项下制备供试品溶液。进样测定,按下式计算回收率。

测定结果为6份供试品中大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷的平均加样回收率分别为98.44%、95.37%,RSD分别为1.35%、2.41%,表明本方法具有较好的回收率,测定方法可靠。
2.8 供试品溶液稳定性考察取“2.3”项下供试品溶液,间隔0、2、4、8、16、24 h测定1次,进样2 μL,记录峰面积,计算RSD。结果大黄素-8-O-β-D-葡萄糖苷的RSD为0.76%,大黄素甲醚-8-O-β-D-葡萄糖苷的RSD为0.89%,表明供试品溶液在24 h内稳定,能满足测定需要。
2.9 供试品含量测定取不同产地何首乌药材粉末各0.20 g,按“2.3”项下制备样品溶液,进样2 μL,记录峰面积,计算样品中的含量。见表1。对照品溶液和供试品溶液色谱图见图1。
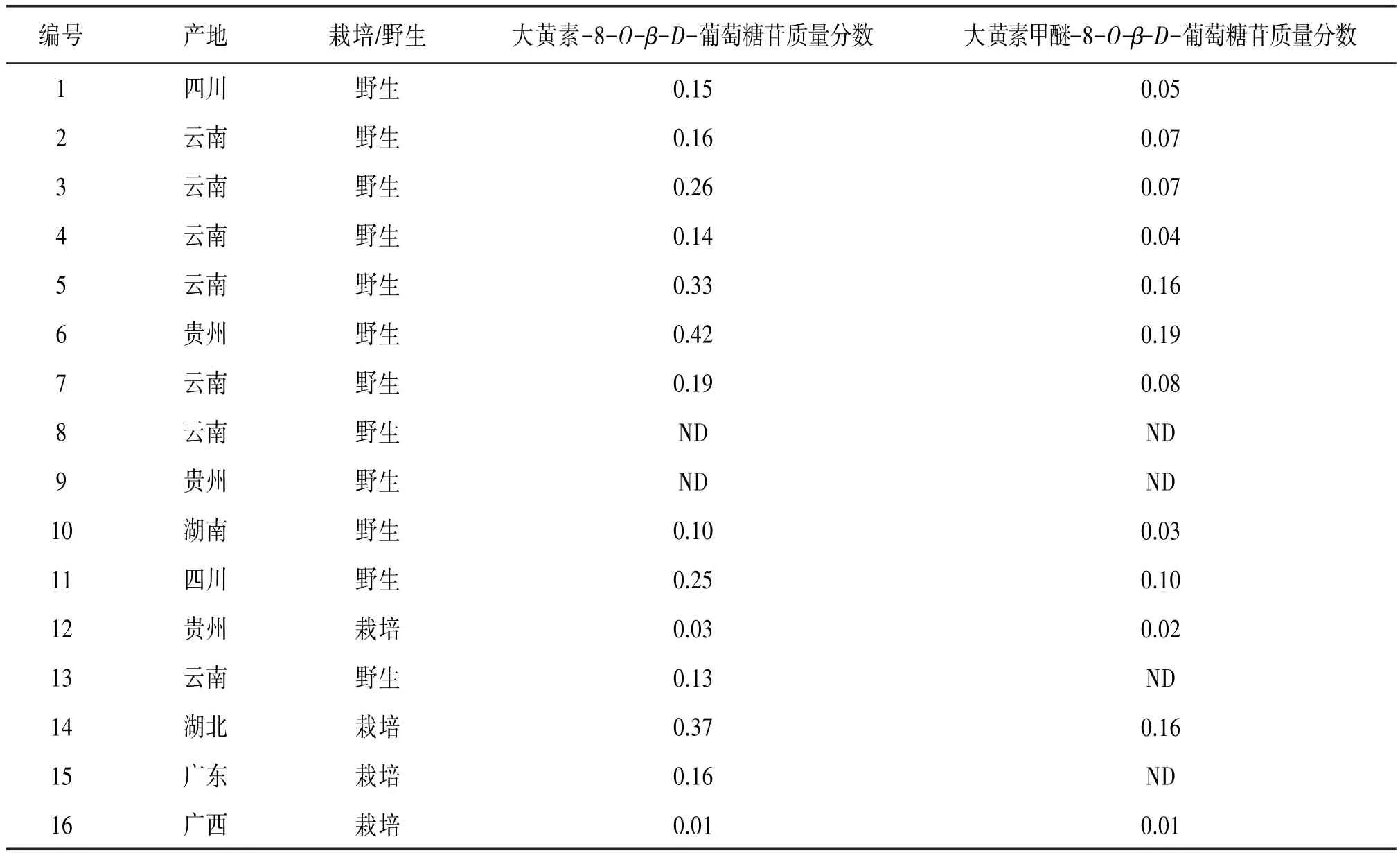
表1 不同产地何首乌药材供试品含量测定结果(n=3,%)
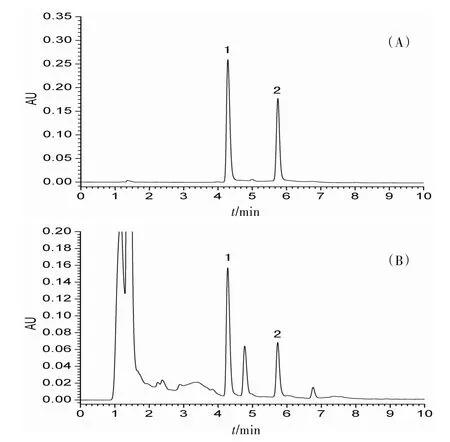
图1 对照品溶液(A)与供试品溶液(B)的UPLC图
3 讨论
实验过程中对混合对照品溶液采用DAD检测器在200~410 nm波长内扫描,结果显示大黄素-8-O-β-D-葡萄糖苷在281 nm处具有最大吸收,大黄素甲醚-8-O-β-D-葡萄糖苷在271 nm处具有最大吸收。实验过程中分别以乙腈-0.1%磷酸水溶液(30:70)、甲醇-0.1%磷酸水溶液(55:45)、甲醇-0.1%磷酸水溶液为流动相;流速为0.2 mL∕min;柱温为25、30、35℃,分别进行试验研究。综合考虑供试品中杂质对目标峰峰纯度的干扰、基线噪音、出峰时间及色谱峰形的优化,最终选择上述梯度洗脱条件,检测波长280 nm,在该色谱条件下,大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷与杂质峰分离效果良好,保留时间适中;通过二级管阵列检测器对供试品峰纯度检测,峰纯度角度小于峰纯度阈值,均为符合要求的纯峰,峰纯度检测见图2。
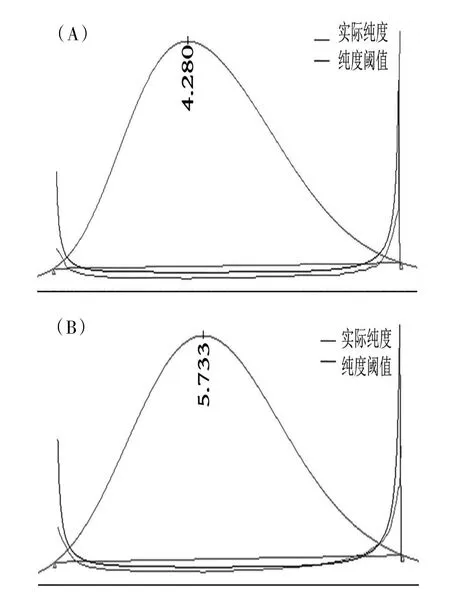
图2 供试品中色谱峰纯度图
测定结果显示,16批次不同产地的何首乌药材中大黄素-8-O-β-D-葡萄糖苷的含量差异较大,从贵州遵义购买的1批野生何首乌药材(6号供试品)中含量最高达到0.42%,而从云南、贵州购买的2批野生何首乌药材(8、9号供试品)未检测出大黄素-8-O-β-D-葡萄糖苷。另外从何首乌药材中大黄素甲醚-8-O-β-D-葡萄糖苷的含量来看,普遍在0.2%以下甚至未检测出。或许这暗示可以用大黄素-8-O-β-D-葡萄糖苷和大黄素甲醚-8-O-β-D-葡萄糖苷作为指标性成分来区分何首乌药材品质的优劣。
由于近年来不断出现服用何首乌导致肝损伤病例的报道〔5-6〕,引起社会的广泛关注,药学工作者对其肝损伤机制机理也作了大量研究〔7-11〕。目前对何首乌药材的药理作用和质量控制研究大多集中在二苯乙烯苷类成分上,对何首乌中结合性蒽醌苷类定量检测的研究甚少。如何更加科学地评控何首乌药材的质量对保障临床安全用药具有重要的意义。何首乌作为传统补益类中药,亟须建立跟其补益功效相关的指标性成分的含量测定方法。2015年版《中华人民共和国药典》通过间接法测定结合蒽醌的含量显得比较繁琐〔12〕,本实验首次建立了超高效液相色谱法同时直接测定何首乌药材中2个结合性蒽醌糖苷含量的方法,该法简便、精确、快速,能在6 min内快速完成2个成分的含量测定,为何首乌药材的质量控制提供了一个参考方法。
