马尾藻岩藻聚糖分离纯化及对HepG2细胞胆固醇含量的影响
2019-01-03刘海韵谌素华王维民黄娟娟廖森泰
刘海韵 谌素华,2 王维民 黄娟娟 廖森泰
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东省水产品加工与安全重点实验室,广东 湛江 524088;3. 广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610)
中国马尾藻资源丰富,主要分布在西沙群岛、南沙群岛、硇洲岛、海南岛、涠洲岛等海域中,且分布在近海岸,易获得[1]。岩藻聚糖是马尾藻的主要活性物质,具有降血脂[2]、抗氧化[3]、抗癌[4]、抗肿瘤[5]、抗病毒[6]、抗凝血[7]、抗血栓[8]、提高免疫力[9]等作用,其生物活性与硫酸根的位置及数量有直接的关系[10]。有研究表明海藻中提取的岩藻聚糖可以有效地降低血清中胆固醇含量,如Park等[11]研究表明岩藻聚糖通过调节SREBP-2以调节肝脏中胆固醇和甘油三酯合成的关键酶的表达来改善血清脂质水平;Uehara等[12]研究表明ATP结合盒转运子ABCA1是细胞内胆固醇逆转运的重要调节因子,也是促进胆固醇逆转运(RCT)过程中的关键转运体和受体,主要介导血管壁上的巨噬细胞或其他细胞内的胆固醇及磷脂流出,促进RCT,调节脂代谢紊乱;谌素华等[13]通过建立高脂血症小鼠模型,研究了马尾藻岩藻聚糖对脂代谢相关酶和胆固醇合成关键酶的影响,研究表明岩藻聚糖能够显著增加血清卵磷脂胆固醇酰基转移酶(LCAT)、肝脂酶(HL)、脂蛋白脂酶(LPL)和肝脏LCAT、LPL活性,增加脂蛋白代谢的关键酶,加速总胆固醇(TC)和低密度脂蛋白(LDL)的分解代谢,或通过抑制胆固醇合成酶HMG-CoA还原酶降低胆固醇的合成。
采用常规水提方式提取岩藻聚糖的分子量较大,不易被生物吸收利用,其活性也往往不佳[14],所以将纯化的岩藻聚糖降解后再进行相关活性研究越来越受到关注。蔡璐[15]1-2采用酸降解法获得了低分子量的岩藻聚糖组分,并且用于小鼠的体内试验。但酸降解法有污染较重、反应条件难以控制、硫酸基损失较大且降解结束后必须纯化以除去酸等不足[16],不利于进一步的活性研究,所以本研究拟采用污染小、更高效、硫酸基保护效果优异[17-18]的基于过氧化氢-抗坏血酸体系的自由基氧化降解法[19-20]得到低分子量的岩藻聚糖。本研究拟采用体外培养细胞的方式探讨各不同组分对HepG2细胞胆固醇含量的影响,以期与小鼠体内试验形成相互对照。由于动物体内的脂质代谢途径十分复杂,不确定因素太多,所以并不能仅仅依靠小鼠体内试验就能完全定论岩藻聚糖具有良好的降血脂活性,还需要体外细胞试验来进一步论证。所以还采用不同分子量的岩藻聚糖,以期使试验结果具有更多的延展性,能够更为全面地论证岩藻聚糖的降血脂活性。本研究旨在为治疗高胆固醇病症提供一定的理论基础,同时为马尾藻资源利用及岩藻聚糖生物活性开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
亨氏马尾藻:2017年3月采摘于广东湛江硇洲岛海域,将采摘的亨氏马尾藻除去烂叶、黄叶、根等不可食部分,反复用自来水冲洗干净,在50 ℃烘干后粉碎,过80目筛,干燥后装袋贮藏备用;
HepG2人体肝癌细胞:北纳创联生物技术有限公司;
DEAE C-52纤维素、BCA蛋白浓度测定试剂盒:北京鼎国昌盛生物科技有限公司;
Superdex 75葡聚糖凝胶:美国通用电气公司;
DMEM培养液、FBS(胎牛血清)、PS(双抗)、PBS磷酸缓冲液、DMSO(二甲基亚砜)、0.25%胰蛋白酶-EDTA溶液、MTT(噻唑蓝):西格玛奥德里奇公司;
组织总胆固醇试剂盒:南京建成生物工程研究所。
1.1.2 主要仪器设备
电子天平:AW120型,日本岛津公司;
真空冷冻干燥机:FD8508型,韩国Ilshin公司;
CO2培养箱:MC0175型,日本三洋电机株式会社;
智能型倒置荧光显微镜:DMI4000B型,德国徕卡微系统有限公司;
全自动酶标仪:Varioskan Flash型,美国热电公司。
1.2 试验方法
1.2.1 粗多糖的制取 将过筛后的马尾藻粉按料液比1∶30(体积比)配成溶液,以60 ℃、350 W超声50 min,然后在80 ℃的恒温水浴浸提3.5 h。弃去沉淀,45 ℃旋转蒸发浓缩。加乙醇至体积分数为30%,滤除沉淀;继续加乙醇至体积分数为80%,取沉淀用丙酮和无水乙醇交替洗涤各2次。将沉淀用少量水溶解,按多糖溶液∶Sevag试剂=5∶1(体积比)的比例加入Sevag试剂(氯仿∶正丁醇=4∶1,体积比)进行脱蛋白。透析并真空冷冻干燥[15]13得粗多糖。
1.2.2 DEAE C-52纤维素阴离子交换层析 将DEAE C-52纤维素用蒸馏水清洗干净,装入2.6 cm×60 cm的玻璃层析柱,至距离柱顶约5 cm处时停止装柱,以蒸馏水平衡柱子。称取200 mg粗多糖溶于20 mL蒸馏水,依次用蒸馏水和1.3,2.3,3.0 mol/L NaCl 进行分级洗脱。流速为1 mL/min,分步收集(5 mL/管),以硫酸—苯酚法在490 nm处跟踪检测,分别收集洗脱峰,直至无糖组分流出,依吸光度对洗脱液管号作图,得到洗脱曲线。合并相同峰位组分,透析48 h除盐,45 ℃ 旋转蒸发浓缩,真空冷冻干燥[21]13得到HF0、HF1、HF2和HF3,其得率分别为13.98%,67.80%,17.04%,0.24%。
1.2.3 过氧化氢—抗坏血酸体系氧化降解 称取回收率最高的HF1组分300 mg,加入20 mL蒸馏水溶解,于30 ℃的恒温水中加入0.103 6 g抗坏血酸,边搅拌边加入2%的过氧化氢1 mL,另称取300 mg的HF1,加入20 mL蒸馏水溶解,于30 ℃的恒温水中加入0.259 0 g抗坏血酸,边搅拌边加入5%的过氧化氢1 mL,加完后开始搅拌计时,反应2 h后3 600 r/min离心10 min,弃沉淀,透析72 h后经45 ℃旋转蒸发浓缩,真空冷冻干燥[21]13得到HDF1和HDF2。
1.2.4 Superdex 75葡聚糖凝胶层析 将Superdex 75葡聚糖凝胶用蒸馏水清洗干净,装入1.6 cm×80 cm的玻璃层析柱,至距离柱顶约5 cm处时停止装柱,以已过0.22 μm微孔滤膜的0.5 mol/L NaCl平衡柱子。将得率较高的HDF2用适量蒸馏水溶解,以已过膜的0.5 mol/L NaCl为洗脱液,洗脱速度为6 s/滴,每管收集3 mL,用苯酚—硫酸法测定吸光值,确定峰的变化,收集同一峰的多糖组分,经过透析、45 ℃旋转蒸发浓缩、真空冷冻干燥[21]14得到HDF21和HDF22。
由于HF0为中性多糖组分,无理想生物活性,HF2、HF3回收率不高,HDF2全部用于了Superdex 75葡聚糖凝胶层析。所以本研究最终选择HF1、HDF1、HDF21和HDF22 4种组分做进一步研究。
1.2.5 化学成分分析
(1) 多糖含量测定:苯酚—硫酸法[22]。
(2) 硫酸基含量测定:氯化钡—明胶比浊法[23]。
(3) 岩藻糖测定:半胱氨酸盐酸盐法[24]。
(4) 葡萄糖醛酸含量测定:改良的咔唑比色法[25]。
1.2.6 HepG2细胞培养试剂配置
(1) 完全培养液:89% DMEM+10% FBS+1% PS。
(2) 细胞冻存液:50% DMEM+40% FBS+10% DMSO。
(3) 5 mg/mL MTT:称取25 mg MTT溶于5 mL PBS缓冲液中,避光,晃动一段时间后置于超声波中使其充分溶解,-20 ℃保存,使用前用完全培养基稀释成0.5 mg/mL。
(4) 2 mg/mL多糖母液:分别称取10 mg HF1、HDF1、HDF21和HDF22溶于5 mL DMEM中,浓度为2 mg/mL,置于4 ℃下保存备用,试验前用DMEM稀释成需要的浓度,过0.22 μm针式滤膜。
1.2.7 HepG2细胞的复苏、培养、传代及冻存
(1) 细胞复苏:取出细胞冻存管,放入流动的37 ℃水中,期间不断摇晃使细胞冻存液融化。加入适量的完全培养液,1 000 r/min离心5 min,弃去上清液,加入适量的完全培养基后移入培养瓶中,于37 ℃、5% CO2的培养箱中培养,次日更换培养基继续培养,并观察细胞形态。
(2) 细胞传代培养:从培养箱中取出细胞培养瓶,用酒精喷在培养瓶表面消毒后,在倒置显微镜下观察到细胞汇合度在70%~80%时即可进行细胞传代,在超净工作台中操作,弃去培养瓶中旧的培养液,加入 0.01 mol/L PBS缓冲液1 mL,洗涤细胞2次,吸出PBS缓冲液。再加入0.25%的胰蛋白酶2 mL,于培养箱中消化3 min,观察细胞形态,此时细胞质回缩变圆,细胞间隙变大即可加入2 mL完全培养液终止消化。将细胞悬液转移到15 mL离心管中,1 500 r/min 离心5 min,弃去上清液,按一定的比例加入完全培养基吹打均匀,取10 μL于计数板上计数,按计数结果进行稀释,分装到新的培养瓶中静置培养。
(3) 细胞冻存:选择处于对数生长期的细胞,更换新的培养液培养过夜,次日将细胞进行消化,终止消化后,转移到15 mL离心管中,1 500 r/min 离心5 min,弃去上清液,按比例加入细胞冻存液,吹打摇晃均匀。每管吸取1 mL分装到冻存管中,标好日期和名称后分别于4 ℃冷冻30 min、-20 ℃ 冷冻1 h,最终在-80 ℃冻存。
1.2.8 MTT法制作HepG2细胞生长曲线 在倒置显微镜下观察到细胞汇合度在80%左右时将细胞消化处理,然后用完全培养基将细胞浓度调整为5×104个/mL接种在96孔板上于培养箱内培养,每天同一时间取竖排的8孔细胞进行MTT法处理,得到OD值,以时间为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.2.9 不同浓度组分及其对HepG2细胞胆固醇含量的影响 将多糖样品HF1、HDF1、HDF21、HDF22分别设2个浓度组,低浓度组(125 μg/mL) 和高浓度组(500 μg/mL),并设立空白组。
(1) 细胞铺板:将处于对数生长期的细胞消化制成细胞悬液,稀释成1×105个/mL,接种在6孔板中,每孔2 mL 3组平行,于培养箱中培养。
(2) TC含量的测定:待细胞汇合度达60%~70%时,弃去旧的培养液,用PBS洗2次后加入DMEM稀释的多糖组分2 mL,分别培养24,48,72 h后弃去培养液,用PBS洗2次,再分2次加入1 mL PBS溶液,用刮板把6孔板中的细胞完全转移到1.5 mL离心管中。于1 000 r/min 离心5 min后弃上清液,加入胆固醇试剂盒中100 μL的细胞裂解液,旋涡震荡30 s后静置5 min,反复3次共裂解25 min;于1 500 r/min 离心5 min,取上清液。
(3) 配制工作液:R1与R2体积比为4∶1,混匀,立即使用。
(4) 标准品稀释:将5 mmol/L胆固醇标准品用无水乙醇稀释为1 250.0,625.0,312.5,156.0,78.0,39.0 μmol/L。取10 μL于96孔板中,并设立空白对照组,3个平行;分别取10 μL 待测样品加入96孔板中,3组平行,每孔加入190 μL工作液,充分摇匀,37 ℃反应20 min后于550 nm处测OD值。由标准曲线计算出各样品中胆固醇含量。
1.3 统计学分析
2 结果与分析
2.1 亨氏马尾藻岩藻聚糖化学组成
由表1可以看出,经过分离纯化和降解,HDF1的多糖含量、硫酸基含量和岩藻糖含量均高于HF1,但糖醛酸含量低于HF1。降解后的HDF1的多糖含量升高了14.14%。HDF21、HDF22的多糖含量分别降低了6.77%和8.80%,硫酸基含量分别降低了1.20%和5.88%。 HDF22的岩藻糖含量降低了5.02%,HDF21的糖醛酸含量降低了6.98%,但HDF21的岩藻糖含量有明显的升高,提高了9.47%。因此,从数据来看,降解作用对HDF21的化学组成影响最大。

表1 亨氏马尾藻岩藻聚糖不同组分的化学组成
2.2 HepG2细胞生长状况
由于该细胞为肝癌细胞,生长速率快,由图1可以看出,细胞在48~72 h处生长最快,处于对数生长期,而培养开始及培养后期OD值变化不大,这是因为细胞在最初数量较少,且处于适应环境的过程,培养一段时间之后,由于营养充足,细胞增长很快,后期由于营养物质的消耗及代谢产物的增多,细胞增长缓慢。
2.3 马尾藻岩藻聚糖不同组分对细胞内胆固醇含量的影响
由图2可知:细胞培养24 h后,与空白组相比,不同组分不同浓度的岩藻聚糖均能不同程度地降低细胞内胆固醇含量。其中HF1和HDF1在浓度为125 μg/mL时能极显著降低(P<0.01)HepG2细胞内胆固醇含量。而当HF1的浓度处于500 μg/mL,HDF21的浓度处于125 μg/mL时,也能显著降低(P<0.05)细胞内胆固醇含量。
细胞培养48 h后,与空白组相比,只有HF1浓度为500 μg/mL 时才能极显著降低(P<0.01)细胞内胆固醇含量(降低了57.57%);HF1、HDF1在浓度处于125 μg/mL,HDF22浓度处于500 μg/mL时能显著降低(P<0.05)细胞内胆固醇含量。其他组胆固醇水平虽然低于空白组,但是没有显著差异。
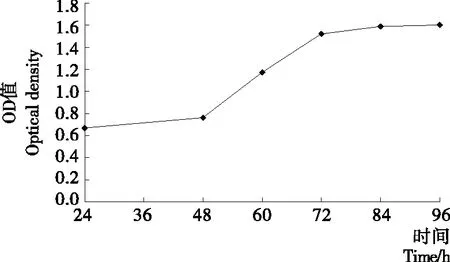
图1 HepG2细胞生长曲线

图2 不同组分及浓度岩藻聚糖硫酸酯对细胞内胆固醇水平的影响
Figure 2 Effects of different components and concentrations of fucoidan sulfate on intracellular cholesterol levels
细胞经培养72 h后,与空白组相比,岩藻聚糖各个组分、各个浓度均能明显降低细胞内胆固醇含量。当浓度处于125 μg/mL时,除了HDF21作用的细胞胆固醇含量没有明显变化外,HF1、HDF1、HDF22处理的细胞胆固醇含量均有显著性降低(P<0.05);而HF1、HDF1、HDF21和HDF22 4种组分的高浓度组(500 μg/mL)均能极显著降低(P<0.01)细胞内胆固醇含量,分别降低了44.14%,57.64%,61.21%,54.09%。
综上所述:与空白组相比,HF1、HDF1、HDF21和HDF22 4种组分在低浓度和高浓度分别作用细胞24,48,72 h 后均能降低细胞内胆固醇含量,其中作用72 h时降胆固醇作用最佳。从图2(c)来看,浓度为500 μg/mL时的HDF21降胆固醇的效果最好,降低了61.21%;其次为HDF1,降低了57.64%。同一组分的高浓度样品效果好于低浓度,因此可以看出岩藻聚糖的降胆固醇作用不仅与时间有关还与浓度有关。
3 结论
将亨氏马尾藻粉依次进行超声波辅助热水浸提、乙醇分级沉淀、Sevag法脱蛋白、透析并真空冷冻干燥后得粗多糖,采用DEAE C-52分级纯化得到HF1,经自由基氧化降解得到HDF1、HDF2,HDF2经Superdex 75分离纯化得到HDF21、HDF22。分析了HF1、HDF1、HDF21、HDF22的化学组成:多糖含量分别为35.13%,49.27%,28.36%,26.33%;硫酸基含量分别为16.35%,17.52%,15.15%,10.47%;糖醛酸含量分别为12.53%,10.85%,5.55%,12.84%;岩藻糖含量分别为15.34%,17.52%,24.81%,10.32%。
研究了4种不同分子量的岩藻聚糖HF1、HDF1、HDF21和HDF22对HepG2细胞胆固醇含量的影响。结果表明,4种组分作用细胞后均能降低胆固醇含量,特别是4种组分的高浓度(500 μg/mL)作用72 h均能极显著降低(P<0.01)细胞内胆固醇含量,HF1、HDF1、HDF21和HDF22组分别降低了44.14%,57.64%,61.21%,54.09%。这表明岩藻聚糖对HepG2细胞内胆固醇水平的影响可能具有一定的时效与量效关系,且4种组分中HDF21降胆固醇效果最好,可能与其分子量较低及糖链上的岩藻糖含量较高有关。
本研究采用细胞体外培养方式,通过检测细胞内胆固醇含量探究了岩藻聚糖的降血脂活性。但由于脂质代谢的复杂性,岩藻聚糖的降血脂机理尚不清楚,后续试验可以在岩藻聚糖的结构解析和细胞分子生物学的层面上作进一步的探究。
