C基因型多重耐药乙型肝炎病毒稳定复制表达小鼠模型的建立
2019-01-03刘璐洁余双庆许智慧刘新光吴小兵徐东平董小岩
刘璐洁,杨 悦,余双庆,许智慧,赵 丽,刘新光,吴小兵,徐东平,董小岩,刘 妍
多重耐药乙型肝炎病毒(multidrug resistant hepatitis B virus, MDR HBV)是指HBV基因组同时出现核苷类药物耐药突变(rtM204I/V±rt184/202/250变异)和核苷酸类药物耐药突变(rtA181V±rtN236T)的病毒[1]。近年来,临床上耐核苷类药物和核苷酸类药物的MDR HBV感染呈逐年增多趋势,给临床治疗带来巨大的挑战[2]。我国HBV感染以B和C基因型流行为主,北方地区C基因型感染患者高达83.8%[3],有研究显示C基因型HBV感染患者有更高的多重耐药发生风险和进展为肝硬化、肝细胞癌的风险[4]。本课题组前期从我国大样本来源的慢性HBV感染患者中分离鉴定了16种MDR HBV株,并在国内外首次建立了C基因型MDR HBV(HBV基因组反转录酶区同时含有如下耐药位点:rtL180M+S202G+M204V+N236T)稳定复制细胞系(国家发明专利ZL201110353756.0),具备了体外细胞水平研究C基因型MDR HBV的工具[5]。为了能够深入研究C基因型MDR HBV的体内病毒学特性及优化治疗方案,需要合适的C基因型MDR HBV动物模型。
由于小鼠易获得、研究背景清楚、经济实用等优点,HBV小鼠模型广泛应用于人HBV相关研究。但因为HBV的种属特异性,小鼠并不能天然感染HBV,可通过转基因、高压水动力注射、重组腺相关病毒介导及人源化人-鼠嵌合肝脏等方法介导,实现人HBV在小鼠体内复制及人工感染[6]。上述方法各有优缺点,其中重组8型腺相关病毒(recombinant adeno-associated virus 8, rAAV8)介导的HBV稳定复制表达小鼠模型具有成模率高、病毒复制水平高、稳定复制持久等优点。本研究拟在前期工作基础上,建立rAAV8介导的C基因型MDR HBV稳定复制表达小鼠模型,为后续评价抗MDR HBV药物疗效提供实验平台。
1 材料与方法
1.1 材料 6~8周龄雌性C57BL/6小鼠购自北京斯贝福生物技术有限公司;人乙肝病毒表面抗原(HBsAg)和E抗原(HBeAg)ELISA检测试剂盒购自北京万泰生物药业股份有限公司;小鼠抗人乙肝病毒核心抗原(HBcAg)单克隆抗体、小鼠抗人HBsAg单克隆抗体以及生物素-链霉素免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司。
本文C基因型野生病毒命名为rAAV8-1.3HBV-C-WT,C基因型多重耐药病毒命名为rAAV8-1.3HBV-C-MDR。病毒载体构建及病毒纯化均与北京五加和分子医学研究所有限公司合作完成。
1.2 方法
1.2.1 病毒 rAA V8-1.3HBV-C-MDR和rAA V8-1.3HBVC-WT的制备 首先构建携带1.3倍C基因型MDR HBV基因组和1.3倍C基因型野生型HBV(wild type HBV, WT HBV)基因组的重组腺相关病毒质粒pAAV2neo-1.3HBV-C-MDR、pAAV2neo-1.3HBV-C-WT,测序鉴定正确后使用腺相关病毒进行包装纯化[7]。每个样品设置2个复孔,按照MOI值(vg/cell)为106的标准,将重组病毒转导至Huh7细胞,同时设不转导病毒的细胞对照孔作为空白对照孔,检测上清HBsAg和HBeAg水平。
1.2.2 动物模型的制备 将重组病毒rAAV8-1.3HBV-C-MDR和rAAV8-1.3HBV-C-WT分别经尾静脉注射至C57BL/6小鼠体内(注射剂量为1×1011vg/200 μl/只),以建立文献已报道的C基因型WT HBV复制小鼠模型(HBV-C-WT组,n=6)和MDR HBV复制小鼠模型(HBV-C-MDR组,n=6)。病毒注射后第2、3、5、7、9周分别经眼底静脉丛采血,检测血清中HBV DNA、HBsAg和HBeAg的表达水平,并于第9周末处死全部小鼠,取肝组织行HE染色和免疫组化染色观察。以上动物实验均在原解放军第三〇二医院实验动物中心完成,饲养条件和实验标准严格遵照美国健康研究所实验动物护理与利用指南进行。以上实验经该院伦理委员会批准。
1.2.3 荧光定量PCR检测血清HBV DNA 病毒注射后第2、3、5、7、9周经眼底静脉丛采血,将采集到的全血置于37 ℃孵箱中温育1 h,室温下3000 r/min离心10 min分离血清。取15 μl血清送北京巴奥瑞生物科技有限公司进行HBV DNA定量检测(检测下限为102IU/ml),每份小鼠血清样本设3个复孔,取均值。
1.2.4 ELISA检测小鼠血清HBsAg和HBeAg水平 上述步骤中得到的血清经生理盐水稀释20倍后,使用HBsAg、HBeAg诊断试剂盒检测小鼠血清HBsAg和HBeAg水平,检测过程参见试剂盒说明书。2项指标阳性判断标准均定义为样品A450值≥临界值(cutoff值),临界值=阴性对照孔均值×2.1(阴性对照孔低于0.05者按0.05计算)。
1.2.5 小鼠肝组织HE染色和免疫组化染色 取小鼠肝脏,用10%多聚甲醛固定,石蜡包埋后切片,行HE染色,诊断标准参考《慢性乙型肝炎防治指南》[8]。同时进行免疫组化染色检测肝组织HBsAg和HBcAg的表达,镜下观察肝细胞膜被染为棕黄色表示HBsAg表达,肝细胞核被染为棕黄色表示HBcAg表达,阴性不显色。
1.3 统计学处理 采用SPSS 19.0软件进行统计学分析。计量资料呈正态分布或近似正态分布,用x±s表示,2组比较采用两独立样本t检验;2组指标在不同时间点的比较用重复测量设计的方差分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 重组质粒的构建 重组腺相关病毒质粒pAAV2neo-1.3HBV-C-MDR构建成功后测序并与C基因型RT区标准序列比对,可见在同一病毒基因组上出现典型MDR HBV突变位点rtL180M+S202G+M204V+N236T,测序比对分析见图1。

图1 重组病毒质粒pAAV2neo-1.3HBV-C-MDR中HBV部分反转录酶区序列比对分析箭头标注显示同一病毒基因组上rtL180M、rtS202G、rtM204V和rtN236T同时发生多重耐药突变Figure 1 Sequence alignment of HBV partial reverse transcriptase region of recombinant viral plasmid pAAV2neo-1.3HBV-C-MDR
2.2 重组病毒转导Huh7细胞中HBsAg和HBeAg的表达 未转导重组病毒的细胞上清(空白对照)中未检测到HBsAg和HBeAg表达,而转导rAAV8-1.3HBV-C-MDR和rAAV8-1.3HBV-C-WT后Huh7细胞可有效表达HBsAg和HBeAg,且2者比较差异无统计学意义(t=2.630,P=0.211;t=2.277,P=0.246)(图2)。
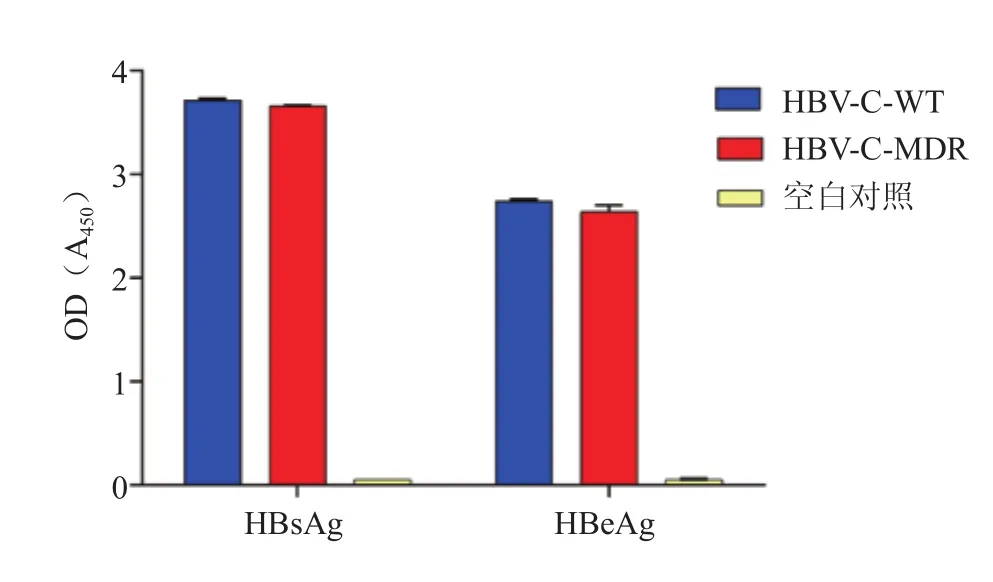
图2 Huh7细胞上清中HBsAg和HBeAg的表达Figure 2 Expression of HBsAg and HBeAg in supernatant of Huh7 cells
2.3 模型小鼠血清HBV DNA载量动态检测结果 将重组病毒rAAV8-1.3HBV-C-MDR,rAAV8-1.3HBV-C-WT经尾静脉注射至C57BL/6小鼠体内,注射后第2、3、5、7、9周HBV-C-MDR组和HBV-C-WT组小鼠血清中均能检测到HBV DNA且病毒载量渐趋稳定,HBV-C-MDR组和HBVC-WT组小鼠血清HBV DNA波动范围分别为3.67 ~ 4.06 lg IU/ml和 4.36 ~ 5.11 lg IU/ml; 第9周HBV-C-MDR组小鼠血清HBV DNA水平为(3.90±0.24)lg IU/ml,HBV-C-WT组小鼠血清HBV DNA水平为(5.11±0.32)lg IU/ml。注射病毒2周后HBV-C-MDR组小鼠血清HBV DNA水平显著低于HBV-C-WT组;组内不同时间点小鼠血清HBV DNA水平差异无统计学意义[4]。见图3。

图3 不同时间点2组小鼠血清HBV DNA水平F组间=54.756,P=0.001;F时间=1.250,P=0.322Figure 3 HBV DNA load in mouse serum at different time points in both groups
2.4 模型小鼠血清抗原动态检测结果 C57BL/6小鼠注射 rAAV8-1.3HBV 后的第 2、3、5、7、9周,使用ELISA法检测小鼠血清(1∶20倍稀释)中HBsAg和HBeAg的水平,结果见图4和图5所示。结果显示,注射病毒2周后HBV-CMDR组和HBV-C-WT组小鼠血清中均可检测到HBsAg和HBeAg高表达,HBV-C-MDR组HBsAg和 HBeAg OD值分别为3.501±0.230和2.989±0.250,HBV-C-WT组HBsAg和HBeAg OD值分别为 3.967±0.230和 3.384±0.230。HBV-C-MDR组HBsAg和HBeAg水平均低于HBV-C-WT组(P均<0.05)。不同时间点HBsAg水平差异有统计学意义,其中,第2周与第3周、第3周与第5周、第5周与第7周相比,HBsAg水平差异无统计学意义(P均>0.05);第7周与第9周相比,HBsAg水平差异有统计学意义(P=0.011);不同时间点HBeAg水平差异无统计学意义。

图4 不同时间点2组小鼠血清HBsAg的表达水平F组间=23.731,P=0.005;F时间=14.271,P=0.000;cutoff.临界值Figure 4 Expression of serum HBsAg in mouse serum at different time points in both groups

图5 不同时间点2组小鼠血清HBeAg的表达水平F组间=129.540,P=0.000;F时间=1.896,P=0.151;cutoff.临界值Figure 5 Expression of serum HBeAg in mouse serum at different time points in both groups
2.5 小鼠肝组织HE染色及免疫组化染色结果 病毒注射后第9周,2组小鼠采血后处死取肝脏组织,经过固定包埋等步骤行HE染色和免疫组化染色。HE染色结果显示2组小鼠肝细胞未有明显损伤及炎细胞浸润;免疫组化染色结果显示2组小鼠肝细胞均能表达HBsAg和HBcAg(图6)。
3 讨 论
核苷(酸)类药物为目前最常用的抗HBV药物,其中核苷类药物包括拉米夫定,恩替卡韦,替比夫定,核苷酸类药物包括阿德福韦酯和替诺福韦酯[8]。临床上,核苷(酸)类药物的长期序贯治疗在抑制前一种药物耐药突变株的同时,也增加了对后一种药物耐药突变株的筛选,增加了MDR HBV筛选的可能[9]。本课题组前期分离鉴定了16种MDR HBV株,并在国内外首次建立了C基因型MDR HBV稳定复制细胞系,具备了体外细胞水平研究C基因型MDR HBV的工具。为了能够深入研究C基因型MDR HBV的体内病毒学特性及优化治疗方案,仍需要合适的C基因型MDR HBV动物模型。
近年来,HBV复制小鼠模型构建有很大的研究进展,但小鼠肝细胞缺乏HBV进入胞内所需的特异性受体及与HBV作用的某些蛋白,无法直接应用感染性HBV接种的方法制备模型[10]。现有的HBV小鼠模型大多是通过高压水动力法将HBV基因组导入到肝脏或者直接利用转基因方法制备,但通过转基因方法得到的HBV复制小鼠对HBV抗原天然免疫耐受[11-12],成模率低且小鼠血清中检测不到HBeAg的表达[13],而通过高压水动力法获得的HBV复制小鼠模型病毒持续时间短,不能获得持续复制的HBV小鼠模型,故不适用于慢性HBV感染的研究[14-15]。有研究发现利用携带1.3拷贝HBV基因组的rAAV8介导的HBV复制小鼠模型能够在小鼠肝细胞中自发回复形成染色体外环状闭合HBV基因组DNA,对肝脏有很高的转导效率,且在小鼠血清中能够持续检测到HBV DNA、HBsAg和HBeAg表达[7]。
本研究在课题组前期构建C基因型稳定复制表达WT HBV小鼠模型的基础上[16],为了进行MDR HBV相关研究,采用rAAV8为载体,课题组前期发现的患者来源的MDR HBV全基因组序列,尾静脉注射小鼠后可在肝细胞内表达HBV。持续观察9周,小鼠血清中HBV DNA载量均在103IU/ml以上。与WT HBV小鼠模型相比,MDR HBV小鼠模型血清HBV载量较低,分析原因可能由于MDR HBV本身复制力比WT HBV低,这与前期体外细胞实验显示的MDR HBV有较低的病毒复制力结果相符[17]。注射病毒第2周,实验组和对照组小鼠血清均表达高水平HBV DNA,随后HBV DNA水平渐趋稳定,第2周HBV DNA不稳定可能因为经尾静脉注射病毒后,病毒短期内未能全部到达肝脏且部分存在于血液中的病毒未能完全代谢,待造模观察几周后,其水平逐渐趋向稳定。另外,在注射病毒观察期间,实验组和对照组小鼠血清中均能检测到HBsAg和HBeAg的表达;注射病毒后第9周,2组小鼠肝组织HBsAg和HBcAg免疫组化检测均为阳性,直接验证了模型小鼠可以在肝脏中表达HBsAg和HBcAg。
总之,本研究建立了rAAV8介导的C基因型MDR HBV小鼠模型,血清中HBV DNA、HBsAg和HBeAg可持续稳定表达,肝细胞内可检测到HBV相关抗原HBsAg和HBcAg,为后续体内动物水平评价抗MDR HBV药物疗效提供实验模型。该模型制备过程相对简单,病毒表达持续时间长,但由于rAAV8载体介导的小鼠HBV复制表达模型同样缺少HBV进入宿主的自然感染环节,故本模型在研究MDR HBV与宿主免疫应答等方面的应用价值有限。

图6 小鼠肝组织病理检测结果HBV-C-MDR小鼠肝脏组织HE染色(A,200倍)、HBsAg免疫组织化学染色(B,400倍)和HBcAg免疫组织化学染色(C,400倍);HBV-C-WT小鼠肝脏组织HE染色(D,200倍)、HBsAg免疫组织化学染色(E,400倍)和HBcAg免疫组织化学染色(F,400倍)。箭头指示为染色阳性细胞Figure 6 Pathological results of liver tissue in mouse models
