芋螺毒素ImI的化学合成及其杀虫活性研究
2019-01-03吴小英安婷婷高炳淼
吴小英,安婷婷,高炳淼
1海南省人民医院;2海南省药物研究所,海口 570311;3海南医学院,海口 571199
芋螺(Cone Snail)主要生长于热带海域,属于软体动物门,腹足纲,芋螺科,是在沿海珊瑚礁、沙滩上生活的美丽的螺类[1]。芋螺毒素(conotoxins)是来源于芋螺毒管中用于捕猎的一类多肽的集合,其具有丰度高、分子量小、结构多样、靶点广泛、特异性强等特点,已经逐渐成为国内外极受关注的新兴研究热点[2,3]。全世界约有500种以上芋螺,根据芋螺食性可分为三大类:食虫芋螺(大于350种),食螺芋螺(约70种),食鱼芋螺(约70种)[4,5]。我国芋螺约有80余种,主要分布在海南省管辖的西沙群岛、南沙群岛和中沙群岛,以及台湾岛等热带海区[6]。至今,已从数百种芋螺中分离到了上千种芋螺毒素,其在镇痛、癫痫治疗、癌症、戒烟戒毒、疾病诊断和受体研究中具有广泛的应用价值[7]。部分芋螺毒素已进入临床研究或已被FDA正式批准为治疗新药,用作特异诊断试剂和镇痛药[8]。如由Olivera等从幻芋螺(Conus magus)中分离的ω-MVIIA,已被美国FAD正式批准为治疗顽痛的药物,其商品名为Ziconotide[9]。
随着化学杀虫剂的普遍使用,农业害虫的耐药性不断增加,导致杀虫剂毒性和使用量都越来越大,生态环境受到巨大伤害,进而严重威胁着人类健康,由此对新型、高效、安全生物杀虫剂的需求非常迫切[10,11]。食虫芋螺毒素能够特异性作用于昆虫而具有较强的杀虫能力,对哺乳动物的毒性很小或无毒副作用,而食虫芋螺毒素的杀虫活性和作用靶点尚未展开系统研究[12]。因此,开展食虫芋螺毒素的研究,筛选获得高效杀虫芋螺毒素,为解决化学农药造成的生态环境问题提供一条新途径。本研究化学合成了芋螺毒素线性肽ImI,经两步氧化法后质谱鉴定获得氧化折叠肽ImI,采用MTT法和昆虫注射法测试其杀虫活性,可为研发新型、高效、安全生物杀虫剂奠定基础。
1 材料与方法
1.1 实验材料
多肽合成相关氨基酸活化试剂(ABI,美国);色谱级三氟乙酸(Trifluoroacetic acid,TFA )和色谱级乙腈(Acetonitrile,ACN),购自Thermo Fisher Scientific公司;Vydac分析型C18柱(5 μm,4.6 mm × 250 mm)及制备型C18柱(10 μm,22 mm×250 mm),购于上海申越实验器材有限公司。其他常用生化试剂均为国产分析纯,购自广州化学试剂厂。
1.2 实验仪器
多肽合成仪(ABI 433,美国);高效液相色谱仪(Waters2535,美国);电喷雾电离质谱(岛津,日本);冷冻干燥机(Christ,德国)。
1.3 实验方法
1.3.1 线性肽的合成
芋螺毒素ImI线性肽(GCCSDPRCAWRC-NH2)的合成参照文献[12]的方法,采用Fmoc化学方法合成ImI的线性肽,树脂为Wang Resin,从C端至N端合成,HBTU/HOBt/DIEA缩合形成肽键。合成过程中非半胱氨酸的侧链保护基团如下所示:Ser(tBu),Asp(OtBu),Arg(Pbf),Trp(Boc)。半胱氨酸Cys 1和Cys 3用S-Trityl(Trt)保护基团,Cys 2和Cys 4用S-acetamidomethyl(Acm)保护基团。树脂肽合成后,按照每20 mg的树脂肽1mL试剂K(82.5% TFA/5% phenol/5% H2O/5% Thioanisole/2.5% EDT,v/v)切割(室温2 h),过滤并用20倍体积的-20 ℃冰乙醚沉淀和洗涤回收线性肽粗品,进行HPLC纯化,采用Vydac C18柱:流动相A(水,0.1%TFA),流动相B(乙腈,0.1%TFA);流速12 mL/min;60 min线性梯度洗脱,B相20%至80%,检测波长214 nm。经过HPLC反复纯化后获得线性肽,分析型HPLC分析其纯度达95%以上,通过质谱鉴定无误后,进行冻干保存,用于后续的氧化折叠反应。
1.3.2 两步法氧化折叠
第一步氧化,将纯化后线性肽溶于铁氰化钾反应液(K3[Fe(CN)6]10 mmol/L,Tris 0.1 mol/L,pH 7.5)中促使形成第一对二硫键(Cys1和Cys3),线性肽浓度不高于50 mg/mL,室温氧化折叠45 min。HPLC纯化反应后的产物,并进行质谱鉴定。第二步氧化,将纯化的产物加入充入氮气保护的碘(I2)反应液中(7.5 mmol/L I2溶液;水/TFA/乙腈=73∶3∶24,V/V),反应5~10 min,加抗坏血酸至溶液颜色消失,形成第二对二硫键(Cys2和Cys4)得到ImI最终活性产物。采用HPLC对合成的产物纯化并进行质谱确认。
1.3.3 MTT法
取对数期生长的Sf9细胞,用细胞计数板计数,按每孔100 μL接种于96 孔板中,每孔细胞数量控制在103个左右,27 ℃培养至细胞完全贴壁后,分别加入不同浓度的芋螺毒素纯品,每组各设置3个复孔,以不加抑制剂的实验组作对照。27 ℃条件下培养48 h后,每孔加入浓度为5 mg /mL的MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)10 μL,继续培养4 h。弃去板中培养液及MTT,每孔加入100 μL DMSO(二甲基亚砜),室温低速震荡15 min。待结晶物完全溶解后,在酶标免疫测定仪测定490 nm处的吸光度值。
1.3.4 昆虫注射法
选用3龄或4龄的黄粉虫(约180 mg/条),注射前采用鸡饲料正常喂食。在实验当天将芋螺毒素溶解在0.7%盐水中至所需浓度,使用微注射器(气相尖头微量进样器,10 μL,上海高鸽)进行注射,注射体积为5 μL,用10 μL 0.7%盐水冲洗导管死腔中残留药物。将溶解的芋螺毒素分别以不同浓度注射到黄粉虫体内(n=10)。用0.7%盐水溶液注射对照组黄粉虫(n=10),每个浓度做三次重复。在48小时观察注射芋螺毒素或0.7%盐水的黄粉虫死亡情况。
1.3.5 数据处理
数据处理和分析采用统计软件GraphPad Prism6,数据以mean±SD表示,两组间数据分析比较采用t检验。*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1 线性肽的合成
采用化学方法合成了ImI线性肽,对粗肽进行HPLC纯化(见图 1)。ImI线性肽的洗脱时间为 9.653 min,最终得到纯度为95%的线性肽约20.2 mg。
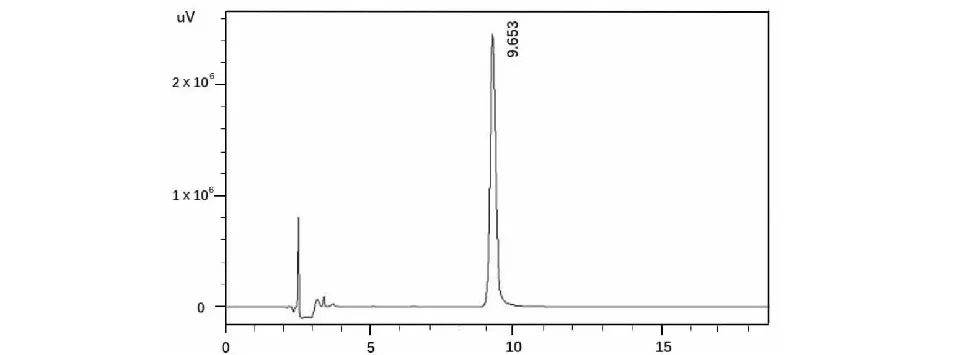
图1 HPLC纯化线性肽ImIFig.1 HPLC Purification of linear peptide ImI
2.2 氧化折叠
利用铁氰化钾溶液和I2溶液对合成的线性肽ImI进行两步法氧化折叠,并对氧化折叠终产物进行HPLC纯化和质谱鉴定。树脂切割后的线性肽分子量为1497.78 Da,符合含有Acm保护基团的ImI分子量。经第一步氧化后的分子量为1495.78 Da,与氧化前相比少了2 Da,证明第一对二硫键形成。第二步氧化折叠后质谱鉴定ImI分子量为1351.58 Da,与第一步氧化后的分子量相差144.2 Da,证明第二步氧化折叠是切割两个Acm保护基团并形成了第二对二硫键(如图2)。再与其线性肽的分子量1355.634 Da 相差约4 Da,亦证明脱去4个氢原子形成了两对二硫键。通过两步氧化法最终从20.2 mg线性肽ImI中获得活性产物约9.75 mg,产率为48.3%。
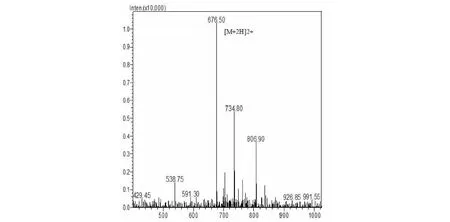
图2 氧化折叠后ImI的质谱鉴定Fig.2 Identification of oxidative folding ImI by mass spectrometry
2.3 MTT法
通过MTT法测试芋螺毒素ImI对昆虫细胞sf9的抑制作用。实验结果(图3)表明,与对照组(0.7% NaCl溶液)相比,实验组均具有显著性差异。芋螺毒素ImI对昆虫细胞sf9的抑制效果具有剂量效应,半数有效量为 0.13 nM。
2.4 昆虫注射法
不同浓度的芋螺毒素ImI被注射到黄粉虫的腹部来评价其杀虫作用。图4可以看出空白对照和阴性对照组致死率均为0,表明注射法模型对于评价杀虫作用是可行的。随着芋螺毒素ImI的注射量的增加,对昆虫的致死率从16.6%到66.7%,经计算黄粉虫的半数致死剂量为0.11 μg/mg。

图3 芋螺毒素ImI对昆虫细胞sf9的抑制作用Fig.3 Inhibitory effects of conotoxin ImI on growth of insect sf9 cells注:测试组对比于阴性对照组,*表示具有显著性差异(*P < 0.05,**P < 0.01)。Note:Compared with the negative control group,the test group showed significant difference(*P < 0.05,**P < 0.01).

图4 芋螺毒素ImI对黄粉虫的杀虫作用Fig.4 Insecticidal effects of conotoxin ImI注:测试组对比于阴性对照组,*表示具有显著性差异(** P < 0.01,***P< 0.001,**** P <0.0001)。Note:the test group was compared with the negative control group and * indicated significant difference(**P < 0.01,*** P<0.001,****P< 0.0001).
3 讨论
随着化学杀虫剂的普遍使用,农业害虫的耐药性不断增加,导致杀虫剂毒性和使用量都越来越大,食品安全和环境生态问题频现,进而严重威胁着人类健康[13]。虽然采取了禁用高毒农药等措施,但也将出现可替代新农药品种缺乏等诸多问题。因此,对新型、高效、安全的生物杀虫剂的需求非常迫切。
乙酰胆碱受体(nAChR)是脊椎动物和无脊椎动物神经系统中快速介导胆碱能突触传递的配基门控离子通道[14]。在昆虫中,nAChR在神经肌肉接头处没有分布,却是中枢神经系统中最丰富的神经递质受体,因此成为杀虫剂的作用靶标[15]。John Moon等采用注射法将重组肽Tgu6.1注射到多毛虫中枢神经索部位,来鉴定杀虫活性[16]。Monica Mejia等[17]开发一种使用果蝇注射和电生理记录的筛选芋螺毒素的新方法。芋螺毒素ImI是来源于食虫帝王芋螺(Conusimperialis),具有4个半胱氨酸形成2个二硫键,其作用靶点为α7-nAChR,我们推测其具有杀虫活性[18,19]。采用化学方法合成芋螺毒素线性肽,经氧化折叠后质谱鉴定获得芋螺毒素ImI,采用MTT法和昆虫注射法研究其杀虫活性。实验结果表明芋螺毒素ImI具有抑制昆虫细胞sf9生长的活性,半数有效量为0.13 nM;对黄粉虫具有杀虫活性,半数致死剂量为0.11 μg/mg。
目前认为多肽类毒素发挥杀虫作用的第一作用靶标为nAChR,但没有发现其具体作用位点。近年来,对果蝇、桃蚜、烟草天蛾等昆虫的nAChR进行了分子克隆和功能鉴定,为杀虫剂作用机理及抗性机制的研究提供分子基础[20]。多肽类毒素类杀虫剂作用于昆虫神经传导的突触部位,与乙酰胆碱竞争受体位点,占领受体位点后,抑制神经兴奋的传导,造成昆虫麻痹,最终死亡[21]。因此,以nAChR作为靶标来研发新型杀虫剂需要加以重视,搞清楚芋螺毒素如何特异性作用于昆虫nAChR各种亚基的作用位点,从本质上揭示其杀虫作用机制,以进行杀虫剂的合理设计和高通量筛选,创制出新型生物杀虫剂,提高其在害虫防治中的应用价值将是进一步需要开展的工作。
