解淀粉芽孢杆菌B10-26对芝麻的促生防病效果及其定殖能力分析
2019-01-03何碧珀郝学政刘红彦倪云霞刘新涛赵新贝
何碧珀 ,郝学政 ,刘红彦 ,倪云霞 ,刘新涛 ,赵新贝 ,赵 辉*
(1.河南省农业科学院 植物保护研究所/农业部华北南部农作物有害生物综合治理重点实验室/河南省农作物病虫害防治重点实验室, 河南 郑州 450002; 2.河南省农业厅 中药材生产技术服务中心,河南 郑州 450002)
芝麻茎点枯病是由菜豆壳球孢引起的土传病害,是危害芝麻的主要病害之一,能造成10%~20%的减产,重发地减产可达80%以上[1]。该病害在芝麻整个生长期均可发生,导致茎秆中空、蒴果干枯,对芝麻产量和品质造成严重影响。目前,芝麻茎点枯病的防治仍以化学农药为主,但大量使用化学药剂会造成病原菌抗药性增加、环境污染、农药残留等诸多问题,因此,生物防治成为解决化学防治弊端的重要措施。芽孢杆菌具有良好的抗病促生作用,机制主要有营养和空间的竞争(定殖)作用、溶菌作用、抗生作用以及诱导植物系统抗性等,因其具有很强的抗逆性和适应性,在农业、环保、医药等领域均得到广泛应用。与枯草芽孢杆菌亲缘性很高的解淀粉芽孢杆菌(B.amyloliquefaciens)也能产生多种抑菌活性物质,具有抑菌谱广、繁殖能力和抗逆性强、防病促生能力好等基本特性,被广泛应用于植物病害生物防治领域。李姝江等[2]研制的解淀粉芽孢杆菌BA-12可湿性粉剂对核桃根腐病有优良防治效果;张金凤等[3]发现,在棉花育苗基质中添加解淀粉芽孢杆菌41B-1R可以有效降低黄萎病的危害。解淀粉芽孢杆菌的生防作用机制研究表明,它可以产生嗜铁素、蛋白酶、纤维素酶、吲哚-3-乙酸和脂肽类抗生素来发挥生防作用[4-5]。本研究以芝麻菜豆壳球孢为靶标,解淀粉芽孢杆菌B10-26为研究对象,对其促生作用、盆栽防效、定殖情况、胞外水解酶活性以及抗生素合成酶相关基因进行测定,揭示B10-26防治芝麻茎点枯病的生防机制,为实现解淀粉芽孢杆菌B10-26在生防领域的开发和应用提供理论依据。
1 材料和方法
1.1 供试材料
供试芝麻品种:郑芝13,由本实验室培育;供试拮抗菌菌株:解淀粉芽孢杆菌B10-26,由本实验室分离保存;供试真菌:菜豆壳球孢,由本实验室分离保存。供试农药:80%多菌灵可湿性粉剂和10亿cfu/g枯草芽孢杆菌可湿性粉剂分别购自苏州遍净植保科技有限公司和百立徳生物科技有限公司。
1.2 培养基
LB培养基:10 g蛋白胨、10 g NaCl、5 g酵母浸出粉、15 g琼脂粉、1 L蒸馏水,121 ℃灭菌30 min。
NA培养基:3 g牛肉膏、10 g蛋白胨、10 g葡萄糖、5 g酵母浸出粉、5 g NaCl、1 L蒸馏水,121 ℃灭菌 30 min。
羧甲基纤维素钠培养基:10 g胰蛋白胨、5 g酵母粉、10 g NaCl、10 g羧甲基纤维素钠、15 g琼脂、1 L蒸馏水,pH值6.0,121 ℃灭菌20 min。
脱脂奶粉培养基:100 g脱脂奶粉、15 g琼脂、1 L蒸馏水,pH值7.0,115 ℃灭菌20 min。
β-1,3-葡聚糖酶培养基:0.05 g D-葡聚糖、0.5 g 酵母提取物、1 g蛋白胨、0.5 g NaCl、0.01 g刚果红、15 g琼脂、1 L双蒸水,pH值7.0,121 ℃灭菌20 min。
几丁质酶培养基:取2 g几丁质,溶于40 mL浓盐酸中,于4 ℃搅拌8 h后,滴加250 mL 95%的乙醇(-20 ℃预冷),即出现白色胶体状物质。4 ℃冰箱过夜后,反复用冰冷的双蒸水离心洗涤沉淀(5 000 r/min离心1 min),洗至pH值5.0左右,溶于200 mL乙酸-乙酸钠缓冲液(50 mmol/L,pH值5.0)中。10 000 r/min匀浆1 min,即成1%的胶体几丁质。称取5 g蛋白胨、2.5 g酵母粉、5 g NaCl、20 g琼脂,加入20%胶体几丁质,双蒸水定容到1 L,pH值7.0,121 ℃灭菌20 min。
1.3 B10-26发酵液制备
在LB平板上划线B10-26,30 ℃培养过夜,挑取单菌落于NA液体培养基中,30 ℃、180 r/min培养48 h所得即为发酵原液,用血球计数板法对菌量进行计数。
1.4 B10-26菌株对芝麻的促生作用检测
1.4.1 B10-26菌株对芝麻种子萌发的影响 采用浸种法测定B10-26发酵液对种子萌发的影响。芝麻种子依次用70%乙醇处理3 min,5%的次氯酸钠处理3 min,无菌水漂洗4~5遍,晾干备用。将1.3中制备的5.92×109cfu/mL B10-26发酵原液分别稀释50倍、100倍、500倍、1 000倍后,浸泡芝麻种子24 h,并以无菌水和NA培养基浸泡的芝麻种子为对照。每皿30粒种子,每个处理3个重复,保湿培养,24 h后测萌发率,以胚芽长度达到种子长度1/2时为发芽标准,5 d后随机选10株萌发种子测其根长和芽长。
1.4.2 B10-26菌株对芝麻幼苗生长的影响 将15粒发酵液浸泡的芝麻种子种植在灭菌后的砂土(砂∶土=1∶3)中,种子消毒和发酵液浸种方法同1.4.1。20 d后选取10株芝麻幼苗测株高、根长及鲜、干质量。株高测量标准为根茎结合处到生长最高点,根长测量标准为根茎结合处到根尖最长点。
1.5 B10-26菌株对芝麻茎点枯病的防效检测
选用无菌土栽培的4~6叶期芝麻幼苗,测定B10-26菌株对芝麻茎点枯病的防治效果,共设置2种处理方式,分别为:B10-26发酵液、多菌灵和枯草芽孢杆菌可湿性粉剂与菜豆壳球孢同时灌根处理,B10-26发酵液、多菌灵和枯草芽孢杆菌可湿性粉剂灌根处理7 d后再灌根接种菜豆壳球孢。菜豆壳球孢接种浓度为1×106cfu/mL,接种量为5 mL/株;B10-26发酵液浓度为1×108cfu/mL,接种量为5 mL/株。以多菌灵和枯草芽孢杆菌可湿性粉剂1 000倍稀释液为阳性对照,无菌水为空白对照。每个处理重复3次,每个重复10株。于接种菜豆壳球孢20 d后调查芝麻幼苗的发病情况。调查分级标准参考高树广等[6]报道的芝麻苗期茎点枯病病害分级标准,计算发病率、病情指数和防治效果。
1.6 B10-26菌株的定殖检测
利用利福平抗性标记法对B10-26菌株进行定殖检测,参考王卿等[7]方法。挑取B10-26单菌落接种到利福平质量浓度为 0.5 μg/mL的NA培养基中,待菌株稳定生长后,依次转接到利福平质量浓度为 10、25、50、100、200、300 μg/mL的NA培养基中,转接量为1%,诱导至利福平质量浓度为300 μg/mL时结束。从含利福平300 μg/mL的B10-26菌液中取100 μL梯度稀释后涂布于NA(利福平300 μg/mL)平板上,培养后挑取菌落形态、拮抗活性不变的抗利福平菌株进行纯化,得到抗利福平的菌株B10-26R并保存备用。
将B10-26R接种到含利福平300 μg/mL的NA培养液中,28 ℃、180 r/min培养48 h。取45粒消毒芝麻种子浸入1×108cfu/mL的B10-26R菌液中3 h,在超净工作台晾干后播种。于播种后7、12、17、22、27 d分别取根、茎、叶组织各1.0 g,先用70%乙醇处理3 min,再用0.1%的升汞处理1.5 min,然后用无菌水漂洗5遍,晾干后剪碎并加入1 mL无菌水研磨,取100 μL样品涂布于NA(利福平300 μg/mL)平板上,每个处理重复3次,28 ℃静置培养48 h后计数。根据每个处理的平均菌落数分别计算每克鲜根、茎、叶中所含的菌量。
1.7 B10-26菌株胞外水解酶活性检测
对B10-26菌株的β-1,3-葡聚糖酶、蛋白酶、纤维素酶和几丁质酶等胞外水解酶活性进行检测,参考Ren等[8]的方法。
1.8 B10-26菌株抗生素合成酶基因检测
B10-26菌株基因组DNA提取采用CTAB法。聚酮类抗生素(Bacillaene)合成酶相关基因baeB、表面活性素(Surfactin)合成酶相关基因srfAD、抗霉枯草菌素(Mycosubtilin)合成酶相关基因mycB、伊枯草菌素(Iturin)合成酶相关基因ituA和丰原素(Fengycin)合成酶相关基因fenB的引物和PCR反应条件均参考邓建良等[9]的方法。最后将测序结果与NCBI数据库中序列进行比对,确定抗生素合成酶基因。
2 结果与分析
2.1 B10-26发酵液对芝麻种子萌发和幼苗生长的影响
表1和表2结果表明,B10-26发酵液对芝麻有一定的促生作用,其中稀释50倍的发酵液(约1×108cfu/mL)对种子萌发和幼苗生长的影响最明显,与无菌水处理相比,芝麻种子的萌发率提高43.37%,胚根长度增加49.25%,胚芽长度增加23.61%;芝麻幼苗的株高增加31.75%,根长增加21.43%,鲜质量增加26.67%,干质量提高46.51%。因此,1×108cfu/mL的B10-26发酵液对芝麻促生作用显著。
2.2 B10-26发酵液对芝麻茎点枯病的防治效果
如表3所示,B10-26发酵液、多菌灵和枯草芽孢杆菌可湿性粉剂灌根处理芝麻苗后立即接种菜豆壳球孢,其防治效果分别为37.2%、50.8%、38.3%,B10-26发酵液的防效与枯草芽孢杆菌可湿性粉剂防效相当;而先进行B10-26发酵液、多菌灵和枯草芽孢杆菌可湿性粉剂灌根处理,7 d后再灌根接种菜豆壳球孢,B10-26发酵液防治效果提高到61.1%,与枯草芽孢杆菌和多菌灵可湿性粉剂防效相当。
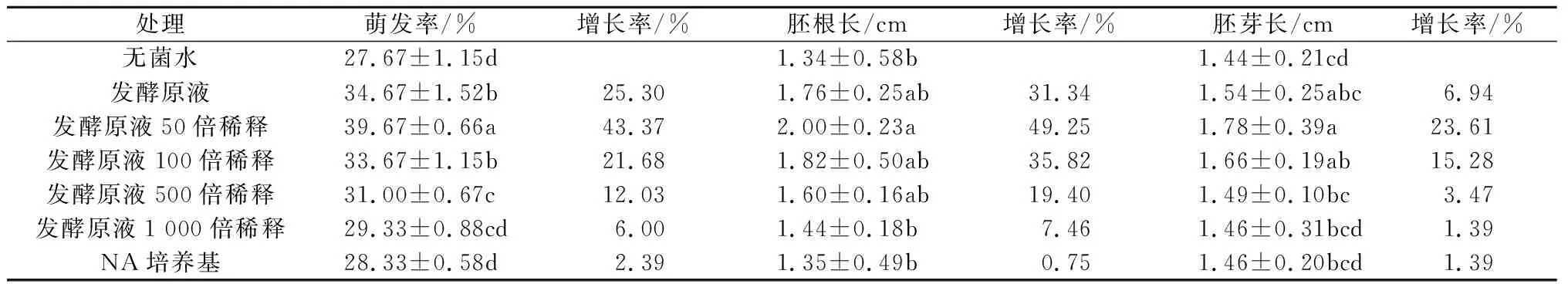
表1 B10-26发酵液对芝麻种子萌发的影响
注:同列数据后不同小写字母表示差异显著(P<0.05),下表同。

表2 B10-26发酵液对芝麻幼苗生长的影响

表3 B10-26发酵液对芝麻茎点枯病的防治效果
2.3 B10-26菌株在芝麻植株上的定殖情况
2.3.1 B10-26抗利福平菌株筛选 经过抗生素梯度诱导筛选,获得1株菌落形态与原始菌株一致且对300 μg/mL利福平具有抗性的菌株B10-26R。平板对峙试验结果表明,B10-26R和B10-26对菜豆壳球孢的抑菌圈直径分别为(0.65±0.036 1) cm 和(0.66±0.011 5) cm,抑菌作用差异不显著,因此,利用B10-26R进行定殖研究。
2.3.2 B10-26R菌株在芝麻上的定殖动态 如图1所示,芝麻种子经发酵液浸种,播种后7~27 d均能从芝麻中分离出目的菌株,根和茎上的定殖动态变化趋势相似,定殖菌量均先升高再降低,12 d定殖菌量达到高峰,分别为6.1×104cfu/g和2.2×103cfu/g,而叶上的定殖动态呈缓慢下降的趋势,7 d时最大定殖菌量为3.4×102cfu/g。结果表明,菌株B10-26R能在芝麻的根、茎、叶上定殖,且27 d后未对芝麻植株造成危害。

图1 B10-26R菌株在芝麻上的定殖动态
2.4 B10-26菌株胞外水解酶活性分析
如图2所示,B10-26菌株在羧甲基纤维素钠培养基和脱脂奶粉培养基上能够产生透明圈,在β-1,3-葡聚糖酶培养基上产生晕圈,且随着培养时间的延长,透明圈或晕圈的直径持续增加,而在几丁质酶的选择培养基上没有产生透明圈或晕圈,说明B10-26菌株能够产生β-1,3-葡聚糖酶、蛋白酶、纤维素酶,不能产生几丁质酶。

1:β-1,3-葡聚糖酶培养基; 2:脱脂奶粉培养基; 3:羧甲基纤维素钠培养基; 4:几丁质酶培养基图2 B10-26菌株胞外水解酶活性检测结果
2.5 B10-26菌株抗生素合成酶相关基因测定分析
以B10-26基因组DNA为模板,采用fenB、srfAD、mycB、ituA和baeB基因的特异性引物进行PCR扩增。如图3所示,扩增出大小分别为1 400 bp、675 bp和750 bp的fenB、srfAD和baeB基因条带,没有扩增出mycB和ituA基因条带。将特异性条带回收、克隆,并进行测序,获得的序列在NCBI数据库进行Blast比对,结果表明,B10-26的fenB基因片段序列与解淀粉芽孢杆菌Y2(NC_017912.1)和解淀粉芽孢杆菌YAU B9601-Y2(NC_017061.1)的丰原素合成酶相关基因fenB相似度达99%;srfAD基因片段序列与解淀粉芽孢杆菌 FZB42(NC_009725.1)和B9601-Y2(HE_774679.1)的表面活性素合成酶相关基因srfAD序列相似度分别为99%和100%;baeB基因片段序列与解淀粉芽孢杆菌FZB42(NC_009725.1)中的聚酮类抗生素合成酶相关基因baeB序列相似度为99%。因此,生防菌B10-26基因组具有fenB、srfAD和baeB3个抗生素合成酶相关基因。

M:DL2000 DNA Marker; 1: fenB; 2:srfAD; 3:mycB; 4:ituA; 5:baeB图3 B10-26菌株抗生素合成酶相关基因扩增产物电泳图谱
3 结论与讨论
解淀粉芽孢杆菌主要通过提高种子萌发率、增加植物质量和提高产量来促进植物生长[10]。当B10-26菌液浓度达1×108cfu/mL时,对芝麻种子萌发和幼苗生长均有一定的促进作用。防治结果表明,同时接种B10-26发酵液和菜豆壳球孢,防治效果仅为37.2%;而用B10-26发酵液灌根处理7 d 后再接种菜豆壳球孢,防治效果达到61.1%,生防效果显著提高,推测可能是B10-26菌株在芝麻幼苗体内定殖一定数量后,迅速占领病原菌与寄主植物的结合位点,从而对芝麻茎点枯病起到较好的防治效果。定殖能力是决定生防菌发挥稳定生防效果的关键因素,表现为在空间上快速占领生态位点、大量繁殖和定殖,诱导植物获得系统抗性,排斥、阻断或干扰植物病原菌的侵染[11-12]。本研究利用利福平抗性标记法检测B10-26菌株在芝麻幼苗上的定殖数量和定殖动态,结果表明,其在根部的定殖数量最多,茎部和叶部递减,这与张彦等[13]报道的分离自土壤的蜡样芽胞杆菌ANTI-8098A在番茄体内的定殖动态结果相似。生防菌B10-26分离自土壤,但能够在芝麻体内定殖,符合前人关于内生菌来源于植物体外,主要源自土壤的报道[14]。王娜等[15]也认为,利用生防菌防治植物病害应采取提前定殖的方式,只有当生防菌在作物根部或茎部定殖一定数量后才能有效占据特定生态位点和空间,从而更有效地抑制病原菌的生长,防治植物病害发生。因此,在采取提前定殖方式的条件下,B10-26菌液与多菌灵和枯草芽孢杆菌可湿性粉剂对芝麻茎点枯病具有同等的防治效果。
生防菌对植物病原真菌的溶菌作用与真菌细胞壁的结构有关,植物病原真菌的细胞壁成分较复杂,大多数含β-1,3-葡聚糖、纤维素、蛋白质、几丁质等,因此,需要多种酶共同作用才能降解病原真菌的细胞壁。相关研究表明,胞外水解酶如β-1,3-葡聚糖酶、纤维素酶、蛋白酶、几丁质酶可以降解真菌细胞壁,在植物病害防治方面起到一定作用[16]。芽孢杆菌在发挥抗生作用的过程中产生多种抗菌物质来抑制植物病原菌,这些抗菌物质主要分为2类,其中一类是具有抗真菌活性的脂肽类抗生素,如表面活性素、伊枯草菌素、丰原素等,另一类是具有抗细菌活性的聚酮类抗生素和细菌素,它们均能够破坏细胞膜的屏障功能,是芽孢杆菌抗菌防病的重要机制[17-18]。本研究发现,解淀粉芽孢杆菌B10-26能够分泌β-1,3葡聚糖酶、蛋白酶、纤维素酶等胞外水解酶,不能产生几丁质酶;检测到B10-26菌株基因组中存在fenB、srfAD、baeB等抗生素合成相关基因,表明B10-26菌株具有产丰原素和表面活性素等脂肽类抗生素以及聚酮类抗生素的能力,这与张华等[19]报道一致。辛雅芬等[20]也曾指出,许多细菌和真菌产生的胞外酶和其他次级代谢产物,尤其是抗生素,都参与了抑制植物病原菌的生防活动。因此,推测B10-26菌株能够产生胞外水解酶和抗生素,并在协同作用下使病原真菌菌丝顶端细胞壁和细胞膜的张力发生不平衡,导致菌丝顶端膨胀、破碎,最终死亡,从而达到抑制植物病原真菌的目的。
