小麦硒敏感性的基因型差异分析①
2019-01-03孙发宇顾世梁
杨 亮,孙发宇,李 磊,顾世梁,李 韬
小麦硒敏感性的基因型差异分析①
杨 亮,孙发宇,李 磊,顾世梁,李 韬*
(扬州大学江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室,江苏扬州 225009)
土壤中硒分布不均匀,富硒土壤中硒含量可达1 200 mg/kg,硒含量过高对大多数植物均有毒害作用。小麦是我国重要的主要粮食作物,筛选硒耐性强的小麦品种有利于实现小麦在富硒地区更好的推广。本研究选择99份小麦品种(系)进行盆栽试验,在拔节期进行处理设置(硒处理每盆硒酸钠用量120 mg/L,记作Se120;以硒酸钠0 mg/L处理为对照,记作CK),比较不同品种(系)小麦硒处理下农艺性状的变化。结果表明:与CK相比,过量施硒后小麦籽粒千粒重显著提高(<0.01),株高、有效叶面积、单株叶片数和功能叶片数均显著下降(<0.01),SPAD值(叶绿素相对含量)则没有显著变化。以Se120和CK之间农艺性状的差异作为小麦的耐硒性指标,通过马氏距离综合评估不同小麦品种对硒的耐受性和敏感性差异,结合聚类分析,发现X325、淮麦18、扬麦15号、淮9440、扬麦11是典型的耐硒品种,而扬麦2号和Corrine是典型的硒敏感型品种。
小麦;硒;耐性评价
硒是人和动物必需的微量元素,具有抗癌[1-4],保护心脏[5]、肝脏[6],增强DNA的损伤修复能力[7],增强免疫力,延缓衰老和增强生殖功能等作用,被誉为“生命火种”[8]。缺硒则会导致多种地方流行性疾病,如克山病、大骨节病等[9-11]。硒不是高等植物的必需元素,但在促进植物生长、提高作物产量、增强作物抗逆性方面有积极作用[12-13]。小麦是富硒能力最强的主粮作物之一[14],能够将无机硒转化为对人体和动物有利的有机硒。而土壤中有效硒含量的丰缺与人体健康密切相关[15]。
硒的生物强化是提高小麦籽粒硒含量的主要策略,目前硒强化的方式主要有基部施硒和叶面喷施硒肥。通常情况下,适量浓度的硒处理能对小麦生长发育有积极影响,但硒处理浓度超过合理的阈值,就会影响小麦的正常生长,出现分蘖减少、株高降低现象,叶面表现出烫伤状损伤等毒害症状,最终导致小麦品质下降[16]。在富硒小麦的培育或选择过程中不仅要考虑最终籽粒的硒含量还要考虑产量的变化,因此筛选既富硒又耐硒的小麦品种更有利于小麦硒生物强化。中国是缺硒国家[17],但也有天然富硒区,中国地表土和水体中硒含量最高的地区是湖北恩施和陕西紫阳[18],两地土壤中的平均硒含量高达27.81 mg/kg[19]和23.54 mg/kg[20]。而高浓度硒可能通过农作物危害人体健康[21],因此存在潜在中毒的风险。湖北恩施地区人均硒摄入量为575 μg/d,高于WHO规定的550 μg/d的最高安全阀值,若通过筛选耐硒且富硒的小麦品种,将无机硒转化为有机硒,这些富硒面粉可作为配粉生产富硒功能食品(或面制品等),从而充分利用高硒区的天然硒资源。
本研究以来源广泛的99个小麦品种(系)为材料,研究不同品种对过量硒的敏感性和硒耐性。硒耐性是复杂的数量性状,单一指标难以反映品种的硒耐性。本文以6个农艺性状的相对值(硒处理/对照)反复标准化后进行聚类分析,结合马氏距离综合评价不同品种硒耐性,以筛选耐硒品种,为后续在天然高硒区推广或选育小麦品种提供借鉴。
1 材料与方法
1.1 供试材料和试验设置
本试验所选的材料包含中国的地方品种、育成品种和部分国外引进品种,共99个品种(系),均为遗传上的纯系(表1)。采用盆栽试验进行随机区组设置,设施硒与对照2个处理,每个处理重复2次。每盆装土15 kg,每盆播种10粒种子,出苗后最终定苗为每盆6株。在小麦整个生育期,复合肥(氮∶磷∶钾=16%∶16%∶16%)以基肥一次性施入(每盆3 g),氮肥分3次施用,累计每盆4 g。施硒处理采用根施硒酸钠的施硒方式,每盆硒酸钠用量为120 mg/L,在拔节期一次性施入,对照处理只浇施等量体积的水。土壤中基础硒含量为0.016 mg/kg。

表1 99个小麦品种(系)
1.2 小麦农艺性状的表型鉴定
以株高(plant height,PH)、千粒重(thousand kernel weight,TKW)、SPAD值(叶绿素相对含量)、功能叶片数(the number of functional leaf,NFL)、单株叶片数(leaf number per plant,NPP)和有效叶面积(the green leaf area,GLA)共6个农艺性状在硒处理与对照之间的差异或比值作为硒耐性指标。
SPAD值利用叶绿素含量测定仪(SPAD-502)在小麦抽穗期进行测定,每盆随机取3株,测定部位为旗叶中部。株高、功能叶片数、单株叶片数和有效叶面积在花后25 d每盆随机挑选3株小麦进行测定。千粒重在小麦成熟后以盆为单位进行收获,收获后立即脱粒,并将籽粒放在65℃的烘箱中处理10 h后,每盆随机选取1 000粒称重,重复2次。
1.3 籽粒及土壤硒含量的测定
籽粒:称取0.5 g干燥后的籽粒,加入5 ml浓硝酸、3 ml水和两滴过氧化氢在微波消解仪上进行消解,升温至180℃并维持10 min;消解液最后定容在50 ml的容量瓶中,用等离子发射光谱-原子吸收仪测定硒含量。
土壤:在播种前,从土堆中随机取8个样品。土样在阳光下晒干后过100目筛,取0.5 g土加5 ml王水(盐酸∶硝酸=3∶1,体积比)在微波消解仪上进行消解,升温至250℃并维持10 min;消解液最后定容在50 ml的容量瓶中,用等离子发射光谱-原子吸收仪测定硒含量。
1.4 数据分析
采用SPSS16.0和SigmaPlot10.0进行数据分析和作图,同时使用Excel辅助数据收集、处理以及图表的绘制。马氏距离计算、聚类分析用Matlab软件进行。
2 结果与分析
2.1 施硒对小麦籽粒硒含量的影响
图1显示,硒处理小麦籽粒中的硒含量与对照相比显著提高(<0.001),对照处理小麦籽粒的平均硒含量为1.81 mg/kg,硒处理小麦籽粒平均硒含量达到143.22 mg/kg。在99个小麦品种(系)中,硒处理籽粒中含硒总量排名前10% 的品种为:周麦13(307.85 mg/kg)、Jupatecar()(251.00 mg/kg)、丰优3号(235.65 mg/kg)、秦麦11(234.12 mg/kg)、西麦1376(230.55 mg/kg)、宁麦14(224.35 mg/kg)、镇9523 (209.93 mg/kg)、豫50(200.90 mg/kg)、陕89150(198.18 mg/kg)。
2.2 施硒对小麦主要农艺性状的影响
图2显示了对照与硒处理小麦的农艺性状差异。由图2可知,硒处理小麦株高有极显著的降低(<0.01),硒处理小麦株高平均值仅为58.19 cm,而对照株高平均值为74.13 cm,降幅高达15.94 cm;对照小麦SPAD平均值为27.81,硒处理平均值为26.74,二者差异不显著(>0.05);对照小麦千粒重为40.23 g,硒处理小麦达到43.17 g,较对照平均增加2.93 g,增幅显著(<0.01)。施硒显著降低小麦的有效叶面积、单株叶片数以及功能叶片数(<0.01),对照处理的相应均值为4.31 cm2、19.37和11.57,硒处理较对照分别下降了0.83 cm2、3.94和3.50。因此,施硒总体上增加了小麦籽粒千粒重,但降低了小麦株高、有效叶面积、单株叶片数和功能叶片数。

图1 硒处理和对照条件下不同品种(系)的籽粒硒含量

(图中PH、TSW、GLA、NPP和NFL分别代表株高、千粒重、有效叶面积、单株叶片数、功能叶片数;下同; **表示处理间差异达P<0.01显著水平)
2.3 小麦农艺性状对硒处理的响应
不同小麦品种(系)对高浓度硒的耐性不同,表现出较大的差异。部分品种(系)受高浓度硒处理的影响较小,对硒的表现为较强的耐性;而一些品种(系)对高浓度硒处理表现敏感,即对硒的耐性较弱,这些材料在高浓度硒处理后植株的生长发育会受到一定程度的毒害和抑制。
2.3.1 株高对硒处理的响应 本试验所使用的硒浓度能够极显著地降低小麦植株高度(<0.01)。对照小麦的株高主要集中于70 ~ 80 cm;而硒处理小麦株高主要集中于55 ~ 65 cm。不同基因型小麦品种对硒的反应存在差异,大部分表现为株高降低,但是其降幅的程度不同,其中降幅超过30 cm的品种(系)有12个(图3A),包含Corrine(加拿大)以及11份来自中国的品种(系),降幅在10 ~ 20 cm的品种除来自美国的Field-H、Jupatecar() 2个材料外,其余42个都是中国品种(系)。扬麦15、扬麦17和X325的株高对施硒不敏感。
2.3.2 SPAD值对硒处理的响应 总体而言,小麦叶片的SPAD值在硒处理与对照之间差异不显著,但不同品种(系)间SPAD值有显著差异(图3B)。其中,59个品种(系)硒处理SPAD值有显著的降低(<0.01),徐麦30(–23.28)、苏2006(–23.13)、镇9759 (–21.27)、扬麦11(–20.90)、罗麦8号(–20.62)的降幅均超过20,而变化幅度在4以内的品种(系)共有32个。施硒后SPAD有提高的品种(系)有40个,其中增幅较大的是川麦26(29.32)、宁资8号(27.99)、扬麦2号(21.80)等。
2.3.3 千粒重对硒处理的响应 70个品种(系)施硒后千粒重有增加的趋势(图3C),增幅最大的品种为扬麦16号(16.73 g),其次为淮麦9467(13.56 g)、扬麦6号(13.44 g)、扬麦12号(13.36 g)和扬麦2号(10.24 g),这5个品种的千粒重增幅大于10 g,这说明施硒能有效提高大多数品种(系)籽粒的千粒重;而29个品种(系)的千粒重施硒后有所降低,降幅最大的是Corrine(–40.42 g),其次为济南17(–35.27 g)、和罗麦8号(–11.04 g)、青紫1号(–10.54 g),共4个品种千粒重的降幅大于10 g。变幅在1 g以内的品种(系)有22个,均为中国品种(系),包括茶定红麦、丰优5号、淮9440等。
2.3.4 有效叶面积对硒处理的响应 不同品种(系)有效叶面积对硒的响应不同(图3D),78个品种(系)施硒后其有效叶面积降低,降幅最大的为美国的Field-H(-6.33 cm2),其次为Jupatecar+)(-4.52 cm2)、宁资18(–4.25 cm2),西麦1376(–4.04 cm2),降幅均在4 cm2以上,说明这些品种(系)受硒的影响较大,硒对这些品种(系)的生长表现出明显的抑制作用;而21个品种(系)的有效叶面积施硒后升高,增幅最大的为6209、X215和豫18三个品种(系),分别增加6.18、2.79 和1.41 cm2,表明这些品种(系)在有效叶面积方面对高浓度硒具有较好的耐性。
2.3.5 单株叶片数对硒处理的响应 硒处理总体降低了小麦的单株叶片数(图3E),但不同品种(系)间单株叶片数对硒的敏感程度不同。共有72个材料在高硒处理后单株叶片数下降,其中,施硒后单株叶片数降低较大的品种(系)主要包括Field-H(–22.63)、Jupatecar()(–20.14)、宁资18(–19.92)、扬麦15号(–16.28)和川麦26(–16.21),表明这些品种(系)单株叶片数极易受到硒的影响。安徽11、周麦13、陕107-6、X152和Amadina单株叶片数在高硒浓度下变化较小,平均降幅不到1,表明施硒对这些品种单株叶片数影响较小。共有27个品种(系)在高硒处理下单株叶片数升高,其中,增幅较大的有6209(26.69),X215(12.14)、豫18(7.97)等。
2.3.6 功能叶片数对硒处理的响应 绝大部分品种的功能叶片数在施硒后降低(图3F),降幅最大为Field-H(-20.31),其次为Jupatecar()、宁资18和西麦1376,降幅分别为17.41、16.59和14.20。而施硒后功能叶片数增加的品种有21份,6209的增幅最大,达到14.76,其次是X215(7.48)、甘春20(4.30)和千斤早(4.18);而7001、9085早、陕89150、Corrine、皖麦33、313、X076、周麦13、鲁22、扬158-6和淮麦19在施硒后其功能叶片数基本保持不变。
2.4 基于农艺性状的聚类分析
用上述6个农艺性状的相对值(硒处理/对照)作为综合指标,经过反复标准化后,对99个材料进行聚类分析,总共划分成5大类群(表2)。第1类群包括甘春20号、烟辐188、Corrine、扬麦2号,占总品种数4.04%;第2类群包括Bobwhite、扬麦15号、扬麦17号等26个品种(系),占总材料数26.26%;第3类群包括CS、Wheaton、HFZ等42个品种(系),占总数42.42%;第4类群包括扬麦6号、安农2号、千斤早等14个品种(系),占总数14.14%;第5类群包括镇9523、宁资8号、山东农006等13个品种(系),占总数13.13%。从聚类结果可以看出,来自同一地区的品种多数被分在同一类群,如扬麦系列的9个品种中有5个被分在第4类群,宁麦系列的5品种中有4个品种被分在第3类群。但同一类群中也包括不同来源的品种。

图3 各品种小麦6个性状在硒处理与对照间的变化量(Se120-CK)
2.5 基于马氏距离的综合评价
在99个小麦品种(系)中加入1个对照,假设该对照6个农艺性状的相对值(硒处理/对照)均为1(即硒处理与对照无差异),以此作为参考,选出与对照马氏距离(数值)最小的品系X325,再以X325为对照,分析各材料与对照之间的差异(距离),实现了对品种(系)的整体评价(表3),距离(数值)越小,表明硒耐性越好。同时,结合6个农艺性状反复标准化(消除不同指标的量纲差异)进行聚类,分析不同材料的差异性和共性,其中第2类材料总体耐性较好(表4),SPAD差值、有效叶面积差值及功能叶片数差值均在1以内,单株叶片数差值在3以内,该类包含对照品系X325等23个材料,淮麦18、扬麦15号、淮9440和扬麦11对硒具有较高的耐性。第3、第4类材料耐性稍弱,SPAD差值、单株叶片数差值、功能叶片数差值均在2以上,表现为中度耐硒。第5类为中等硒敏感性材料,第1类材料耐性最差,对硒较敏感。

表2 99个小麦品种(系)聚类分析结果
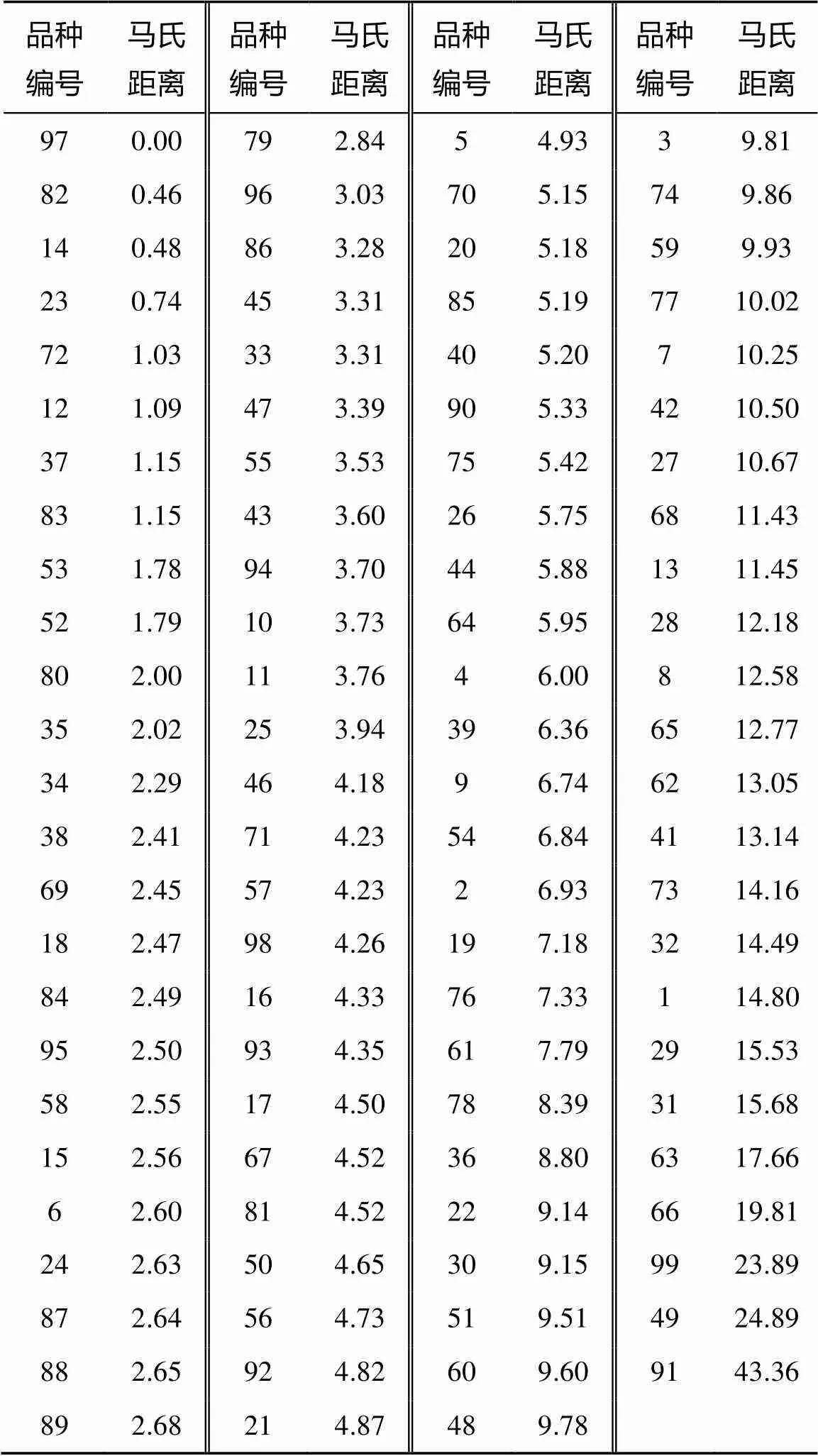
表3 98个小麦品种(系)分别与对照品系X325之间的马氏距离
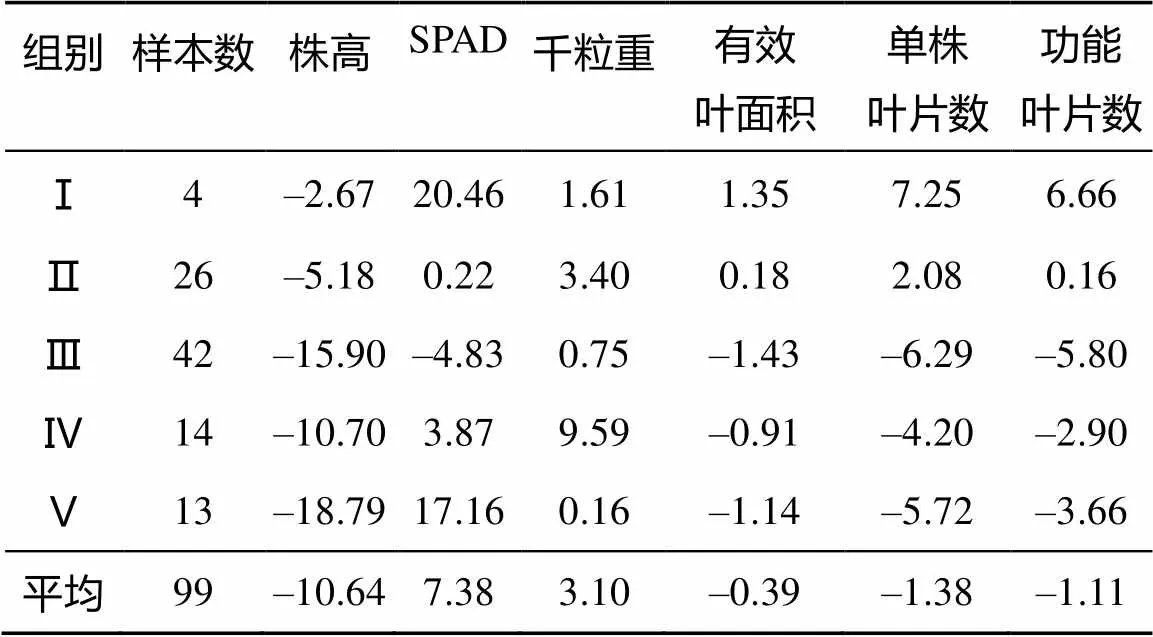
表4 不同组别材料6个农艺性状差值(Se120-CK)的平均值
3 讨论
3.1 小麦硒耐性指标的评价方法
小麦硒耐性评价可以通过两种方法进行评价。一是根据小麦施硒后叶片的颜色变化及坏死程度进行评价,但根据叶色及坏死程度进行判断硒耐性存在很大的人为误差;二是通过硒处理后的主要农艺性状变化进行评价,其可间接地反映品种对硒的耐性能力。由于品种的不同农艺性状在硒处理后变化不一,有的呈增加趋势,有的呈降低趋势,这为综合筛选耐硒品种带来了不便。耐硒材料的筛选由于受到性状多、群体大、性状间相关性等因素的影响,根据单一表型筛选,会对评选结果造成一定的误差[22],而且性状受制于变异度的大小,使聚类结果难以一致。将小麦6个主要农艺性状的相对值(硒处理/对照)反复标准化,直到分类不再改变,可使分类结果相对准确,容易分析。本研究采用反复标准化的聚类分析法以及马氏距离综合评价法筛选硒耐性品种,既简化了选择过程,且具有科学性。聚类分析在研究作物品种的差异和分类方面,证明是比较可行的分析评价方法[23]。目前,聚类分析在小麦农艺性状[24]及品质指标[25]等研究中都有应用,在小麦白粉病抗性的研究中也涉及结合马氏距离进行综合评价[26]。本文在聚类分析的同时,还根据材料间的马氏距离综合评价小麦的耐硒性,这是创新之处。基于马氏距离,把评价对象不同方面的多个指标信息汇集成为一个综合指标,由此来反映被评价对象的整体情况,实现了对多个品种的多个指标进行综合评价和比较,有利于掌握品种整体硒耐性情况,给耐硒品种选育提供比较全面的信息。
3.2 小麦籽粒硒含量和植株硒耐性的关系
植物对高浓度盐离子的应对机制主要有耐盐和排盐。研究表明植物对硒的耐受能力主要来自于它对硒的转化即排盐,将Se6+最终转化成挥发态的二甲基硒醚或二甲基二硒醚[27-29],推测可能是硒耐性好的小麦将Se6+转化成挥发态硒的效率更高,将一部分硒挥发出去,从而降低硒过量对小麦造成的伤害,导致籽粒中的硒含量低于硒敏感的品种。还有研究表明植物硒含量是一个综合作用的结果[30-31]。本试验所设硒处理浓度为120 mg/kg,远远超过小麦等作物正常硒生物强化所用到的浓度。试验结果显示,硒耐性较好的品种(系)X325、扬麦15号、淮9440在硒处理后籽粒硒含量分别增加81.77、85.65 和98.47 mg/kg,硒含量增加值在99个品种中排名在后20%,推测较耐硒的原因是拒硒性或者转化为气态硒排出体外。硒敏感性品种扬麦2号在硒处理后籽粒硒含量增加112.35 mg/kg,显著高于扬麦15号,其硒敏感的原因很可能是吸收效率高而造成毒害。因此高硒区应筛选适度拒硒或者能够将毒性较高的无机硒高效转化为有机硒进而转化为气态硒挥发的小麦品种,即适宜高硒区本地强化的品种应该具有较好的硒耐性但硒含量中等或较低,当然也可以筛选硒高效积累且耐硒的品种,其产品可作为配粉用于缺硒地区的生物强化。
4 结论
由于硒耐性是复杂的数量性状,难以用单一指标进行合理的评价,本研究创新地将聚类分析及马氏距离综合分析方法应用到小麦耐硒性的评价上,将不同量纲的多性状进行了反复标准化降维,提高了硒耐性评判的准确性。利用反复标准化的聚类分析,同时基于马氏距离综合分析共筛选出5个适宜在高硒区进行强化或育种利用的耐硒品种(系)(X325、淮麦18、扬麦15号、淮9440、扬麦11)。而硒敏感型品种(扬麦2号和Corrine)可能硒吸收效率较高,因此适宜在贫硒地区进行推广或育种利用。本研究结果为今后区别性对待高硒和贫硒土壤的小麦品种选育和推广等提供了支撑。
[1] Sun Q L, Dong M M, Wang Z H, et al. Selenium-enriched polysaccharides fromPyracantha fortuneana(Se-PFPs) inhibit the growth and invasive potential of ovarian cancer cells through inhibitingβ-catenin signaling[J]. Oncotarget, 2016, 7(19): 28369–28383
[2] Stolzoff M, Webster T J. Reducing bone cancer cell functions using selenium nanocomposites[J]. Journal of Biomedical Materials Research Part A, 2016, 104(2): 476–482
[3] Outzen M, Tjønneland A, Larsen E H, et al. Selenium status and risk of prostate cancer in a Danish population[J]. The British Journal of Nutrition, 2016, 115(9): 1669–1677
[4] Liu Y Z, Li W Y, Guo M Y, et al. Protective role of selenium compounds on the pProliferation, apoptosis, and angiogenesis of a canine breast cancer cell line[J]. Biological Trace Element Research, 2016, 169(1): 86–93
[5] Chaâbane M, Tir M, Hamdi S, et al. Improvement of heart redox states contributes to the beneficial effects of selenium against penconazole-induced cardiotoxicity in adult rats[J]. Biological Trace Element Research, 2016, 169(2): 261–270
[6] Xiao X, Yuan D, Wang Y X, et al. The protective effects of different sources of maternal selenium on oxidative stressed chick embryo liver[J]. Biological Trace Element Research, 2015, 172(1): 201–208
[7] Rosa V D, Erkekoğlu P, Forestier A, et al. Low doses of selenium specifically stimulate the repair of oxidative DNA damage in LNCaP prostate cancer cells[J]. Free Radical Research, 2012, 46(2): 105–116
[8] Rayman M P. Selenium and human health[J]. Lancet, 2012, 379(9822): 1256–1268
[9] Zhou X R, Yang H J, Fang G, et al. T-2 toxin alters the levels of collagen II and its regulatory enzymes MMPs/TIMP-1 in a low-selenium rat model of Kashin-Beck Disease[J]. Biological Trace Element Research, 2016, 169(2): 237–246
[10] Zhao Z J, Li Q, Yang P Z, et al. Selenium: A protective factor for Kaschin-Beck disease in Qing-Tibet Plateau[J]. Biological Trace Element Research, 2013, 153(1/2/3): 1–4
[11] Jirong Y, Huiyun P, Zhongzhe Y, et al. Sodium selenite for treatment of Kashin-Beck disease in children: A systematic review of randomised controlled trials[J]. Osteoarthritis and Cartilage, 2012, 20(7): 605–613
[12] 高阿祥, 周鑫斌, 张城铭. 硒(IV)预处理下根表铁膜对水稻幼苗吸收和转运汞的影响[J]. 土壤学报, 2017, 54(4): 989–998
[13] White P J. Selenium accumulation by plants[J]. Annals of Botany, 2016, 117(2): 217–235
[14] 李韬, 兰国防. 植物硒代谢机理及其以小麦为载体进行补硒的策略[J]. 麦类作物学报, 2012, 32(1): 173–177
[15] 马迅, 诸旭东, 宗良纲, 等. 不同调控措施对酸性富硒土壤硒有效性及水稻产量性状的影响[J]. 土壤, 2018, 50(2): 284–290
[16] 李春喜, 蒿宝珍, 姜丽娜, 等. 小麦生长发育过程中硒的研究进展[J]. 安徽农业科学, 2007, 35(13): 3811–3814
[17] 彭大明. 中国硒矿资源概述[J]. 化工矿产地质, 1997, 19(1): 36–42
[18] Tan J A, Zhu W Y, Wang W Y, et al. Selenium in soil and endemic diseases in China[J]. Science of the Total Environment, 2002, 284(1/2/3): 227–235
[19] Yuan L X, Yin X B, Zhu Y Y, et al. Selenium in plants and soils, and selenosis in Enshi, China: Implications for selenium biofortification[M]. Berlin: Springer Netherlands, 2012: 7–31
[20] Zhao C Y, Ren J H, Xue C Z, et al. Study on the relationship between soil selenium and plant selenium uptake[J]. Plant and Soil, 2005, 277(1/2): 197–206
[21] 何兴强. 富硒农业发展中的安全问题及对策[J]. 安徽地质, 2012, 22(4): 294–296
[22] 王亚娟, 张秋芳, 任志龙, 等. 小麦优异种质资源农艺性状综合鉴定与评价[J]. 麦类作物学报, 2004, 24(4): 119–122
[23] 周丽艳, 郭振清, 马玉玲, 等. 春小麦品种农艺性状的主成分分析与聚类分析[J]. 麦类作物学报, 2011, 31(6): 1057–1062
[24] 王有武, 魏凌基, 艾尼瓦尔, 等. 春小麦谷蛋白亚基、醇溶蛋白电泳谱带及主要品质指标的主成分分析和聚类分析[J]. 石河子大学学报(自然科学版), 2004, 22(4): 277– 281
[25] 陈欢, 张存岭. 基于主成分–聚类分析评价长期施肥对砂姜黑土肥力的影响[J]. 土壤学报, 2014, 51(3): 609–617
[26] 李韬, 李嫒嫒, 李磊, 等. 温室条件下小麦白粉病抗性的综合评价和高抗品种的筛选[J]. 麦类作物学报, 2016, 36(4): 435–442
[27] Eiche E, Bardelli F, Nothstein A K, et al. Selenium distribution and speciation in plant parts of wheat() and Indian mustard () from a seleniferous area of Punjab, India[J]. Science of the Total Environment, 2015, 505: 952–961
[28] Pilonsmits E A H, Quinn C F. Selenium metabolism in plants[J]. Plant Cell Monographs, 2010, 17: 225–241
[29] Pilonsmits E A H, Leduc D L. Phytoremediation of selenium using transgenic plants[J]. Current Opinion in Biotechnology, 2009, 20(2): 207–212
[30] 张城铭, 周鑫斌, 高阿祥. 水稻不同生育期对硒吸收累积及铁膜的吸附特性[J]. 土壤学报, 2017, 54(3): 693–702
[31] 周骏, 刘兆云, 孟立丰, 等. 土壤性质对土壤–水稻系统中硒迁移的影响[J]. 土壤, 2016, 48(4): 734–741
Genotypic Differences of Wheat Sensitivity to Selenium Application
YANG Liang, SUN Fayu, LI Lei, GU Shiliang, LI Tao*
(Key Laboratory of Crop Genetics & Physiology of Jiangsu Province, Yangzhou University/Co-Innovation Center for Modern Production Technology of Grain Crops / Key Laboratory of Plant Functional Genomics, Ministry of Education, Yangzhou, Jiangsu 225009, China)
Selenium (Se) distribution in surface soil is non-uniformed. Se content in Se-enriched soil can reach 1 200 mg/kg, toxic to most plants growing in these areas. Therefore, it is important to screen wheat varieties with strong tolerance of Se in Se-rich areas. Ninety-nine wheat varieties were selected for Na2SeO4-tolerance pot experiment. Na2SeO4(120 mg Na2SeO4per pot in 1 L water) (Se120) was applied at the jointing stage of wheat with 0 mg Na2SeO4per pot in 1 L water as control (CK). Chlorophyll content in leaves in heading period (represented by SPAD value), plant height (PH), the green leaf area (GLA), leaf number per plant (NPP) and the number of functional leaf (NFL) were measured in 25 days after flowering for each treatment. Thousand-kernel weight (TKW) was measured after harvest. The differences of these agronomic traits between Se120 and CK was studied. The results indicated that Se120 treatment significantly increased TKW of wheat grains (<0.01), decreased PH, GLA, NPP and NFL significantly (<0.01) compared with the CK, but there was no significant impact on SPAD(>0.05). The differences of agronomic traits between Se120 and CK were taken as an index of wheat Se tolerance. The Mahalanobis distances method and cluster analysis were employed to comprehensively evaluate Se tolerance and sensitivity of wheat. It was found that X325, Huaimai18, Yangmai15, Huai9440 and Yangmai11showed high Se tolerance while Yangmai2 and Corrine were Se sensitive cultivars. This study provides useful information for breeding of wheat varieties with Se tolerance ability and for Se biofortification in wheat.
Wheat; Selenium; Tolerance evaluation
国家自然科学基金项目(31771772)和江苏高校优势学科建设工程项目(PAPD)资助。
(taoli@yzu.edu.cn)
杨亮(1994—),男,江苏苏州人,硕士研究生,主要从事小麦硒生物强化的研究。E-mail: 851228482@qq.com
10.13758/j.cnki.tr.2018.06.021
S326
A
