一株海洋链霉菌发酵条件的优化及其抑菌活性物质的研究
2019-01-02梁光杰车程川巩志金
梁光杰,车程川,巩志金,杨 革*
(曲阜师范大学 生命科学学院,山东 曲阜 273165)
放线菌(Streptomycessp.)属于革兰氏阳性菌,能够产生具有经济意义的次级代谢产物和其他具有药物意义的化合物,当前发现的70%天然抗生素产自放线菌[1],因此被认为是重要的微生物[2-4]。近几十年来,从陆地分离到大量放线菌菌株[5-7],但是从陆地上发现新的放线菌菌株以及新颖的化合物变得越来越困难,所以人们把目光转向海洋。海洋放线菌需要适应极端的海洋环境,所以形成了不同于陆生放线菌的独特、复杂的代谢途径。因此产生的次级代谢产物在结构类型和生物活性方面呈现出多样性和新颖性[8]。ZOBELL C E[9]研究发现,海水具有杀菌的能力,随后世界各国加大对海洋微生物资源开发的力度。研究发现,大约27%种属的海洋微生物次级代谢产物具有抗菌活性的潜力[10],其中放线菌的活性次级代谢产物约占微生物来源的活性次级代谢产物的45%,海洋放线菌次级代谢产物的开发和研究为生产新的抗生素开创了新的途径[11]。微囊化技术、噬菌体定向筛选等新技术广泛的应用使海洋放线菌研究得到飞速的进展[12]。目前为止,对海洋放线菌及其次级代谢产物研究报道很多[13-16]。这些新化合物具有新颖的结构、良好的生物活性,如抑制肿瘤生长[17]、抑制真菌生长[18]、拮抗疟疾[19]以及杀虫的潜力[20-21]。因此,从海洋环境中分离纯化放线菌,对研究海洋放线菌种类的多样性及其次级代谢活性物质具有重大意义[22]。
金黄色葡萄球菌(Staphylococcus aureus)、产气杆菌(Aerobacter aerogenes)和变形杆菌(Proteus)是常见的致病菌。因此选择这3种广泛存在菌株作为指示菌用于海洋放线菌的筛选,以达到寻找新型海洋抗生素的目的。
海洋灰略红链霉菌(Streptomyces griseorubens)F8由本实验室分离于日照海岸线,通过研究影响其抑菌活性的培养条件,优化了其发酵条件。通过探究其发酵产物的性质并对抑菌活性物质进行了粗提,并对粗提物进行了最小抑菌浓度(minimum inhibitory concentration,MIC)的探究,为以后抑菌活性物质进一步的分离纯化奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
灰略红链霉菌(Streptomyces griseorubens)F8:由本实验室分离鉴定并保存到中国微生物菌种保藏管理中心,专利菌种保藏专利号为CGMCC NO.14923。
金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、产气杆菌(Aerobacter aerogenes)CGMCC 1.183、变形杆菌(Proteus)CGMCC 1.491:均为本实验保存。
1.1.2 化学试剂
葡萄糖、可溶性淀粉、硝酸钾、磷酸二氢钾、氯化钠、七水硫酸亚铁、七水硫酸镁(均为分析纯):国药集团化学试剂有限公司;酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;麦芽浸粉(生化试剂):大连美仑生物技术有限公司;AB-8大孔吸附树脂:天津市光复精细化工研究所;钠型732阳离子交换树脂:北京索莱宝科技有限公司;葡聚糖凝胶G25:美国GE公司。
1.1.3 培养基
菌株F8活化培养基采用麦芽浸粉(yeast extract-malt extract-glucose,YMG)培养基:酵母浸粉4 g,葡萄糖4 g,麦芽浸粉10 g,自然海水1 L,pH 7.0~7.5,115 ℃灭菌30 min。
菌株F8发酵培养基采用高氏一号培养基:可溶性淀粉20g,KNO31 g,KH2PO40.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.05 g,自然海水1 L,121 ℃灭菌20 min。
指示菌生长培养基采用LB培养基:NaCl 10 g,蛋白胨10 g,酵母浸粉5 g,蒸馏水1 L,121℃灭菌20 min。
1.2 仪器与设备
DK-8D电热恒温水槽:上海精宏实验设备有限公司;PHS-3CpH计:上海仪电科学仪器股份有限公司;GNP-9080型隔水式恒温培养箱;Lab-Therm LT-X振荡培养箱:比欧科技国际发展有限公司;HP PLUS 10D全自动蛋白纯化系统:利穗科技(苏州)有限公司;1-14小型台式离心机、3-18KS高速冷冻离心机:美国Sigma公司;Alpha 1-2LD plus冷冻干燥机:德国CHRIST公司。
1.3 方法
1.3.1 菌株的活化
将菌株F8从甘油管中取出,接种于固体YMG培养基中,于恒温培养箱中28℃条件下培养7 d。
1.3.2 种子液的制备
将活化好的菌株接种于液体高氏一号培养基中180r/min、28℃条件下摇床培养2 d。
1.3.3 抑菌活性的测定
将菌株F8进行发酵(初始pH值7,28℃条件下摇瓶发酵7 d),然后发酵液10 000 r/min离心10 min,取上清进行抑菌活性测试。使用牛津杯法测定抑菌活性:吸取0.2mL指示菌菌液到LB平板表面,用涂布棒将菌液涂布均匀,在培养基表面垂直摆放牛津杯(内径6 mm),轻轻安放,使其与培养基接触无空隙,在杯中加入0.2mL发酵液。然后将平板于37℃条件下培养24h,之后测量透明圈直径(透明圈>6mm,说明具有抑菌作用)。
1.3.4 发酵条件的优化
培养时间对菌株F8抑菌效果的影响:在发酵温度为28℃、180 r/min摇瓶培养,分别在第5~12天每天测定发酵液抑菌效果,每组做3个平行。
接种量对菌株F8抑菌效果的影响:在发酵温度为28℃,接种量分别为5%、6%、7%、8%、9%、10%,180 r/min摇瓶培养11 d,测定发酵液抑菌活性,每组做3个平行。
发酵温度对菌株F8抑菌效果的影响:在接种量为8%,发酵温度分别为20℃、25℃、30℃、35℃条件下,180 r/min摇瓶培养11 d,测定发酵液抑菌活性,每组做3个平行。
发酵液的初始pH对菌株F8抑菌效果的影响:在接种量为8%,发酵温度30℃,培养基初始pH分别为5、6、7、8、9条件下,180 r/min摇瓶培养11 d,测定发酵液抑菌活性,每组做3个平行。
1.3.5 抑菌活性物质稳定性研究
pH稳定性:将发酵液上清(10 000 r/min离心10 min)pH调节至2、3、4、5、6、7、8、9、10、11、12放置1 h,然后再将pH调回到原发酵液pH,分别测定抑菌活性,每组做3个平行,以原发酵液作为对照。
热稳定性:将发酵液上清分别在40℃、50℃、60℃、70℃、80℃、90℃、100℃条件下水浴30 min,分别测定抑菌活性,每组做3个平行,以原发酵液作为对照。
光照稳定性:将发酵液上清置于光照条件下照射1~10 d,然后测定抑菌活性,以原发酵液作为对照。
遗传稳定性:将菌株F8在高氏一号固体培养基连续传代8代,然后每代分别进行摇瓶发酵(发酵液初始pH值为8,接种量8%,30℃条件下摇瓶发酵11 d),测定各代发酵液上清的抑菌效果。
1.3.6 抑菌物质的分离纯化
将10 L发酵液10 000 r/min离心10 min取上清,然后旋转蒸发得到发酵液浸膏,然后用尽量少的水溶解浸膏经过AB-8大孔树脂层析,用体积分数分别为30%、50%、70%及100%的甲醇溶液梯度洗脱,收集甲醇流出液,旋转蒸发至干,然后过钠型732阳离子交换树脂收集流出液,将流出液真空旋转蒸发至干,将2.5 g浓缩样品溶于2 mL超纯水中,经葡聚糖凝胶G25柱层析得到抑菌活性物质粗提物。
1.3.7 粗提物最小抑菌浓度的测定
制备菌液:将指示菌预先活化两代后再接种到液体培养基中,在37℃条件下培养6~8 h,作为测试菌菌液。
最小抑菌浓度(MIC)的测定:配制不同浓度的发酵液粗提物于试管中,在含不同浓度的粗提物试管中,各加入测试菌0.2 mL,充分混匀。另作两个对照管(只含菌和只含粗提物)。将上述试管置37℃恒温箱中培养24h。取出试管,充分振荡,用肉眼逐个观察各试管的浑浊度。如某管培养液与对照管(只含粗提物的试管)同样透明,则表明测试菌的生长被抑制,因此该管的粗提物量即为MIC。
2 结果与分析
2.1 培养时间对抑菌效果的影响
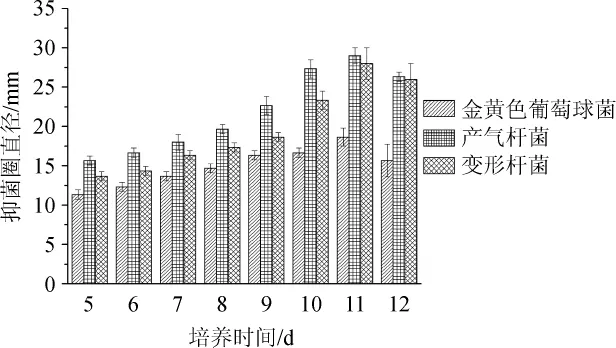
图1 不同培养时间对菌株F8抑菌活性的影响Fig.1 Effect of different culture time on antibacterial activity of strain F8
由图1可知,随着培养时间在5~11 d范围内增加,发酵液对3种指示菌的抑制作用越来越强,说明随着培养时间的增加产生的抑菌活性物质越来越多;当培养时间到第11天时抑菌作用达到最大,对金黄色葡萄球菌、产气杆菌、变形杆菌的抑菌圈直径分别为19 mm、29 mm、28 mm;当培养时间超过11d时,抑菌效果减小,原因可能是当培养天数超过一定值时,抑菌活性物质所处的发酵环境发生了变化导致活性物质降解,从而导致抑菌效果减小。因此,最适培养时间为11d。
2.2 接种量对抑菌效果的影响
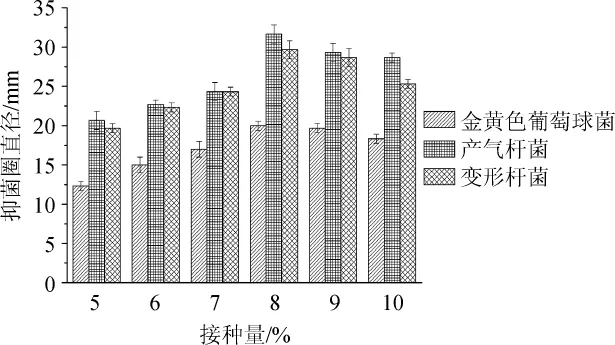
图2 不同接种量对菌株F8抑菌活性的影响Fig.2 Effect of different inoculum on antibacterial activity of strain F8
由图2可知,随着接种量在5%~8%范围内增加,发酵液抑菌效果也随着增加;当接种量为8%时抑菌效果达到最好,对金黄色葡萄球菌、产气杆菌、变形杆菌的抑菌圈直径分别为20 mm、32 mm、30 mm;当接种量>8%之后,抑菌效果反而减小,原因可能是菌体生长所需要的氧气、营养物质增加而三角瓶内的溶氧跟营养物质不能满足其生长从而降低抑菌活性物质的生产使抑菌效果增加不明显。因此,最适接种量为8%。
2.3 不同发酵温度对抑菌效果的影响
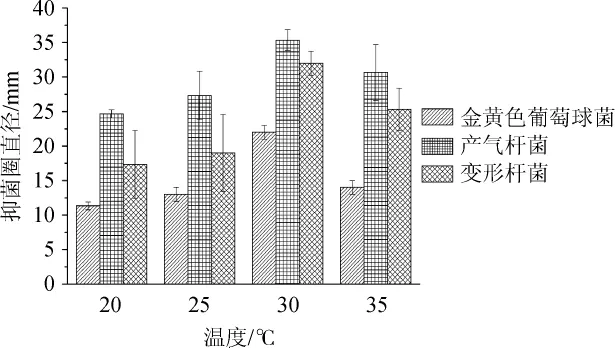
图3 不同培养温度对菌株F8抑菌活性的影响Fig.3 Effect of different culture temperature on antibacterial activity of strain F8
由图3可知,当发酵温度在20~30℃范围内升高,发酵液抑菌效果随着温度的增加而增大;当发酵温度为30℃时,发酵液抑菌效果最好,对金黄色葡萄球菌、产气杆菌、变形杆菌的抑菌圈直径分别为22 mm、35 mm、32 mm;当发酵温度高于30℃之后,发酵液抑菌效果降低,原因是当超过最适温度以后菌株的生长状况不好,所产的抑菌物质减少从而导致抑菌效果降低。因此,最适发酵温度为30℃。
2.4 发酵液的初始pH对抑菌效果的影响
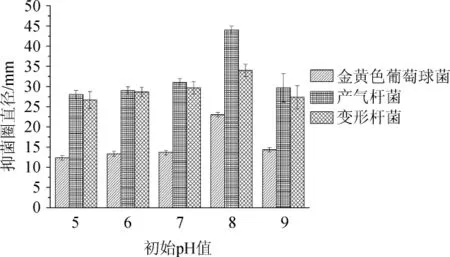
图4 不同初始pH值对菌株F8抑菌活性的影响Fig.4 Effect of different initial pH values on antibacterial activity of strain F8
由图4可知,随着初始pH在5~8范围内增加,抑菌效果随之增加;当初始pH值为8时,抑菌效果达到最好,对金黄色葡萄球菌、产气杆菌、变形杆菌的抑菌圈分别为23 mm、44 mm、34 mm;当初始pH值>8之后,抑菌效果有所下降,原因是过酸或者过碱都不适合生长,所产的抑菌物质减少从而导致抑菌效果下降。因此,最适初始pH值为8。
2.5 抑菌活性物质的pH稳定性
由表1可知,经过不同pH处理菌株F8发酵产物对三种指示菌的抑制作用基本上没有太大变化。结果表明,抑菌活性物质对酸碱有较强的承受能力,pH稳定性较好。
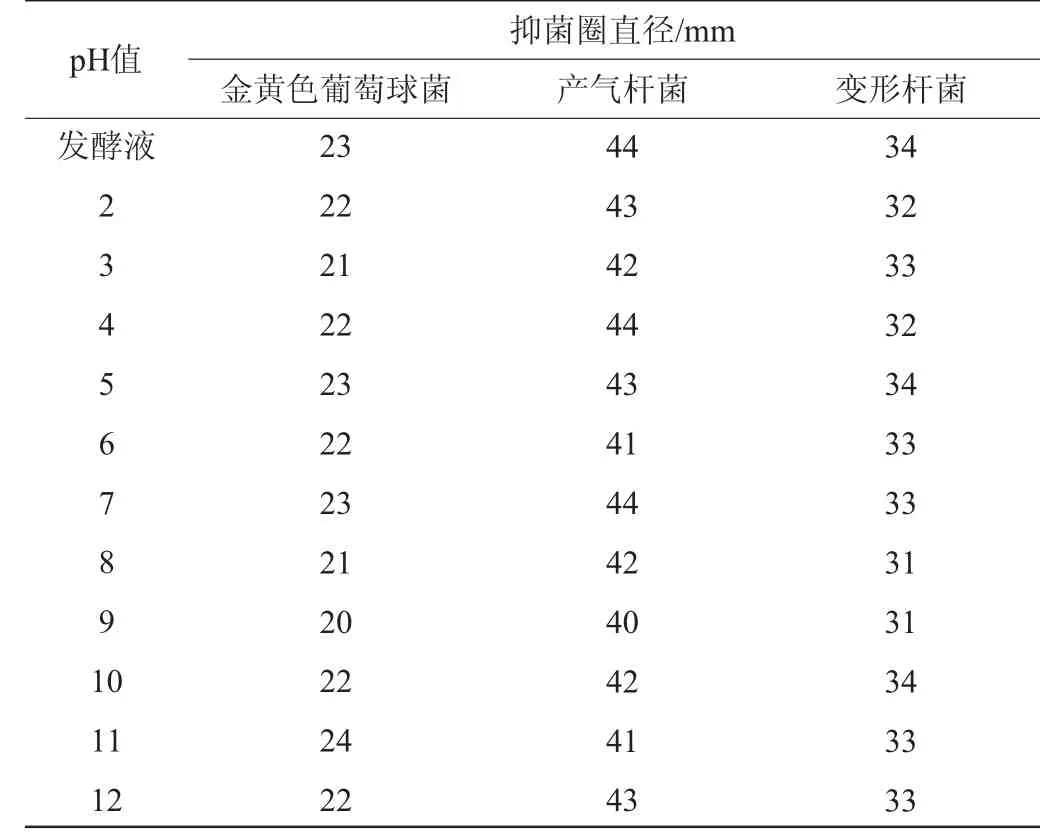
表1 菌株F8发酵产物抑菌活性的pH稳定性Table 1 pH stability of antibacterial activity of fermentation products produced by strain F8
2.6 抑菌活性物质的热稳定性
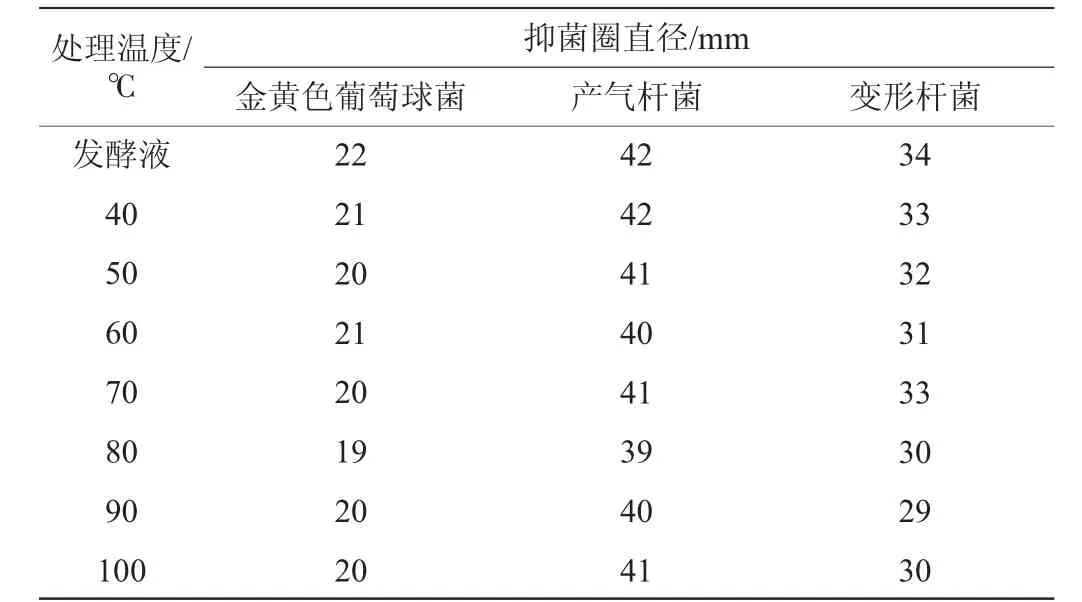
表2 菌株F8发酵产物抑菌活性的热稳定性Table 2 Thermal stability of antibacterial activity of fermentation products produced by strain F8
由表2可知,经过不同温度处理发酵产物对三种指示菌的抑制作用基本上没有太大变化。结果表明,菌株F8发酵所产抑菌活性物质具有很好的热稳定性。
2.7 抑菌活性物质的光照稳定性

表3 菌株F8发酵产物抑菌活性的光照稳定性Table 3 Light stability of antibacterial activity of fermentation products produced by strain F8
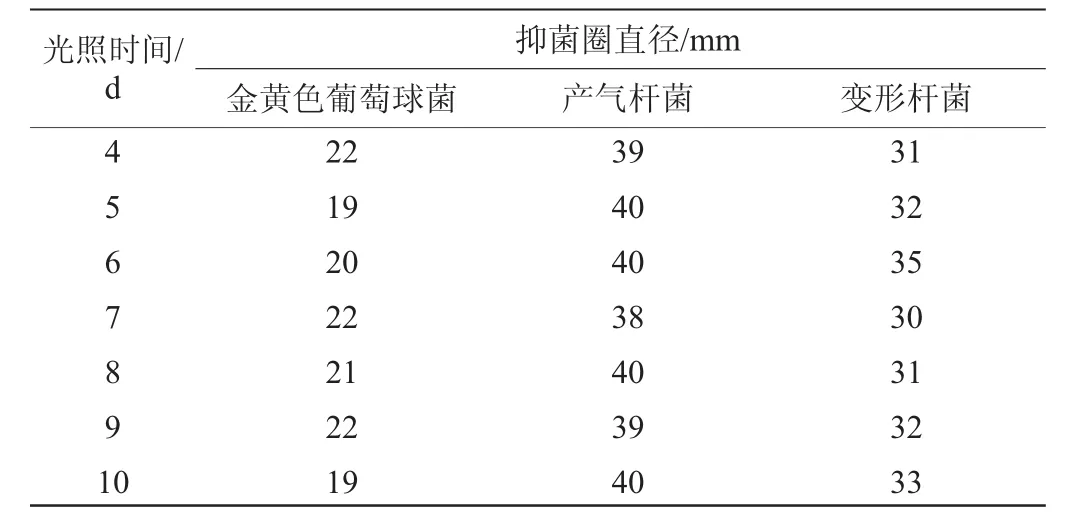
续表
由表3可知,经过不同时间的光照处理,发酵产物对三种指示菌的抑制作用基本上没有太大变化。结果表明,菌株F8发酵所产抑菌活性物质具有很好的光稳定性。
2.8 抑菌活性物质的遗传稳定性
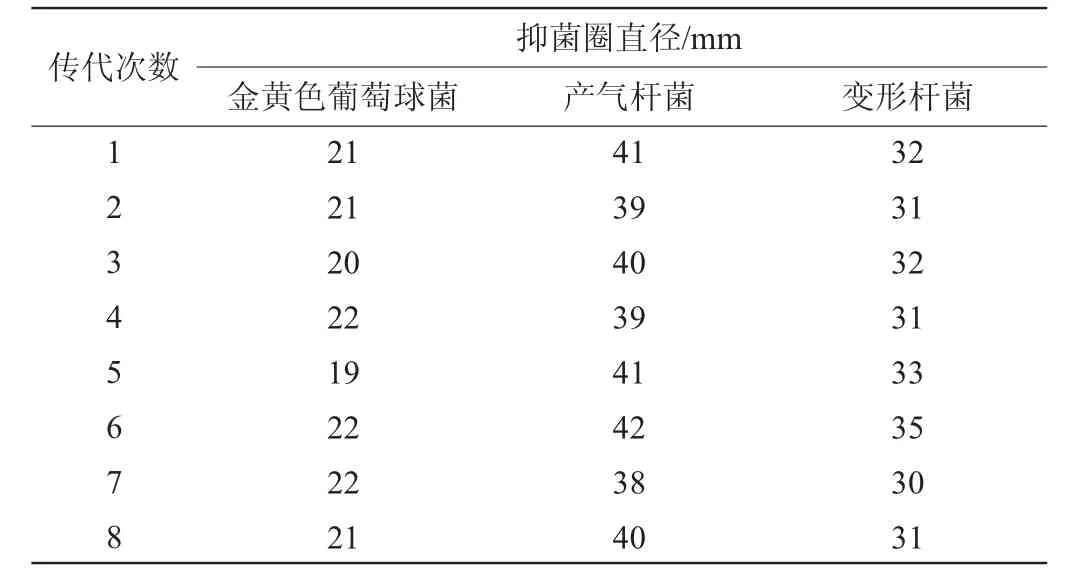
表4 菌株F8发酵产物抑菌活性的遗传稳定性Table 4 Genetic stability of antibacterial activity of fermentation products produced by strain F8
由表4可知,不同传代次数的菌株进行发酵,其发酵液对三种指示菌的抑制作用基本上没有太大变化。结果表明,发酵产物的遗传稳定性较好。
2.9 抑菌物质的分离纯化
10 L发酵液经过旋转蒸发浓缩,AB-8大孔树脂层析,732阳离子交换树脂层析,最后经葡聚糖凝胶G25层析进行分离纯化,洗脱曲线见图5。
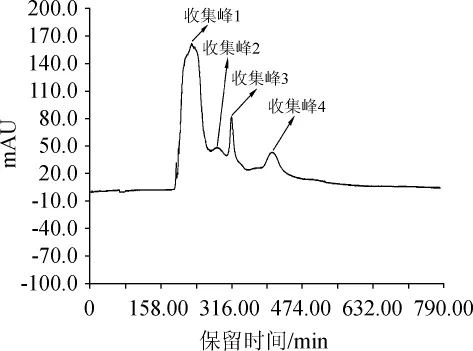
图5 发酵液组分在G25层析柱分离纯化洗脱曲线Fig.5 Elution curve of separation and purification of fermentation liquid components on G25 chromatographic column
由图5可知,一共洗脱出了4个峰,分别收集这4个峰对应的洗脱组分后进行抑菌试验,结果表明,第3个峰对应组分的洗脱液具有抑菌效果。
2.10 最小抑菌浓度
将上述第3个峰洗脱液冷冻干燥后,配制成质量浓度分别为10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL、60 μg/mL、70 μg/mL、80 μg/mL、90 μg/mL、100 μg/mL溶液进行MIC测试,以只含指示菌和只含粗提物两支试管为对照,结果见表5。由表5可知,洗脱组分3对金黄色葡萄球菌的MIC为100 μg/mL,对变形杆菌的MIC为30 μg/mL,对产气杆菌的MIC为20 μg/mL。
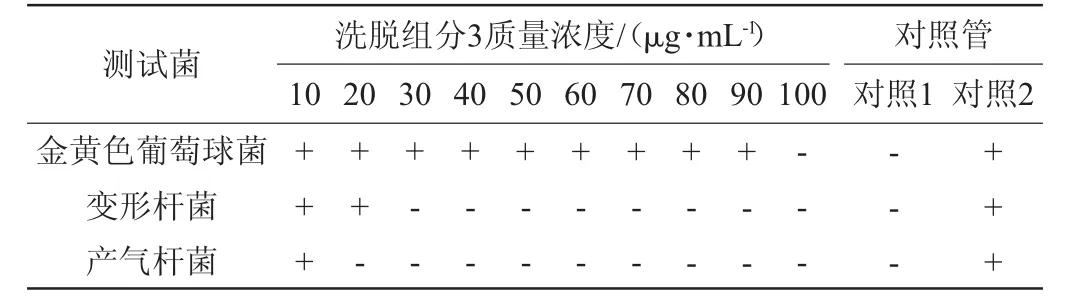
表5 抑菌活性物质粗提物对不同测试菌的最小抑菌浓度Table 5 Minimum inhibitory concentration of crude extracts of antibacterial active substances on different test bacteria
3 结论
本实验对海洋链霉菌菌株F8进行了发酵条件的优化及其抑菌活性物质性质的研究。通过单因素实验确定了菌株最佳发酵条件为培养时间11 d,接种量8%,培养温度30℃,初始pH值为8。优化后菌株F8对金黄色葡萄球菌、产气杆菌和变形杆菌的抑菌圈直径分别为23 mm、44 mm、34mm。对菌株所产抑菌活性物质的性质进行了研究,发现抑菌活性物质为水溶性,并且具有较好的酸碱、热、光照以及遗传稳定性。在此基础上通过AB-8大孔树脂、钠型732阳离子交换树脂以及葡聚糖凝胶G-25层析对抑菌活性物质进行分析纯化,并得到具有抑菌活性的粗提物,其对金黄色葡萄球菌、变形杆菌、产气杆菌的MIC分别为100 μg/mL、30 μg/mL及20 μg/mL。
