三孢布拉霉中类胡萝卜素增产方法的研究进展
2019-01-02陈玉龙杨清香付金菊
陈玉龙,王 强,杨清香*,付金菊
(河南师范大学 生命科学学院,河南 新乡 453007)
类胡萝卜素是一类重要的天然色素,具有减少细胞损伤、减缓衰老等生理功能。目前,已经从自然资源中分离出来600多种类胡萝卜素,仅有50多种是对人类有益,其中被商业开发和利用的只占极少数。
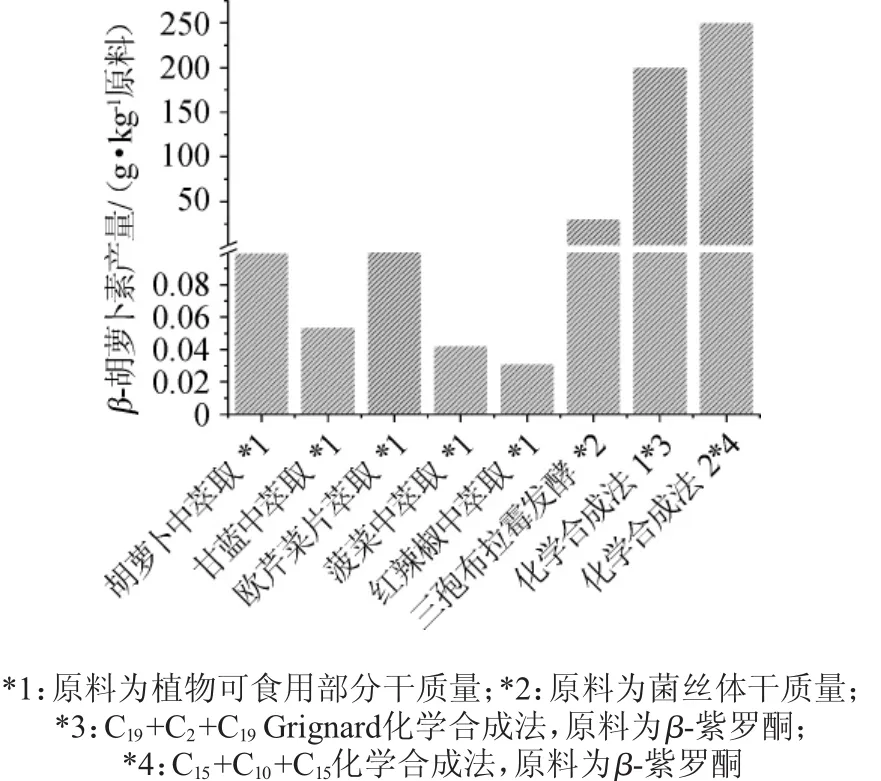
图1 不同生产方法所得β-类胡萝卜素的产量Fig.1 Production of β-carotenoids by different production methods
类胡萝卜素的生产方法主要有三种:天然提取、化学合成和微生物发酵。各种方法的产量见图1[1]。天然提取的原料来源于花卉、植物叶子、鸟类羽毛、水果、甲壳动物壳和鱼肉等,胡萝卜的类胡萝卜素含量高,是目前主流的提取原料。天然提取类法可分为沉淀法萃取、冷冻干燥法提取、天然油脂悬浮液的直接制取法等,其中冷冻干燥提取法已经用于工业化生产[2]。天然提取法生产类胡萝卜素成本高,约50kg胡萝卜才能得到2g左右的类胡萝卜素的结晶体,生产工艺复杂,在市场上很难占据一席之地。自从1953年首创化学合成类胡萝卜素以来,化学合成的类胡萝卜素由于工艺简单、快速、成本低等优势占据了大部分的市场。2015年合成资源在整个行业的价值达到9.036亿美元[1]。Roche和BASF两家公司共同垄断着类胡萝卜素合成资源的市场。Roche公司以β-紫罗酮为原料,通过C19+C2+C19Grignard反应合成β-胡萝卜素,BASF公司同样以β-紫罗酮为原料,经乙烯基β-紫罗兰醇(Ⅳ),以C15+C10+C15方式再通过Witing反应合成β-胡萝卜素。虽然化学合成类胡萝卜素的产量高,但是其合成的β-胡萝卜素100%为全反式,与天然的β-胡萝卜素相比抗遗传毒性弱,长期服用对人体产生毒副作用。相比较前两种生产方法而言,微生物发酵生产的天然类胡萝卜素更为经济、安全,目前发现自然界中许多微生物都具有产生类胡萝卜素的能力,如杜氏藻(Dunaliella)、雨生红球藻(Haematococcus pluvialis)、三孢布拉霉(Blakeslea trispora)、布拉克须霉(Phycomyces blakesleeanus)和卷枝毛霉菌(Mucor circinelloides)等,其中三孢布拉霉类胡萝卜素产量大,且不产生有毒有害的副产物,是运用于工业化生产类胡萝卜素的主要微生物,目前生产厂家有DSM和Vitaene公司,三孢布拉霉发酵所得的类胡萝卜素已获得欧盟、美国食品药品监督管理局等的批准。
三孢布拉霉中类胡萝卜素的生物合成途径是甲羟戊酸途径(mevalonate pathway,MVA pathway)。首先乙酰辅酶A(acetyl-coenzymeA,acetyl-CoA)生成类胡萝卜素的基本骨架,即异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP),然后IPP在一系列酶的催化作用下形成牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP),GGPP在八氢番茄红素合成酶(carRA编码)作用下形成八氢番茄红素,再经过八氢番茄红素脱氢酶(carB编码)作用生成番茄红素,经过番茄红素环化酶(carRA编码)作用最终生成γ-胡萝卜素、β-胡萝卜素(见图2)。
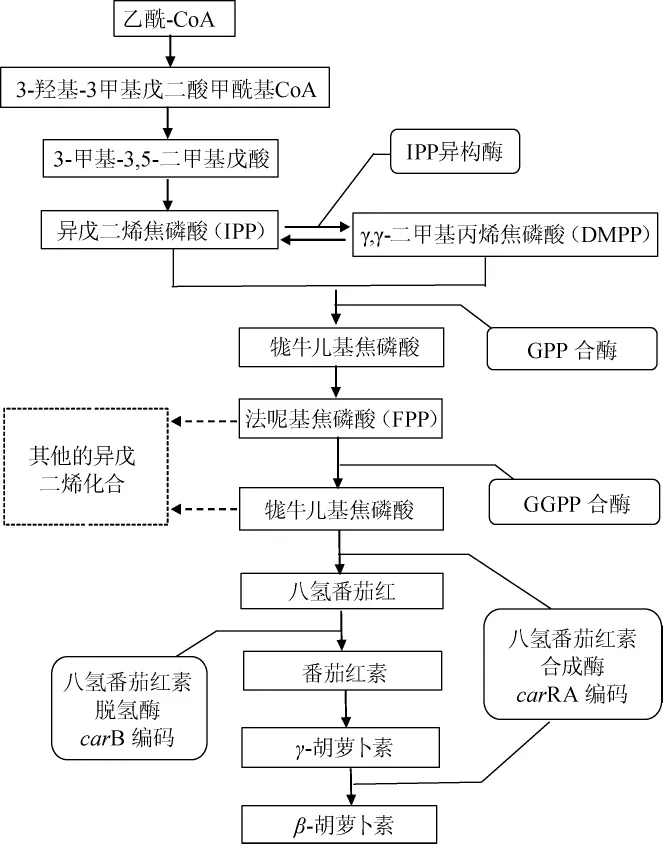
图2 三孢布拉霉中类胡萝卜素代谢途径及关键基因Fig.2 Metabolic pathways and key genes of carotenoid in Blakeslea trispora
三孢布拉霉发酵生产类胡萝卜素虽然已经实现了工业化,但是产量较低,在三孢布拉霉的研究方面,提高类胡萝卜素的产量一直是研究重点。目前的研究主要分为两个方面,其一针对β-胡萝卜素产量的提升,其二是针对番茄红素产量的提升。本文将从菌种的选育、外源添加物、工艺优化三个方面介绍现阶段提高三孢布拉霉类胡萝卜素产量的手段和方法,对不同的手段和方法的优点以及不足进行比较,期望能够为三孢布拉霉工业化发酵生产类胡萝卜素提供参考。
1 优良菌株的选育方法
1.1 诱变育种
1.1.1 传统理化诱变法
传统理化诱变包括辐射诱变和化学诱变。辐射诱变通过射线(紫外线、χ射线、γ射线等)对生物材料进行辐射,诱发其染色体的数量、结构发生变异,从而得到突变体。化学诱变通过化学诱变剂(碱基类似物、烷化剂、移码诱变剂等)处理生物材料,引起其基因突变、染色体断裂,产生突变体。传统的诱变方法操作简单,不需要昂贵的仪器设备。但具有盲目性和随机性,育种的筛选难度大。在三孢布拉霉育种工作中,化学诱变法报导较多的是使用烷化剂N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,NTG)、甲基磺酸乙酯(ethylmethylsulfone,EMS)等进行诱变,NTG、EMS具有1个或多个活性烷基,易取代脱氧核糖核酸(deoxyribonucleic acid,DNA)分子中活泼的氢原子,使DNA分子上的碱基及磷酸部分被烷化,DNA复制时导致碱基配对错误而引起突变,突变株类胡萝卜素产量明显提升。MEHTA B J等[3]利用NTG处理孢子悬液后进培养,挑选具有显著颜色差异的菌落并反复纯化,所获得的突变菌株β-胡萝卜素的产量较野生型提高了近130倍,含量达到39 mg/g。相比较化学诱变而言,辐射诱变所得到的突变体不稳定,且多为隐性突变。因此,辐射诱变往往和化学诱变相结合用于三孢布拉霉的菌种选育,在COSTA PEREZ J等[4]的专利中以紫外线、NTG、EMS分别对 B.trispora(+)和B.trispora(-)进行复合诱变,获得的突变株经摇瓶培养后得到的β-胡萝卜素产量达到6.0~8.7 g/L。MARCOS RODRIGUEZ A T等[5]在专利中提到,利用紫外线、NTG和EMS分别对B.trispora(+)和B.trispora(-)进行复合诱变,获取的突变株经过摇瓶培养得到的番茄红素产量高达3.7g/L。三孢布拉霉在整个生长周期内均为单细胞多核体,在诱变过程中多核体的存在对突变株的分离造成了相当大的技术难度。为解决三孢布拉霉孢子多核体难以分离的问题,处理过后的孢子存活率一般控制在1%~5%。王强[6]对NTG诱变进优化,以质量浓度0.5 mg/L的NTG处理三孢布拉霉的孢子悬液40~50 min时效果最佳,孢子的存活率为1%~5%,正向突变率为10%。
1.1.2 N+离子注入诱变法
离子注入诱变技术是离子经过加速后以较高的速度射向生物材料,与靶生物中分子、原子进行一系列的碰撞,当入射离子能量较高时,它与靶原子分子的作用主要是非弹性碰撞过程(电子阻止过程),使生物分子电离或激发,导致电离损伤。入射离子能量逐渐降低后,弹性碰撞将起主要作用(核阻止过程),通过碰撞、级联和反冲,导致几百个原子移位,留下空位和断键。随着入射离子能量进一步降低,核阻止本领急剧上升,能量损失达到峰值。慢化的原初离子也将以高斯分布的形式沉积下来。如果注入的是活性离子,则它们在沉积过程中将不断地与生物分子键合、置换或者填充空位,形成新的分子基团。伴随着入射离子能量的沉积,其中小部分能量将随着动量方向指向表面而达到表面,引起生物体表面的二次粒子发射,即溅射。离子束对生物体的作用是集动量传递、能量及质量沉积、电荷中和与交换于一体的联合作用,直接或间接作用诱发遗传物质发生突变。具有对生物体生理损伤小、突变谱广、突变频率高,并有一定的重复性和方向性的新特点[7]。使用N+离子注入三孢布拉霉菌株中,引起了生物体内复杂的作用机制,突变频率和筛选效率与植入的离子的能量和剂量密切相关,呈现出N+离子注入特有的注量-存活率曲线,即“马鞍型”曲线等。陈恒雷等[8]以12×1015N+/cm2剂量的注入量时获得最大的正向突变率,β-胡萝卜素产量较对照高出25%,达到1.25 g/L。
1.1.3 常压室温等离子体诱变法
常压室温等离子体(atmosphericroomtemperatureplasma,ARTP)诱变技术采用粒子包括处于激发态的氦原子、氧原子、氮原子、OH自由基等)浓度的等离子体射流。等离子体射流中的活性粒子能够使微生物细胞壁/膜的结构及通透性改变,并引起基因损伤,进而使微生物基因序列及其代谢网络发生显著变化,形成突变体。ARTP诱变技术是一种新兴的诱变方法,相比传统的物化诱变而言,其安全性更高,操作简便,对遗传物质的损伤机制更为多样,所获得的突变类型也很多样[9]。WANG Q等[10]利用ARTP诱变出高产番茄红素的三孢布拉霉菌株,ARTP处理150 s具有较高的筛选效率,导致8%的存活率和14%以上的阳性突变率,所得到的突变株番茄红素产量提升55%,达到26.4 mg/g。值得提出的是诱变出的突变株对溶解氧的需求减小,呼吸作用降低。这意味着突变株相比于原始菌株而言,更加适应在体积较大发酵罐中的生长。
目前通过诱变所获得的高产菌株相比于野生菌株在类胡萝卜素的产量上已经有了很大的提升,但是其产量很难达到工业化生产的要求。单一的诱变因素往往无法获得较为理想的效果,多种因素相结合的复合诱变往往成了较好的选择。以传统的理化诱变与新兴的N+离子注入和ARTP诱变等组成复合诱变,对内在大分子作用的同时,对细胞壁细胞膜也造成损伤。复合诱变因诱变机制不同,可获得的突变形式也很多样,通过筛选获得期望菌株的概率也相对增大。WANG Q等[11]用NTG和N+离子注入诱变分别对B.trispora(+)和B.trispora(-)进行复合诱变,经过摇瓶发酵后番茄红素产量提高64%,达到28.8 mg/g。
1.2 基因工程育种
近年来三孢布拉霉中有关类胡萝卜素合成的基因已经相继被报道,合成类胡萝卜素的相关基因被克隆到一些生长速度快、生长能力强、营养需求低的微生物中,如大肠杆菌和毕氏酵母[12],期望能降低生产成本,提高生产效率。但到目前为止,这些工程菌中类胡萝卜素的产量仍然很低,难以运用到工业化生产。WANG Y等[13]对三孢布拉霉自身基因组进行改造,利用同源重组基因打靶技术编辑carRA基因,敲除其中的carR序列(番茄红素环化酶编码序列),阻止番茄红素进一步合成β-胡萝卜素,提高番茄红素产量。但所获得的carR缺陷型菌株的番茄红素产量只有少量提升。值得关注的是其意外获得了几株carA双拷贝菌株,摇瓶培养过程中加入番茄红素环化酶抑制剂,最终所得到的番茄红素产量高达103.58 mg/g。这意味着在今后的工作中可以通过增多carA拷贝数来获取高产类胡萝卜素的工程菌。巩尊洋等[14]率先克隆到了三孢布拉霉中的负调控基因crgA,并对其进行了敲除,在发酵前36 h番茄红素迅速积累,随后缓慢转变为β-胡萝卜素,且类胡萝卜素产量显著提高。然而,在敲除crgA的菌株中均无接合孢子的生成。
三孢布拉霉合成过程中涉及到的基因复杂,许多功能基因还未被发现,代谢调控机制还未完全被阐明,而且双功能基因carRA同时编码八氢番茄红素合成酶和番茄红素环化酶,一直是研究的难点。期望近年来基因编辑技术的不断发展和三代测序技术的成熟,对于三孢布拉霉新的功能基因的发现及育种工作有积极的影响。
2 发酵工艺优化
2.1 高产类胡萝卜素培养基的优化
培养环境中碳氮比对类胡萝卜素的合成具有很大的影响,不同碳氮比的培养环境,不仅影响着发酵所得到的类胡萝卜素的总量,而且对其中的β-胡萝卜素、γ-胡萝卜素、番茄红素的百分含量也有较大的影响[15-16],碳源充足氮源缺乏更有利于类胡萝卜素的产成[17]。三孢布拉霉的生长分为两个阶段,第一个阶段是菌体的增长,第二个阶段是菌体中类胡萝卜素的积累。在菌丝体增长阶段提供充足的碳源和氮源,利于菌丝体生长,提高生物量。在类胡萝卜素合成阶段则要提供碳源充足、氮源缺乏的培养环境,利于类胡萝卜素在菌丝体中的积累。因此,培养基优化要把握好菌体生长环境中碳源和氮源的比例,在生长的第二阶段适当的选择补充碳源提高类胡萝卜素的积累。CHOUDHARIS等[17]对不同的碳源、氮源、硫酸盐、pH进行了摸索,并用响应面优化法确定最适添加量,发现在以葡萄糖、L-天冬氨酸、酵母浸粉、KH2PO4、MgSO4为基质的培养基中发酵所得的β-胡萝卜素产量较高(0.14 mg/mL)。除了培养基营养成分问题,三孢布拉霉在液体培养基中菌丝体抱团成球,不利于正、负菌丝体之间的物质交换,影响产量的提升。为了解决菌丝抱团问题,BOHME K等[18]在培养基中加入0.2%的琼脂使菌体明显分散,SCHAAP A等[19]在专利中以玉米干粉,麦芽糖等作为基底能够获得较高的番茄红素产量(0.3 mg/mL),防止菌丝体抱团成球。目前在工业化的生产中多用到的是玉米粉等作为培养基底。此外,在发酵过程中人为的少量的添加某些外源物质可以刺激类胡萝卜素的产量提升,关于这类物质的报道有很多,这里主要介绍几种对类胡萝卜素产量提升有明显刺激的,并解释某些外源物可能的作用机制。
2.1.1 加入三孢酸结构类似物
三孢酸(trisporic acid)是三孢布拉霉在正菌和负菌协同作用下将β-胡萝卜裂解并转化形成的,可以刺激三孢布拉霉大量合成类胡萝卜素,因而称之为性激素。三孢酸结构类似物在结构上与三孢酸相似,在研究中发现这些物质也能刺激三孢布拉霉提高类胡萝卜素的产量,三孢酸结构类似物有α-紫罗酮、β-紫罗酮、脱落酸、维生素A等,其中以脱落酸的作用效果最好。徐君伟等[20]向培养基中添加9.36nmol/L脱落酸时所获得的番茄红素产量最高(0.54g/L),相对于对照提高出44%。三孢酸结构类似物能够刺激类胡萝卜素产量提升的原因可能是其起到了类似于三孢酸的作用,也可能是为类胡萝卜素的合成提供碳骨架。
2.1.2 加入菌体氧化应激诱导物
氧化应激是指生物体促氧化-抗氧化平衡机制受到干扰,机体氧化与抗氧化作用失衡,多倾向于氧化。机体为了维持促氧化-抗氧化机制的平衡,保护细胞免受损伤,形成了两种应对系统,即酶抗氧化系统和非酶抗氧化系统。酶抗氧化系统包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶等,非酶系统主要有谷胱甘肽、抗坏血酸、生育酚、类胡萝卜素等。当培养环境中存在氧载体、氧化物等,引起三孢布拉霉氧化应激效应,菌体细胞内的抗氧化酶(SOD、CAT)活性会明显增高,而类胡萝卜素是一种有效的抗氧化物,作为非酶抗氧化系统对于维持细胞内的氧化平衡,应对氧化压力,防止细胞自我分解具有积极的作用[21],其合成量也会明显上升。二丁基羟基甲苯(butylated hydroxytoluene,BHT)原本是一种抗氧化剂在食品加工中较为多见,用于防止食品腐败。SMIRNOVA E G等[22]研究表明,添加BHT后并没有抑制超氧化物的形成,相反的是BHT作为一种助氧化剂直接和氧分子作用形成超氧阴离子,促进了超氧化物的产生,引起机体氧化应激反应。在培养基中添加20 mmol/L的BHT所获得的β-胡萝卜素的产量较对照提高了5倍,达125 mg/g,而且添加BHT后菌丝体由大面积的聚集而变得分散,更有利于正负菌之间的物质传递(如三孢酸)。此外,氧载体如正己烷、正十二烷、过氧化氢都可以增加体系的溶解氧,一定程度的引起菌体的氧化应激,提高类胡萝卜素产量。但并不是所有的氧化应激诱导物都能提高类胡萝卜素的产量,如NANOU K等[23]外源添加5.0 mmol/L的氯化铁引起三孢布拉霉强烈的氧化应激效应,细胞内SOD和CAT活性增加,类胡萝卜素总的合成量并没有显著的增加,只是类胡萝卜素的组成成分发生了较大的变化,其中β-胡萝卜素含量显著降低。
2.1.3 加入外源油脂
培养基中存在的外源植物油可以被菌体吸收利用,转化为自身的脂肪酸,因此三羧酸(tricarboxylic acid,TCA)循环不需要再提供大量的乙酰-CoA用于菌体脂肪酸合成,使更多的乙酰辅酶A能够通过甲羟戊酸途径合成类胡萝卜素。此外,菌体吸收的脂肪酸一方面可以增加脂溶性类胡萝卜素在细胞内的溶解度,另一方也可以分解成乙酰-CoA提供细胞生长或类胡萝卜素的合成,也有报道称[24]三孢酸、β-紫罗酮等只有在外源植物油存在的情况下才发挥其作用,所以添加外源植物油不仅对三孢布拉霉中类胡萝卜的合成有较强的促进作用,而且有利于菌丝体的生长。MANTZOURIDOU F等[25]添加粗大豆油到葡萄糖培养基,所得β-胡萝卜素的产量提高40多倍,VERESCHAGINAOA等[26]对不同植物油中的组分进行了分析,发现富含亚麻酸的外源植物油,如亚麻籽油、棉籽油、葵花籽油等对类胡萝卜素合成的刺激作用更加明显。
近期报导的以工业甘油,食用废油作为三孢布拉霉发酵生产类胡萝卜素的原料,其产量可相当可观[27-29]。肥皂制造业中造化反应反生的副产品-工业甘油和日常生活的食用废油,它们用作为三孢布拉霉的发酵的培养基,相比高成本的培养基廉价易得,大大节约成本,类胡萝卜素的产出量也毫不逊色,在大规模的工厂发酵中需要大胆的尝试,真正做到变废为宝。
2.1.4 加入非离子表面活性剂
非离子表面活性剂像spans,tweens,Triton X-100和pluoronic F-68等被报道具有提高酶活性,促进细胞生长等作用。多数的非离子表面活性剂对类胡萝卜素的产生具有一定的刺激作用,但以span-20效果最为明显,span-20能促使三孢布拉霉菌丝体生长,使菌丝体的形体分散,防止菌丝抱团形成球,这种分散的菌丝体形式更有利于细胞间物质的转化,促使类胡萝卜素的合成。当培养基中存在1%的span-20时,β-胡萝卜素的产量和三孢酸的合成量都提高了15倍左右[30],但是span-20自身的起泡性影响到其在较大规模的发酵生产中的应用。
2.1.5 其他
乙酸盐、乙烯、花生四烯、生物碱、胺类、异戊烯醇、甲羟戊酸、香叶醇等均会在一定程度上刺激三孢布拉霉提高类胡萝卜素的产量。其中作用比较显著的有,GOVIND N S等[31]报道称10-8mol/L的铜离子刺激β-胡萝卜素产量提升2.2倍,JING K等[32]研究发现,当培养基中存在35 mol/L的醋酸钠时,刺激β-胡萝卜素的产量提升80%。
虽然多数外源添物对类胡萝卜素的合成有着明显的刺激作用,但是在选择的时候也应该考虑添加物的毒害性、对发酵体系的影响大小、后期分离的难易程度等诸多方面,以求达到最大的效益。
2.2 发酵条件优化
B.trispora(-)的孢子萌发比B.trispora(+)的快,然而负菌萌发后菌丝体的生长速度比正菌慢很多,正菌和负菌接种时按照不同的接种量比率和接种时间更有益于培养基的营养成分在正、负菌之间的分配。BOHME K等[18]在负菌接种20 h后,以负菌接种量的1/30来接种正菌,所获得的β-胡萝卜素的产量最高。当然BOHME K所得到的最优的接种时间和接种比例比不是绝对的,菌丝体在不同的环境中生长和生产速度不同,其最优的接种时间和接种比例也会有一定的变化。所以在工业生产过程中,要根据实际情况,如发酵装置,发酵培养基等对菌丝体生长得影响,不断进行优化尝试,以找到最优的接种方式。此外,KIMSW等[33]在报道中提到,培养基的pH在10~11的范围较对照(pH4~9)所得的β-胡萝卜素产量高出近2倍,NANOU K等[34],将发酵的初始pH调至11再进行灭菌有利于β-胡萝卜素的积累。
2.3 发酵罐中的生产优化
在优化发酵过程中,生物反应装置的类型(摇瓶、搅拌式反应器、气升式反应器等)对类胡萝卜素产量的影响不可小觑。摇瓶发酵生产类胡萝卜素虽然发酵条件易于优化和控制,但生产力低并不适用于工业生产。因此,三孢布拉霉在大型发酵罐中的生产优化就成了必然。搅拌发酵罐中通气量,搅拌速率均显著影响着生物量以及β-胡萝卜素浓度。MANTZOURIDOU F等[35]报道,在5 L搅拌发酵罐中,低叶轮速度(150 r/min)和高通气速率(1.5 vvm)下可获得最高的β-胡萝卜素产量(1.5 kg/m3)和最高的生产率(0.08 kg/(m3·d),而在高搅拌速度(500 r/min)和中等曝气速率(1.0 vvm)条件下实现最大生产率(每天0.08 kg/m3)和生物干质量(26.4 kg/m3)。LIU X J等[36]从7.5 L的搅拌罐逐步扩大等级至200 L,番茄红素的生产能力基本保持不变(0.18 mg/mL),添加脱落酸等外源刺激物发酵4 d后,获取最高的番茄红素产量(0.27 g/L)。搅拌发酵罐培养基流动性强,便于物质交换和营养吸收,利于类胡萝卜素生产,但是搅拌发酵罐中叶轮搅拌带来的剪切力会打断菌丝体,影响菌丝体正常生长,降低类胡萝卜素的产量。在气升式发酵罐中的研究中,ROUKAS T等[37]使用脱去蛋白质的水解乳清为培养基,在1.4 L气升式反应器中以较高的通气速率(4vvm)发酵获得最高类胡萝卜素的产量(55.5 mg/(L·d))。气升式反应器耗能少,更加经济环保,没有搅拌发酵中的机械搅拌,减小对菌丝体损伤,溶氧效率高,可以通过增加氧分压引起菌丝体氧化应激反应,增加类胡萝卜的产量。此外,ROUKAS T等[38]使用的一种改进的旋转生物膜反应器,与传统的搅拌发酵罐相比,其所获得的类胡萝卜素的产量提高近6倍,而且在较短的时间内能实现大量的类胡萝卜素的积累,所获得最大胡萝卜素生产力为(0.57 mg/(mL·d)),是迄今为止报告过发酵生产类胡萝卜素效率最高的一种生产方式,更适合工业化生产类胡萝卜素。
3 小结与展望
随着人们对生活品质的重视,绿色食品和保健食品的销量在日益增加,类胡萝卜素以其具有着色、抗氧化、抗衰老、预防癌症等功能而广泛受到市场青睐,具有很好的商业前景。但是,目前类胡萝卜的产量仍然较低,难以满足市场的需求。尽管提高三孢布拉霉类胡萝卜素产量的策略多样,但是多数仍停留在实验室的水平上。发酵调控方面的工作是比较容易快速提高产量的途径,现阶段可以寻找适合的外源刺激物来提高类胡萝卜素的产量,尝试多种不同外源刺激物共同作用,同时寻找合适的培养基和培养方式达到提高类胡萝卜素产量、降低生产成本的目的。从长远来看要实现类胡萝卜素大规模的工业化生产还要以菌株的改良选育为主,诱变育种虽然工作繁琐、成效偏低,但是必不可少,以N+离子注入和ARTP诱变等结合传统的化学诱变手段获得高产类胡萝卜素的突变株以初见成效。随着功能基因组学、蛋白质组学的完善和发展,阐明三孢布拉霉产类胡萝卜素的代谢调控机制将是之后工作的主要内容,运用基因编辑技术改造关键基因获取理想的工程菌株也将成为今后工作中的重点。
