扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究
2019-01-02丁娟芳朱淑云李文洁韦林洪
丁娟芳,杨 嘉,朱淑云,李文洁,韦林洪*
(1.扬州市职业大学 生物与化工工程学院,江苏 扬州 225009;2.扬州市产品质量监督检验所,江苏 扬州 225111)
亚硝酸盐在食品中广泛存在,在蔬菜制品中则更为普遍。蔬菜中的亚硝酸盐主要由细菌将植物体内的硝酸盐转化而来,高含量的亚硝酸盐进入人体后会导致一系列的健康风险[1-4]。
乳酸菌是食品自然发酵中的常见菌种之一,通常被认为是安全的益生菌[5-6]。相关研究表明,乳酸菌在生长代谢过程中可以降解亚硝酸盐,从而保证食品安全[7-10],故从自然发酵环境中分离乳酸菌并对其进行研究成为一种趋势[11]。已报道的亚硝酸盐降解乳酸菌有植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、肠膜明串球菌(Leuconostoc mesenteulides)、啤酒片球菌(Pediococcus cerevisiae)、乳酸粪链球菌(Streptococcus faecalis)等[12],其降解原理主要体现于代谢过程中产生的乳酸和一系列酶,以及乳酸菌成为优势菌后对其他产亚硝酸盐杂菌的生长抑制[11]。目前,对于乳酸菌降解亚硝酸盐的研究主要集中于产酸和亚硝酸盐还原酶,而降解机制、基因组学还有待进一步研究,其应用离工业化生产也还有一定距离[13]。
扬州酱菜素享盛名,拥有着2 100年的悠久历史,其生产工艺融合了制酱、腌渍等过程,千百年来既有传承,也有创新[14]。本研究旨在从扬州传统酱菜中筛选出具有降解亚硝酸盐活性的优良乳酸菌,采用形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定并研究其性能,为今后进一步研究其降解机理并建立发酵体系提供良好的菌种资源和科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱菜样品:均为扬州市场销售的本地散装酱菜。
1.1.2 培养基
MRS琼脂培养基、MRS肉汤培养基、生化鉴定管:广东环凯微生物科技有限公司。
乳酸菌筛选培养基:在MRS琼脂培养基中添加质量浓度为0.2 g/L的碳酸钙;
亚硝酸根降解筛选培养基:在MRS肉汤培养基中添加质量浓度为100 mg/L的NO2-。
1.1.3 试剂
革兰氏染色试剂盒:广东环凯微生物科技有限公司;KOD FX脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(1.0 U/μL):日本TOYOBO公司;DNA凝胶回收试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒:美国Axygen公司;碳酸钙、氢氧化钾、乙酸、甘油、双氧水(均为分析纯):国药集团化学试剂有限公司;亚硝酸根(NO2-)标准溶液(1 000 μg/mL)、硝酸根(NO3-)标准溶液(1 000 μg/mL):国家有色金属及电子材料分析测试中心。
1.2 仪器与设备
SW-CJ-1D超净工作台:苏州净化设备有限公司;HVE-50灭菌锅:日本Hirayama公司;SPX-250B-Z生化培养箱:上海博讯实业有限公司;YQX-II厌氧培养箱:上海新苗医疗器械制造有限公司;ICS1500离子色谱(ion chromatography,IC)仪:美国戴安公司;AL104电子分析天平:梅特勒-托利多仪器(上海)有限公司;ECLIPSE生物显微镜:日本尼康公司;3-30k冷冻台式高速离心机:德国Sigma公司;752型紫外可见分光光度计:上海菁华科技仪器有限公司;2720PCR扩增仪:美国ABI公司;DYY-8C电泳仪:北京六一生物科技有限公司;E1617-T130 plus凝胶成像系统:美国Bio-Rad公司;PHS-3C pH计:上海仪电科学仪器股份有限公司;Bagmixer400拍击式均质器:法国Interscience公司。
1.3 方法
1.3.1 乳酸菌的分离
称取25 g酱菜样品置于盛有225 mL生理盐水的无菌均质袋中,用拍击式均质器拍打1 min,制成10-1样品均液。吸取1 mL 10-1样品均液注入盛有9 mL生理盐水的无菌试管中,混合均匀得到10-2样品均液。重复以上操作制成10-3样品均液。吸取不同浓度样品匀液1 mL涂布于无菌平皿内,将冷却至46℃的乳酸菌筛选培养基倾注平皿,混合均匀后置于(36±1)℃培养箱中培养48 h,直到有溶钙圈的单菌落出现。单菌落经纯化后进行革兰氏染色,革兰氏阳性同时触酶阴性[15-16]的菌株由保藏珠吸附后加入含50%甘油的MRS肉汤介质中,于-70℃超低温冰箱中进行保存。
1.3.2 降解亚硝酸盐乳酸菌的筛选
将活化2代的待测菌株接种于MRS肉汤培养基中,于(36±1)℃条件下培养24h。培养液在无菌条件下2000r/min离心10min,弃去上清液,用10mL生理盐水振荡洗涤菌体。重复以上离心、弃上清、洗涤菌体操作2次,在洗涤后的菌体中加10 mL生理盐水混匀,制成测试菌液。以生理盐水作为对照,采用分光光度计在波长550 nm处测定测试菌液的光密度OD550nm值,控制其在0.6~0.8范围内。
将测试菌液以5%(V/V)的接种量接种到10 mL亚硝酸根(NO2-)降解筛选培养基中,于(36±1)℃条件下静置培养24 h。检测培养基中的NO2-含量,用降解率来表示菌株降解NO2-的能力,以筛选出有高降解活性的乳酸菌菌株。NO2-含量测定方法参考GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》中高效液相色谱(high performance liquid chromatography,HPLC)法进行测定。NO2-降解率的计算公式如下:

1.3.3 菌种鉴定
(1)形态观察和生理生化鉴定
将1.3.2中筛选到的具有降解盐酸盐活性的乳酸菌活化2代后接种至MRS琼脂培养基中,培养24 h后,对菌株进行形态观察。参照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》对乳酸菌进行生理生化特性鉴定[15-16],碳源利用试验采用生化鉴定管进行。
(2)分子生物学鉴定
采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取菌株的基因组[17],以通用引物对(27f/1492r)对菌株的16SrDNA序列进行扩增。PCR扩增反应体系:2×KOD Buffer 25μL、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)mixture 10 μL、KOD DNA polymerase 1 μL、引物27f和1492r各1.5 μL、双蒸水(ddH2O)10 μL、模板1 μL。PCR扩增程序:94 ℃、3 min;98 ℃、10 s,55 ℃、30 s,68 ℃、4 min,30个循环;68 ℃、2 min。PCR扩增产物经纯化后进行测序。引物及测序结果均由南京金斯瑞生物科技有限公司提供。
将菌株的测序结果与美国国立生物技术信息中心(national center for biotechnology information,NCBI)中的GenBank数据库进行BLAST比对搜索,选择近源菌种的16S rDNA序列用Clustal X进行序列比对,最后采用MEGA 6.06软件中的邻接法(neighbour-joining,NJ)构建系统发育树,分析鉴定菌株与已知菌株的同源性。
1.3.4 生长性能的测定
(1)培养温度对菌株生长的影响
将1.3.2中的测试菌液按5%(V/V)接种量接种至10 mL MRS液体培养基中,分别在15℃、20℃、25℃、30℃、35℃、40℃、45℃温度条件下静置培养48h,以无菌培养基为空白,在波长550 nm处测定吸光度值。
(2)菌株生长曲线的测定
将1.3.2中的测试菌液按5%(V/V)接种量接种至MRS液体培养基中,以最适生长温度培养24 h,每隔3 h取样,以无菌培养基为空白,测定样品在波长550 nm处的吸光度值,以培养时间为横坐标,吸光度值为纵坐标绘制测试菌的生长曲线。
2 结果与分析
2.1 降解亚硝酸盐乳酸菌的筛选
从酱菜样品中共分离出有溶钙圈的菌株59株,其中触酶试验阴性同时革兰氏染色阳性的菌株共32株,初步鉴定为乳酸菌[15-16]。将分离出来的菌株接种到含的MRS肉汤培养基中,培养后用离子色谱检测培养基中的含量并计算其降解率,结果如表1所示。
由图1可以看出,取培养12h的菌株DGJ-17的培养液进行分析,在标准物质的保留时间出现了对应的色谱峰,推测在培养过程中有的产生。张庆芳等[18]的研究表明,在发酵初期,发酵液pH值为4.5~6.5时,乳酸菌对亚硝酸盐的降解主要是由于乳酸菌产生亚硝酸盐还原酶进行的酶降解;而在pH值<4.0之前,亚硝酸盐的降解主要是由于乳酸菌代谢产酸,通过化学反应将转变为NO3-[19],这也可能是DGJ-17培养液中出现的原因。

表1 乳酸菌培养24 h后NO2-降解率Table 1 Degradation rate of NO2-by lactic acid bacteria cultured for 24 h

图1 NO2-及NO3-的检测离子色谱图Fig.1 Ion chromatogram of NO2-and NO3-analysis
2.2 菌株的鉴定
2.2.1 形态特征
菌株DGJ-17在MRS琼脂培养基上的菌落及细胞形态结果见图2。
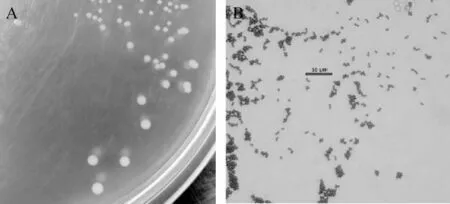
图2 菌株DGJ-17在MRS琼脂培养基上的菌落形态(A)和细胞形态(B)Fig.2 Colonial(A)and cell(B)morphology of strain DGJ-17 on MRS agar medium
由图2A可以看出,菌株DGJ-17在MRS琼脂培养基上菌落为乳白色球形,表面光滑、边缘整齐、中央凸起,菌落直径多为0.2~0.8mm。由图2B可知,菌株为革兰氏阳性菌,油镜下细胞呈现圆球形,单细胞直径为0.8~1.3 μm,多数成对,部分呈单个或短链状。
2.2.2 生理生化鉴定
将菌株DGJ-17活化后接种于MRS琼脂培养基上,经24 h厌氧培养后发现菌株生长良好,由此说明该菌为兼性厌氧菌。菌株DGJ-17的生理生化试验结果见表2。
由表2可知,菌株DGJ-17在10℃、45℃和6.5%NaCl条件下均可以正常生长,发酵葡萄糖产酸不产气。参照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》并结合菌株DGJ-17的形态及生理生化特性可初步确定菌株DGJ-17为肠球菌属(Enterococcus)。

表2 菌株DGJ-17的生理生化特征Table 2 Physiological and biochemical characteristics of strain DGJ-17
2.2.3 分子生物学鉴定
将菌株DGJ-17的16SrDNA序列结果在NCBI进行Blast相似性比对,选取同源性较高的肠球菌属乳酸菌,以邻接法构建系统发育树,结果见图3。

图3 菌株DGJ-17的16S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain DGJ-17 based on 16S rDNA sequences
由图3可知,菌株DGJ-17与乳酸肠球菌(Enterococcus lactis)聚于一支,亲缘关系最近,同源性达到99%。结合该菌株形态特点和生理生化特征,将菌株DGJ-17鉴定为乳酸肠球菌(Enterococcus lactis)。
2.3 生长性能测定结果
2.3.1 培养温度对菌株DGJ-17生长的影响
测定不同培养温度下菌株DGJ-17的生长情况,结果如图4所示。
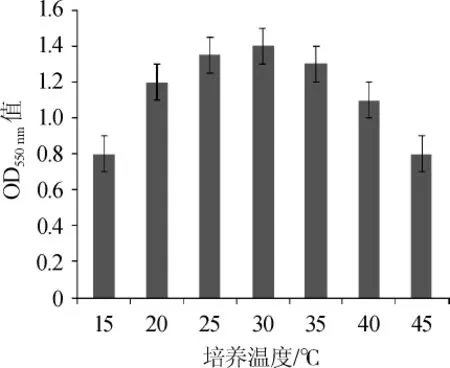
图4 不同培养温度对菌株DGJ-17生长的影响Fig.4 Effect of different culture temperature on growth of strainDGJ-17
由图4可知,菌株DGJ-17在15~45℃的温度范围内均能生长,30℃培养时,菌体密度达到最高(OD550nm=1.4),故30℃为菌株的最适生长温度。
2.3.2 菌株DGJ-17的生长曲线
菌株DGJ-17在30℃培养条件的生长曲线见图5。
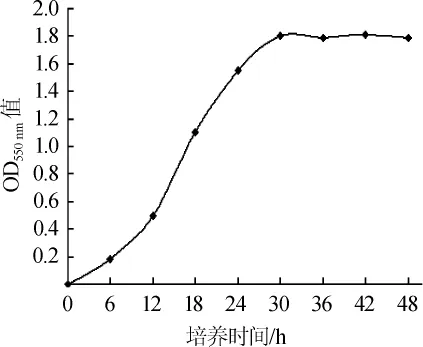
图5 30℃条件下菌株DGJ-17的生长曲线Fig.5 Growth curve of strain DGJ-17 at 30℃
由图5可以看出,菌株DGJ-17的生长迟缓期为0~12 h,对数生长期为12~30h,平稳期为30~48h,菌体在培养48h后逐步进入衰退期。
3 结论
本实验从扬州酱菜中筛选到一株能降解亚硝酸盐的高活性乳酸菌DGJ-17,其NO2-降解率为91.7%,菌株经形态学、生理生化和16S rDNA序列分析被鉴定为乳酸肠球菌(Enterococcuslactis)。菌株DGJ-17的最适生长温度为30℃,生长迟缓期、对数期、平稳期分别为0~12 h、12~30 h、30~48 h,培养48 h后逐步进入衰退期。本实验对乳酸肠球菌DGJ-17的后期应用提供了一定的理论依据,其降解机理及在食品领域的应用还有待进一步研究。
