人工污染GII.4型诺如病毒在太平洋牡蛎中的蓄积与分布特性
2018-12-29苏来金马丽萍周德庆
苏来金,马丽萍,刘 慧,周德庆,*
(1.青岛海洋科学与技术试点国家实验室,海洋药物与生物制品功能实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.上海海洋大学食品学院,上海 201306;3.温州市农业科学研究院,浙江 温州 325006)
诺如病毒(noroviruses,NoVs)是世界范围内重要的食源性病原体,可以分为7 个基因型(GI~GVII),其中GI和GII主要感染人类,也可以通过食源和水源进行传播[1-3],大多数NoVs感染是由GII.4 NoV引发的[4]。近年来,食源性NoVs感染频繁出现,许多NoVs疫情的爆发都与食用牡蛎有关[5-8],给食品安全和贸易带来了巨大威胁。由于牡蛎等双壳贝类的滤食特性,加上生食牡蛎的消费习惯,牡蛎成为世界上公认的NoVs重要传播载体。
通常NoVs通过污染的海水进入牡蛎体内[9],研究表明NoVs在牡蛎体内的积累具有持续性和稳定性,因此很难被净化[10-11],且其检出存在明显的季节性差异。牡蛎中经常有不同基因型的NoVs被检出,这些不同型别的NoVs并不是相似地积累在牡蛎的某一个组织部位[12-14],这使得牡蛎中NoVs的研究变得比较复杂。摸清NoVs在牡蛎中的蓄积、分布、特异性结合机理,可以有针对性地开展NoVs检测和制定NoVs净化方案,对于NoVs控制和风险预警均有重要的参考意义。对于牡蛎中NoVs的积累和分布,前期研究主要通过采集牡蛎样品检测为主[15-16],但是采集养殖或野生的牡蛎检测受到其生长环境、NoVs污染源、样品采集数量和代表性等不确定因素的影响,导致牡蛎中NoVs积累和分布规律研究进展缓慢。本研究采取实验室内控制环境条件,人工污染GII.4 NoV养殖牡蛎的方法,分组织、分时间进行定量和定位检测,以期探索牡蛎中NoVs分布特征和变化情况,为牡蛎中NoVs的分布规律和特异结合机制的研究提供参考。
1 材料与方法
1.1 材料与试剂
2014年10月于山东乳山养殖基地采集养殖太平洋牡蛎(Crassostrea gigas),贝龄为2 年,个体大小均匀,有活力,经实时荧光定量反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)方法随机检测[17],未检测到NoVs,运到实验室放入纯净海水中暂养待用。实验用NoVs阳性毒株为GII.4型(GenBank登录号为EU839594),由中国疾病预防中心提供,经过超速梯度离心纯化后待用。海水取自青岛沿海,盐度约为30‰,经过灭菌和过滤后待用,其他盐度的海水通过浓缩或者纯净水稀释海水获得。
Anti-Norovirus GII.4+GII.15免疫组织化学抗体艾博抗(上海)贸易有限公司;HRP-labeled Goat Anti-Mouse IgG免疫组织化学二抗 美国Abbkine公司;即用型SABC-POD试剂盒、DAB染色试剂盒 武汉德士生物工程有限公司;病毒RNA提取试剂盒 瑞士Roche公司;一步法实时荧光定量RT-PCR试剂盒 宝生物工程(大连)有限公司。
1.2 仪器与设备
荧光定量PCR仪 瑞士Roche公司;RXZ-600型人工气候箱 宁波江南仪器厂;RM2235组织切片机德国Leica公司;MSM自动组织切片染色机 德国SLEE公司;CX31-LV320显微镜 日本奥林巴斯株式会社。
1.3 方法
1.3.1 NoVs污染实验
取1 mL一定浓度的GII.4 NoV,加入盛装1 000 mL海水的养殖容器中,搅拌均匀,放入3 只有活力的太平洋牡蛎,在不同条件下进行牡蛎养殖实验,通氧养殖一定时间后,取出牡蛎,用洁净海水冲洗,分割不同的牡蛎组织,用实时荧光定量RT-PCR方法检测GII.4 NoV的含量[17],同时合并养殖与冲洗海水,检测海水中GII.4 NoV的含量。
1.3.2 NoVs污染浓度的确定
病毒经过实时荧光定量RT-PCR检测其浓度后,将原液用磷酸盐缓冲液(phosphate buffered saline,PBS)分别稀释10、100 倍和1 000 倍,与病毒原液一起作为4 个病毒浓度梯度,分别开展病毒污染牡蛎养殖实验,通氧养殖24 h后,取整体牡蛎进行GII.4 NoV回收,检测其含量,并按照下式计算牡蛎中GII.4 NoV回收率。
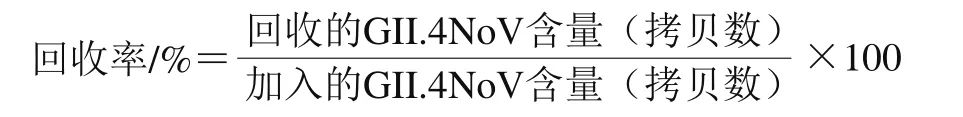
1.3.3 海水中NoVs的稳定性测定
取适量的GII.4 NoV加入盐度30‰、温度20 ℃海水中,保持通氧状态,设置时间0、6、12、24 h 共4 个实验组,每组3 个重复,检测不同时间条件下海水中GII.4 NoV含量变化。
1.3.4 不同温度下NoVs污染牡蛎养殖实验
取适量的GII.4 NoV污染牡蛎进行养殖,海水盐度30‰,养殖海水温度分别设定为5、10、15、20、25、30 ℃共 6 个实验组,每组3 个重复,通氧养殖24 h后,检测不同牡蛎组织部位与海水中的GII.4 NoV含量。
1.3.5 不同盐度下NoVs污染牡蛎养殖实验
取适量的GII.4 NoV污染牡蛎进行养殖,海水温度20℃,盐度分别调整为10‰、20‰、30‰、40‰共4 个实验组,每组3 个重复,通氧养殖24 h后,检测不同牡蛎组织部位与海水中的GII.4 NoV含量。
1.3.6 不同时间牡蛎体内NoVs变化迁移
取适量的GII.4 NoV污染牡蛎进行养殖,海水温度20 ℃、盐度30‰条件下通氧养殖,养殖时间设0、1、2、6、12、24 h共 6 个实验组,每组设3 个重复,检测不同牡蛎组织部位与海水中的GII.4 NoV含量。
1.3.7 净化对牡蛎中NoVs含量的影响
取适量的GII.4 NoV污染牡蛎进行养殖,海水温度20 ℃、盐度30‰条件下通氧养殖24 h后,再将牡蛎放入洁净的海水中,继续养殖6、12、24 h,每6 h更换一次洁净海水,检测不同牡蛎组织部位与海水中GII.4 NoV的含量。
1.3.8 牡蛎组织中NoVs的定位
牡蛎组织中GII.4 NoV的分布用免疫组织化学方法定位,按照文献[18]的方法稍加修改。牡蛎剥壳组织分离后,不同部位在体积分数10%多聚甲醛溶液中固定24 h,石蜡包埋,切5 µm薄片,用PBS在室温下清洗3 次,每次5 min,4 ℃放置过夜,使用SABC-POD试剂盒按照说明书进行操作,染色按照DAB试剂盒说明进行。免疫反应后,用电子显微镜拍照分析,颜色分成4 个评价等级:非常强(强烈的红棕色,+++)、强(明显的棕色,++)、弱(较浅的棕色,+)或者阴性(无棕色,-)。
1.3.9 牡蛎不同组织部位的分离
将养殖后的牡蛎在无菌状态下进行组织分离,分成外套膜、鳃、内脏团3 个部分,分别放入无菌容器待检测。
1.3.10 NoVs回收与定量检测
牡蛎与海水中的GII.4 NoV回收、病毒RNA提取和实时荧光定量RT-PCR检测按照文献[17]的方法进行。
1.4 数据统计分析
2 结果与分析
2.1 NoVs污染浓度的确定
从表1中可以看出,不同浓度的GII.4 NoV在牡蛎组织中均有检出。在高浓度时,海水中有GII.4 NoV检出,此时牡蛎GII.4 NoV回收率为17.20%,说明此时病毒浓度过高,24 h后尚不能被牡蛎全部富集。牡蛎中GII.4 NoV的回收率在稀释10 倍时达到最高,为23.42%;稀释100 倍的回收率为21.6%。考虑到阳性病毒资源缺乏,并且106拷贝数量级在实时荧光定量RT-PCR检测中呈现良好的线性关系,因此,本研究其他实验选择稀释100 倍的GII.4 NoV作为人工污染实验的病毒浓度,即加入1 mL浓度为(8.24±0.17)×106拷贝数/mL(由实时荧光定量RT-PCR检测得到)的GII.4 NoV稀释液。
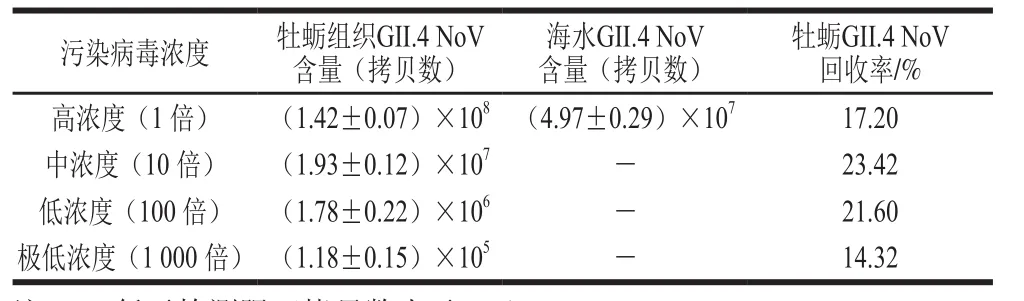
表1 不同浓度GII.4 NoV污染牡蛎情况Table1 Amount of NoV in oyster contaminated with GII.4 NoV at different concentrations
2.2 海水中NoVs的稳定性
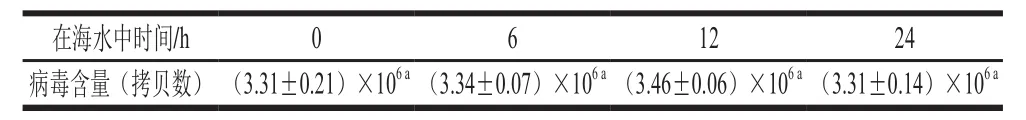
表2 GII.4 NoV在海水中的稳定性Table2 Stability of GII.4 NoV in seawater
从表2中可以看出,加入海水0、6、12、24 h后,GII.4 NoV含量没有明显的变化(P>0.05),说明GII.4 NoV在海水中具有良好的稳定性。
2.3 不同温度下NoVs在牡蛎组织中含量的变化

图1 不同温度下GII.4 NoV在牡蛎组织中的含量Fig.1 Contents of GII.4 NoV in oyster tissues at different temperatures
从图1中可以看出,在5 ℃时,牡蛎代谢缓慢,此时GII.4 NoV主要在养殖海水中,在牡蛎鳃和外套膜中检出少量的GII.4 NoV,在消化道中未检出GII.4 NoV;在10 ℃时,GII.4 NoV在海水、牡蛎鳃、消化道和外套膜中均有检出;15、20、25 ℃时,GII.4 NoV主要分布在牡蛎消化道、鳃和外套膜中;在30 ℃时牡蛎代谢缓慢,GII.4 NoV主要分布在海水、牡蛎鳃和外套膜中,在牡蛎消化道中未检出。不同温度下GII.4 NoV检出量不同,可能是牡蛎的代谢活力不同造成的,牡蛎在最适温度15~25 ℃时代谢旺盛,适宜的温度可以加快病毒在牡蛎体内的积累。
2.4 不同盐度条件下NoVs在牡蛎组织中含量的变化

图2 不同盐度下GII.4 NoV在牡蛎组织中的含量Fig.2 Contents of GII.4 NoV in oyster tissues at different salinities
从图2中可以看出,盐度为10‰时,在海水和牡蛎消化道、鳃及外套膜中均能检测出GII.4 NoV;盐度为20‰、30‰时,海水中检测不到GII.4 NoV,牡蛎消化道、鳃和外套膜中均能检测到GII.4 NoV,但其主要存在于消化道中;盐度为40‰时牡蛎代谢缓慢,GII.4 NoV主要存在于海水中,牡蛎组织中未检测到GII.4 NoV。这说明适宜的盐度能加快NoVs在牡蛎体内的积累。
2.5 不同时间NoVs在牡蛎组织中含量的变化
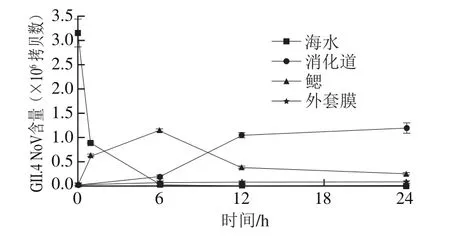
图3 GII.4 NoV在牡蛎组织中的迁移分布变化Fig.3 Contents and distribution of GII.4 NoV in oyster tissues
从图3中可以看出,由于牡蛎的滤食作用,海水中的GII.4 NoV不断减少,6 h后海水中检测不到GII.4 NoV。牡蛎外套膜中的GII.4 NoV含量比较稳定,在6 h时含量为(8.75±0.36)×104拷贝数,24 h时含量为(9.12±0.49)×104拷贝数,且无显著性差异(P>0.05)。牡蛎鳃中的GII.4 NoV含量先增大后降低,6 h时最高,为(1.15±0.15)×106拷贝数,24 h时为(2.51±0.07)×105拷贝数,这可能是由于滤食作用使GII.4 NoV不断经过鳃,最终进入消化道的原因造成的。消化道中的GII.4 NoV含量不断增加并趋于稳定,12h时含量为(1.06±0.14)×106拷贝数,24 h时为(1.21±0.23)×106拷贝数,且无显著差异(P>0.05)。牡蛎各组织从12 h开始GII.4 NoV含量趋于稳定,并且海水中检测不到GII.4 NoV,说明牡蛎养殖24 h后可以将实验浓度下的GII.4 NoV完全富集。
2.6 净化对牡蛎中NoVs含量的影响分析
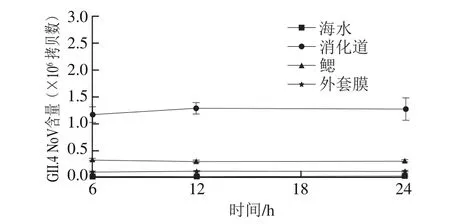
图4 不同净化时间下牡蛎组织中GII.4 NoV的含量Fig.4 Contents of GII.4 NoV in oyster tissues after purification
从图4中可以看出,净化6、12、24 h之后的牡蛎组织GII.4 NoV含量变化不大,净化24 h时牡蛎消化道中GII.4 NoV含量为(1.26±0.21)×106拷贝数,鳃中GII.4 NoV含量为(2.90±0.13)×105拷贝数,外套膜中GII.4 NoV含量为(9.52±0.34)×104拷贝数,海水中未检出GII.4 NoV。经过净化之后,牡蛎各组织中GII.4 NoV含量与净化前相比差异不显著(P>0.05),说明病毒在牡蛎组织内比较稳定。
2.7 牡蛎组织中NoVs的分布特性

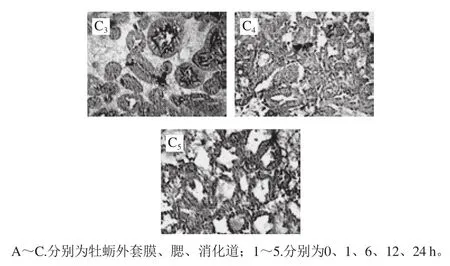
图5 不同时间牡蛎组织中GII.4 NoV的分布Fig.5 Distribution of GII.4 NoV in various oyster tissues as a function of time
从图5中可以看出,随着净化时间的延长,牡蛎外套膜中的GII.4 NoV主要集中在膜边缘,并且颜色较浅(+),含量比较稳定,这与实时荧光定量RT-PCR结果中外套膜中病毒含量较低且稳定的结果一致。牡蛎鳃中的GII.4 NoV主要集中在鳃壁上,颜色先加深(+++)后变浅(+)并趋于稳定(+),与实时荧光定量RT-PCR结果一致。牡蛎消化道中的GII.4 NoV主要分布在消化道内壁上,颜色逐渐加深,6、12、24 h颜色均较深(+++)。从免疫组织化学切片阳性强度的颜色看,牡蛎组织中GII.4 NoV积累规律与实时荧光定量RT-PCR检测的定量结果基本一致。
3 讨 论
由于牡蛎是滤食性动物,短时间内可以过滤大量海水[19],水中污染的NoVs会随滤食过程进入牡蛎体内,但不会通过代谢排出体外,从而蓄积在其体内,即使经过净化也很难把NoVs排出[20]。本研究对比了4 种GII.4 NoV浓度,发现高浓度的病毒在24 h内并不能完全被牡蛎过滤,而过低浓度的GII.4 NoV由于回收率低,难以准确定量,因此研究选择了稀释100 倍的病毒液污染牡蛎。在流行病学调查中,冬、春季节是人类感染NoVs高发期[21-23],但在贝类中检测出NoVs的季节性并不一致[24]。例如青岛海洋科学与技术试点国家实验室对2009年12月—2011年11月的840 个贝类样品的检测结果统计发现,牡蛎中的NoVs在春、夏、秋、冬均能检出[25]。Schaeffer等[26]研究了法国市场上收集16 个月的牡蛎,发现9%的样本受到季节性和气候的影响而存在NoVs。本研究检测了6 个温度条件下牡蛎中GII.4 NoV的变化,发现温度影响了牡蛎的活力,从而导致了GII.4 NoV在牡蛎不同组织中的含量差异,这说明适宜的温度加快了GII.4 NoV在牡蛎组织中的积累,但是温度是否影响到NoVs与牡蛎的紧密结合还有待于进一步研究。本研究同时分析了不同盐度对牡蛎中GII.4 NoV积累的影响,结果表明适宜的盐度有利于牡蛎代谢,加快了GII.4 NoV在牡蛎中的积累。
关于牡蛎中NoVs的分布报道并不一致:Le Guyader等的研究发现GII型NoV分布在牡蛎的外套膜和鳃中[27];McLeod等的研究发现NoVs主要存在于牡蛎消化道部位[28];GII型NoV在泰国曼谷牡蛎的所有部位中均有检出,但不是同一个牡蛎的多个部位,GII.4 NoV分布在牡蛎鳃和外套膜中,GII.7 NoV分布在牡蛎消化道中,GII.21 NoV分布在牡蛎外套膜中[15]。由于在牡蛎生长过程中,NoVs进入其体内可能受到病毒的基因型、海水温度、盐度、光照、风向、样品数量、代表性等因素制约,而这些条件往往是难以确定和把控的;因此采样检测并未获得明确的积累和分布规律。本研究采用实验室人工控制条件,通过定向污染GII.4 NoV进行牡蛎养殖,采用实时荧光定量RT-PCR检测不同时间、不同牡蛎组织中GII.4 NoV的含量,采用免疫组织化学切片定位不同时间、不同牡蛎组织中GII.4 NoV的分布,分析GII.4 NoV在牡蛎体内的含量变化和分布特征。实时荧光定量RT-PCR检测结果发现,随时间的延长,GII.4 NoV在牡蛎组织中的分布呈现一定的规律,牡蛎外套膜中检测出的GII.4 NoV含量比较稳定,鳃中的GII.4 NoV含量先增加后减少,消化道中的GII.4 NoV含量不断增加,在12 h后各组织中GII.4 NoV分布均趋于稳定,这与牡蛎的滤食代谢相符,即NoVs经过滤食过程经过外套膜,从鳃过滤后进入消化道,这与McLeod等[28]的结果一致。经过一定时间的净化,GII.4 NoV在牡蛎组织中的分布与净化前相比未发生明显变化,这与贝类病毒难以净化的报道一致[11]。免疫组织化学切片结果中不同牡蛎组织出现的阳性结果及其颜色深度也证实了实时荧光定量RT-PCR结果。近年来,在亚洲还出现了GII.17 NoV等变异毒株[29-30],但由于阳性病毒和免疫组织化学抗体的缺乏,本研究只分析了GII.4 NoV,其他毒株是否在牡蛎中也存在特定的分布规律有待于进一步的研究。
4 结 论
本研究在实验室控制环境条件下,人工污染GII.4 NoV养殖太平洋牡蛎,以探讨NoVs在太平洋牡蛎组织中的含量变化和分布特性。实时荧光定量RT-PCR结果表明:GII.4 NoVs在牡蛎外套膜中的含量比较稳定,在(8.75±0.36)×104~(9.12±0.49)×104拷贝数之间;在牡蛎鳃中的含量先增加后减少,6 h时达到最高((1.15±0.15)×106拷贝数);在牡蛎消化道中含量逐渐增加,12 h时达(1.06±0.14)×106拷贝数并趋于稳定;24 h后主要分布于牡蛎的消化道组织中,净化对牡蛎体内富集的GII.4 NoV含量无显著影响。免疫组织化学结果显示,GII.4 NoV广泛分布在牡蛎外套膜边缘、鳃壁和消化道内壁上,其分布随时间变化趋势与实时荧光定量RT-PCR结果一致。本研究为进一步研究NoVs在牡蛎中的生物积累规律、特异性结合机制,从而开展牡蛎中NoVs预警监测和制定贝类净化方案提供参考。
