使用一种新底物优化角蛋白酶活性检测方法的研究
2018-12-29张雅洁邓晓旭陈雪姣
■张雅洁 徐 丽 程 瑛 邓晓旭 陈雪姣 周 樱
(武汉新华扬生物股份有限公司,湖北武汉430074)
角蛋白组成结构主要有两大类,即α-角蛋白与β-角蛋白。这两种角蛋白结构中含有大量的二硫键、氢键等,并形成复杂的三维超螺旋结构[1],这使角蛋白的结构复杂而致密,使之具有非常稳定的性质,非常难被一般常见的蛋白酶破坏。但角蛋白营养丰富,在羽毛中的粗蛋白质含量在80%以上,各种氨基酸含量占总量的70%以上,并且含有多种动物所需要的必需氨基酸[2]。角蛋白酶(Keratinase)是一种可以特异性降解角蛋白的酶类,由细菌、放线菌和真菌等多种微生物产生[3],能够将羽毛等难分解的角蛋白废弃物转化为可消化蛋白。
目前国内外仍没有统一角蛋白酶活性的检测标准,而且因角蛋白的不溶性导致在测定角蛋白酶活性时存在一些问题,使得不同的研究结果之间很难进行比较和交流。本试验采用一种新的角蛋白底物,使用GB23527—2009附录B蛋白酶活性的测定(福林法)方法来测定角蛋白酶的活性,从底物浓度、反应时间、吸光值范围和底物专一性等方面研究了此底物是否适用于角蛋白酶的检测,从而优化传统检测角蛋白酶的方法,增加此方法的科学性和准确性。
1 材料与方法
除特殊说明外,所用的试剂均为分析纯,水均为符合GB/T 6682中规定的二级水。
1.1 试剂与设备
试验用角蛋白酶、蛋白酶、木聚糖酶和脂肪酶均来源于武汉新华扬生物股份有限公司。
水解角蛋白K0043(TCI公司),硼酸钠(国药集团化学试剂有限公司),三氯乙酸(国药集团化学试剂有限公司),福林试剂(国药集团化学试剂有限公司),酪氨酸(北京鼎国昌盛生物技术有限责任公司),氢氧化钠(国药集团化学试剂有限公司)。HH-4数显恒温水浴锅(国华电器有限公司),WH-2微型旋涡混合仪(上海泸西分析仪器有限公司),移液器(Thermo公司),THZ-82恒温振荡器(国华电器有限公司),UV-2800紫外可见分光光度计(上海尤尼柯仪器有限公司)。
1.2 试验方法
因为角蛋白酶仍属于蛋白酶类,所以本实验参考《GB23527—2009附录B蛋白酶活性的测定(福林法)》。根据已经研究得出的结果可知角蛋白酶的最适pH值偏碱性[4-6],且为了统一蛋白酶和角蛋白酶检测方法,此次试验不对反应温度和反应pH值进行研究,直接使用碱性蛋白酶的检测条件。
将角蛋白酶酶活定义为:1 g固体酶粉(或1 ml液体酶),在一定温度和pH值条件下,1 min水解酪蛋白产生1 μg酪氨酸,即为1个酶活力单位,以U/g(U/ml)表示。
具体试验方法如下:将水解角蛋白用硼酸缓冲液(pH值10.5)配制成底物溶液。取1 ml稀释至适当浓度的酶稀释液,加入1 ml水解角蛋白底物,于40℃水浴反应后以2 ml三氯乙酸溶液终止,空白先加入三氯乙酸溶液,再加入底物。反应结束后过滤,取滤液1 ml于玻璃管中,加入5 ml 0.4 mol/l Na2CO3溶液和1 ml福林试剂,于40℃保温20 min后,测定680 nm的吸光值。根据酪氨酸标准曲线得到的线性回归方程可以算出反应液中的酪氨酸的含量,并得到角蛋白酶的活性。
1.2.1 不同底物浓度
将水解角蛋白分别配制成 0.1%、0.2%、0.4%、0.5%、1%、1.5%和2%的浓度的底物溶液。将酶液稀释至适当浓度后按照1.2所述试验方法进行试验,反应时间为10 min。
1.2.2 不同反应时间
将底物浓度控制在1%,相同酶浓度下分别反应5、10、15 min和20 min,试验方法按照1.2所述进行试验。
1.2.3 不同吸光值范围
将底物控制在1%,反应时间为10 min,分别将初始酶液稀释至100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍和1 000倍进行试验并根据计算公式计算酶活。
1.2.4 不同酶种分别与底物反应
为验证底物的专一性,分别称取酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木聚糖酶和脂肪酶,采用GB23527—2009附录B蛋白酶活性测定(福林法)碱性蛋白酶的条件提取后,按照1.2所述方法进行试验,底物浓度为1%,反应时间为10 min。
2 试验结果
根据GB23527—2009,绘制酪氨酸标准曲线,结果见图1。
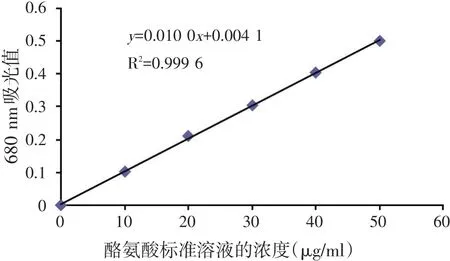
图1 酪氨酸标准曲线
根据图1可得到酪氨酸标准曲线的线性回归方程为y=0.010 0x+0.004 1,R2=0.999 6,可得出K值为99.5,符合国标要求。
2.1 不同底物浓度对试验结果的影响
试验中称取角蛋白酶约1 g,用缓冲液稀释200倍。此酶浓度下的角蛋白酶与不同浓度的底物溶液进行反应的试验结果见表1。
以底物浓度(%)为横坐标,以反应速度(μg/min)为纵坐标绘制平滑曲线得图2。
根据图2可以观察出,当底物浓度大于1.5%以上时,反应速度的增长逐渐趋于平缓,说明继续增大底物浓度并不能继续提高反应速率,也就是酶活性也随之趋于平缓。设底物浓度为S,反应速度为V,继续采用双倒数作图,即以1/S为横坐标,以1/V为纵坐标做回归曲线,得到图3。
得到回归方程为y=0.132 3x+0.054 2,R2=0.996 8,可得到Km值为2.44%。按照理论,反应的底物浓度S应为Km值的5倍以上,但是根据上述试验空白的吸光值可以看出,当底物浓度越高时,空白的吸光值也就越大,底物浓度为1%时的空白吸光值已经接近0.5,底物浓度为1.5%时的空白吸光值接近0.6,底物浓度为2%时的空白吸光值已经接近0.7。当S=5 Km时,即底物浓度约为12.2%,此时的空白吸光值必定大于1,已经超过分光光度计的有效检测范围。所以根据图2及表1中的数据,将底物浓度设置为1%。
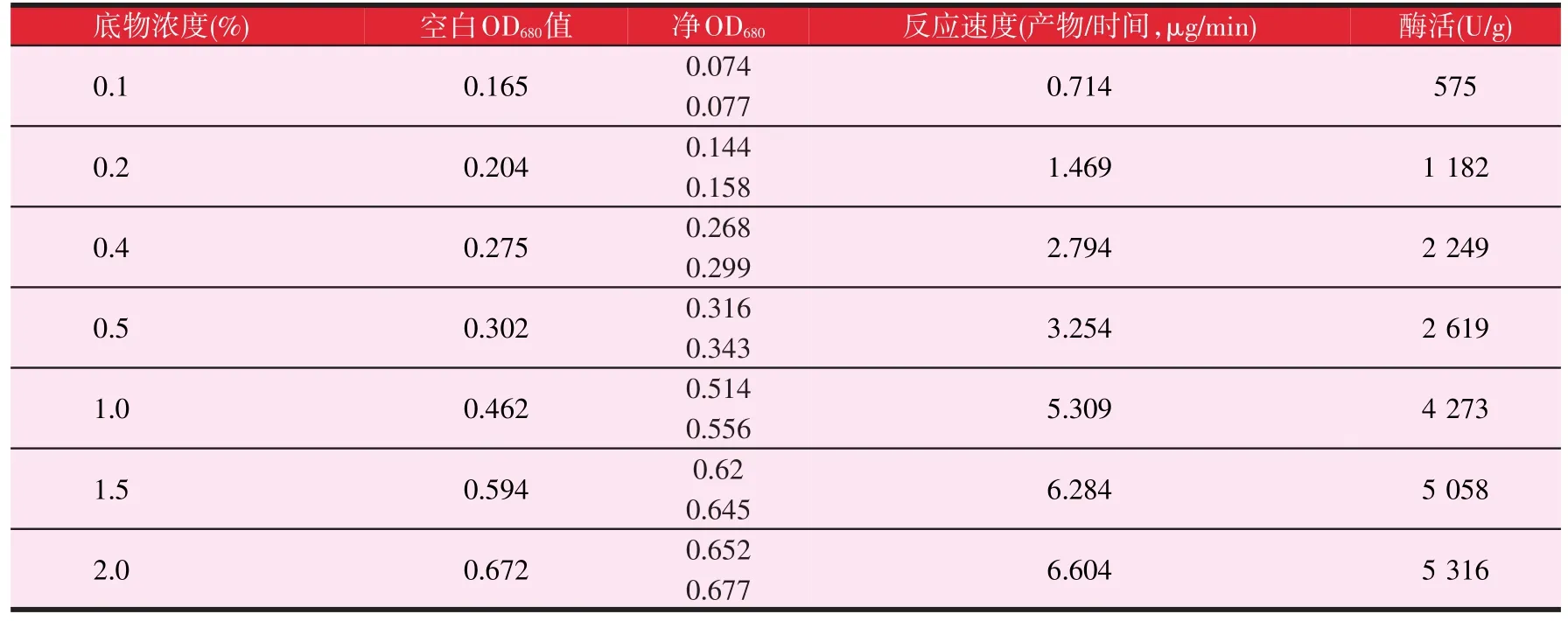
表1 不同底物浓度时的反应速度和酶活
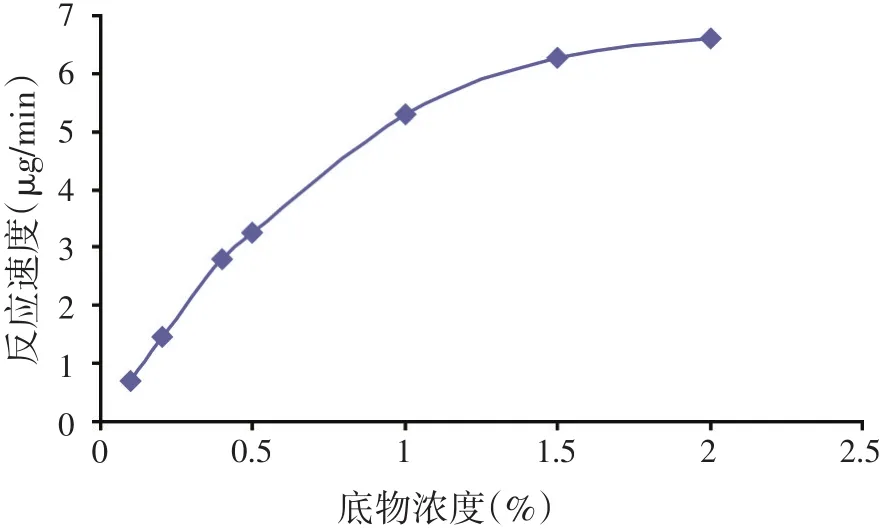
图2 底物浓度-反应速度曲线图
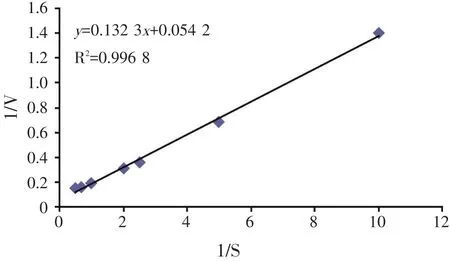
图3 1/S-1/V曲线
2.2 不同反应时间对试验结果的影响
将初始酶液稀释至600倍、700倍和800倍,此三种酶浓度分别反应5、10、15 min和20 min后,计算出不同酶浓度下和不同反应时间时的反应速度,以反应时间为横坐标,以反应速度为纵坐标,绘制不同酶浓度下的反应速度曲线,见图4。
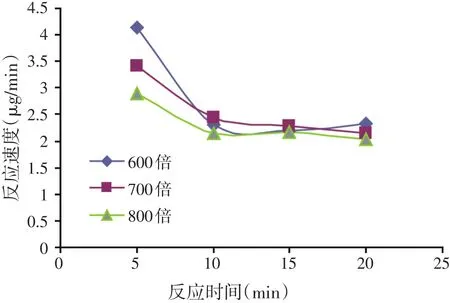
图4 不同酶浓度的反应速度曲线
根据图4可以看出,3种不同的酶浓度下,反应时间从5 min到10 min时,反应速度均迅速下降,反应时间在10、15 min和20 min时,反应速度的变化并不是很大,趋于平缓。这说明反应0~5 min时,酶解反应仍在进行中;10 min以后,酶解反应的速度基本趋于平缓,说明酶解反应基本已经保持平衡,进行比较彻底,由此可以认为10 min是该试验比较合适的反应时间。
2.3 不同吸光值范围对试验结果的影响
根据1.2.3所述条件进行试验,得到的结果见表2。
根据表2的结果可以看出,当酶浓度减小时,相应的吸光值也在随之降低,说明酶浓度与吸光值之间存在正比例关系,而且不同酶浓度下的平行值均较好。根据吸光值较好的范围,对数据的标准差和变异系数进行分析,结果见表3。
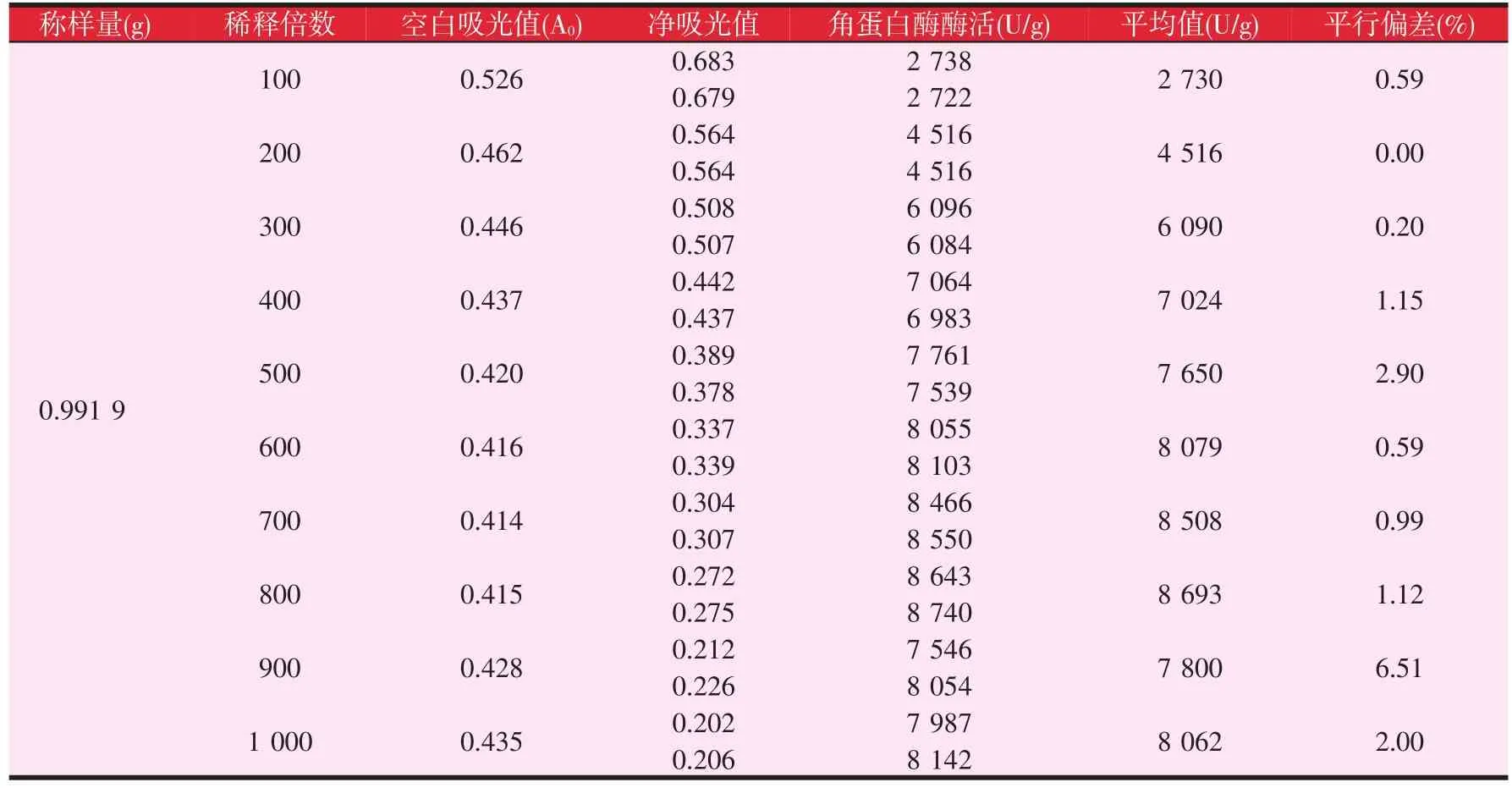
表2 不同酶浓度下角蛋白酶的活性

表3 不同吸光值范围的结果之间标准差和变异系数
一般酶活性检测中,吸光值有效范围基本在0.2~0.5之间。在此范围内对不同区间的吸光值范围的结果进行分析,可以看出这段吸光值区间内的结果比较集中,变异系数很小,得到的结果比较集中,说明控制吸光值的范围,不同酶浓度所得到的结果都能较科学的表现出酶活性。此试验中认为变异系数在7%以下的吸光值区间都可以算作真实有效的,所以认为吸光值在0.2~0.45之间比较合适。
2.4 不同酶种对试验结果的影响
分别与不同酶种反应后得到的试验结果见表4。
根据表4的结果可以看出,中性蛋白酶和碱性蛋白酶按照此方法可以检测出部分角蛋白酶的活性,可能是因为角蛋白酶、中性蛋白酶和碱性蛋白酶均属于蛋白酶类,中性蛋白酶和碱性蛋白酶在生产过程中发酵条件与角蛋白酶相似,所以在分离提纯时也会将同属蛋白酶类的角蛋白酶包含进去,所以中性蛋白酶和碱性蛋白酶能够检测出角蛋白酶的活性。而酸性蛋白酶、木聚糖酶和脂肪酶测出的吸光值都非常低,可以认为是误差影响的吸光值,当吸光值低于0.003时,还会计算出负值。这说明了此种水解角蛋白底物的专一性比较好,角蛋白酶可特异水解此种底物。
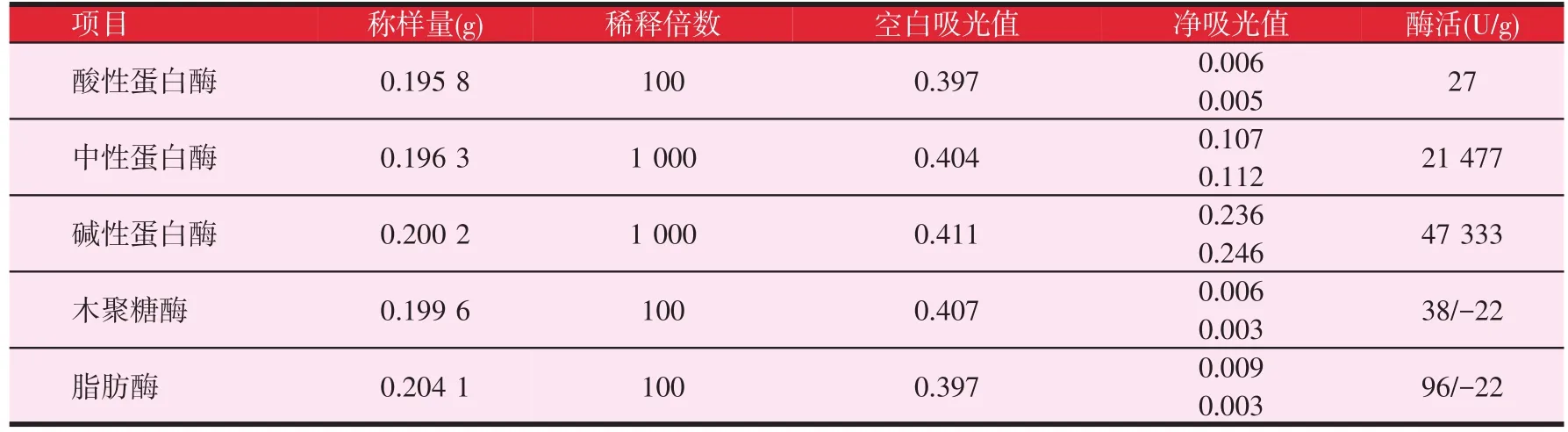
表4 不同酶种与水解角蛋白反应酶活
3 结论
本试验从底物浓度、反应时间、吸光值有效范围和底物专一性这四个方面科学的研究了液体角蛋白在检测过程中的适用性和可行性,优化了传统检测角蛋白酶活性的方法。研究认为采用水解角蛋白作为底物时,底物浓度1%、反应时间10 min、净吸光值有效范围0.2~0.45,在满足上述条件时测定出来的角蛋白酶活性可以较准确的反映出角蛋白酶的真实活性。优化后的方法在一定程度上可以更科学的衡量发酵水平,改进生产技术提供一定帮助。
