两种微生态制剂对虎龙斑体成分、肠道消化酶及组织学结构的影响
2018-12-29李小梅张海发石和荣
■黄 灵 李小梅 舒 琥* 张海发 石和荣
(1.广州大学生命科学学院,广东广州510006;2.揭阳市揭东第一中学,广东揭阳515500;3.广东省大亚湾海洋渔业试验中心,广东惠州516081)
随着养殖环境的不断恶化,养殖鱼类病害越来越多,为了稳产和高产,一些养殖户在养殖过程中违规使用抗生素、禁用化合物及兽药残留超标的现象越来越严重。因此,急需寻求绿色、生态并能提高水产动物饲料转化率和免疫功能的添加剂,从而减少抗生素和化学药物的使用。研究发现,饲料中添加微生态制剂可以提高奥尼罗非鱼的饲料利用率和抗病力(杨奇慧等,2009),微生态制剂是在微生态理论指导下,使用对宿主有益无害的活的一般微生物或促微生物生长的物质,具有快速降解、吸收和转化养殖环境中残饵、粪便、氮和磷等污染物的生物制剂或活菌制剂(齐红莉等,2004)。微生态制剂在鱼类养殖的报道较多。但有关微生态制剂在虎龙斑养殖生产应用上的研究鲜有报道,本试验旨在探讨两种微生态制剂对虎龙斑体成分、肠道消化酶和肠道、肝脏及头肾结构的影响,为开发新的微生态制剂及其在虎龙斑生产上的应用提供参考和依据。
1 材料和方法
1.1 试验饲料及微生态制剂
试验饲料包括基础饲料、乳化鱼油包裹饲料(由2%饲料量的乳化鱼油包裹基础饲料)、益生菌饲料(益生菌饲料由基础饲料与不同用量的益生菌混匀,再以2%饲料用量的乳化鱼油包裹制得)。试验用的基础饲料由广东越群饲料公司提供,其详细营养成分见表1。两种微生态制剂分别为芽孢杆菌(Bacillus sp.)制剂和光合细菌(Photosynthesis bacteria)制剂,芽孢杆菌制剂分别由地衣芽孢杆菌(B.licheniformis)和短小芽孢杆菌(B.pumilus)按1∶1比例混合组成,光合细菌制剂是沼泽红假单胞菌,其中,地衣芽孢杆菌、短小芽孢杆菌和光合细菌的有效活菌数分别为1.0×109、2.0×109cfu/g和1.0×109cfu/g。

表1 试验饲料基本营养成分组成
1.2 试验鱼及饲养管理
试验用的虎龙斑由广东省海洋渔业试验中心提供,并在该中心进行养殖试验。选用540尾体质量为(33.98±4.91)g、体长为(10.48±0.61)cm的虎龙斑,随机分为6个组,每组3个重复,每个重复30尾鱼,分别放入18个网箱(1.0 m×1.0 m×1.0 m)内。分别在基础饲料中添加低浓度0.1%的芽孢杆菌制剂、高浓度0.5%的芽孢杆菌制剂、低浓度1%的光合细菌制剂和高浓度5%的光合细菌制剂,并以2%饲料用量的乳化鱼油包裹,配制成编号为Diet 1、Diet 2、Diet 3、Diet 4四种饲料作为添加组,再增设乳化鱼油组和对照组。
在整个试验期间,每20 d测量一次虎龙斑的总重,日投喂率为体质量的3%,日投喂量的多少是由上一次测量鱼的总重和其固定的投喂量率一同决定的。每天定量投喂2次,分别于8:30和16:30各投喂一次。整个试验期间水质如下:平均水温27~31℃,盐度25‰~30‰,pH值7.5~8.0,溶氧≥5 mg/l,氨氮≤0.04 mg/l。
1.3 样品采集
正式饲养60 d,停止投喂24 h后,采集鱼的肌肉、肠道保存于-80℃冰箱,用于体成分和消化酶活力分析;另取肠道、肝脏和头肾在波恩氏液中固定24 h后,更换70%的乙醇保存,用于组织结构分析。
1.4 测定指标与方法
1.4.1 鱼体成分分析
取保存于-80℃的肌肉样品放到烘干机中干燥至恒重,然后测其常规成分。粗蛋白质含量采用凯氏定氮法测定;粗脂肪含量采用索氏抽提仪,以乙醚为抽提液测定;粗灰分含量采用马弗炉中550℃燃烧失重法测定。
1.4.2 肠道消化酶活力分析
将冰水浴解冻后的肠道称重,加入9倍体积预冷的生理盐水,在冰水浴条件下匀浆,然后在4℃、3 000 r/min离心20 min,保留上清液。上清液用于测定肠道胰蛋白酶(Trypsin)、肠道淀粉酶(Amylase)和肠道脂肪酶(Lipase)活力,采用南京建成生物工程研究所生产的相应试剂盒测定,操作步骤按照说明书进行。
1.4.3 组织学结构分析
将固定的虎龙斑幼鱼的肠道、肝脏和头肾经酒精逐级脱水、透明、透蜡、包埋、切片,切片厚度0.5~0.8 μm,HE染色,中性树胶封片。在显微镜下观察并拍照。
1.5 数据处理及图像分析
HE染色后每组各取5尾鱼的切片,在每张切片中随机测量5组数据取平均值作为该切片的数据,再以5张切片数据的平均值作为1尾鱼组织结构的数据,然后再取每组5尾鱼切片数据的平均值作为每个试验组鱼组织结构的最后数据。用SPSS17.0进行单因素方差分析(One-Way ANOVA),若差异显著,则用Duncan's法进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 两种微生态制剂对虎龙斑肌肉体成分的影响(见表2)

表2 两种微生态制剂对虎龙斑肌肉体成分的影响(%)
如表2所示,微生态制剂显著提高了虎龙斑粗蛋白质含量,所有添加组均显著高于对照组和乳化鱼油组(P<0.05)。虎龙斑肌肉粗脂肪含量则试验Diet 2组和Diet 3组显著低于乳化鱼油组(P<0.05),其他各组之间没有显著性差异(P>0.05)。粗灰分含量则乳化鱼油组显著高于对照组和其他各微生态制剂添加组。
2.2 两种微生态制剂对虎龙斑肠道消化酶的影响(见表3)

表3 两种微生态制剂对虎龙斑肠道消化酶的影响
如表3所示,微生态制剂显著提高了虎龙斑肠道胰蛋白酶活性,所有添加组均显著高于对照组和乳化鱼油组(P<0.05)。虎龙斑肠道淀粉酶活性则Diet 1组和Diet 3组均显著高于对照组和乳化鱼油组(P<0.05),Diet 2组极显著高于对照组和乳化鱼油组(P<0.01),而Diet 4组与对照组和乳化鱼油组没有显著性差异(P>0.05)。微生态制剂添加组的虎龙斑肠道脂肪酶活性与对照组和乳化鱼油组都没有显著差异性(P>0.05),而乳化鱼油组的脂肪酶活性则显著高于对照组(P<0.05)。
2.3 两种微生态制剂对虎龙斑肠道组织结构的影响(见表4、图1)

表4 两种微生态制剂对虎龙斑肠道组织结构的影响(μm)
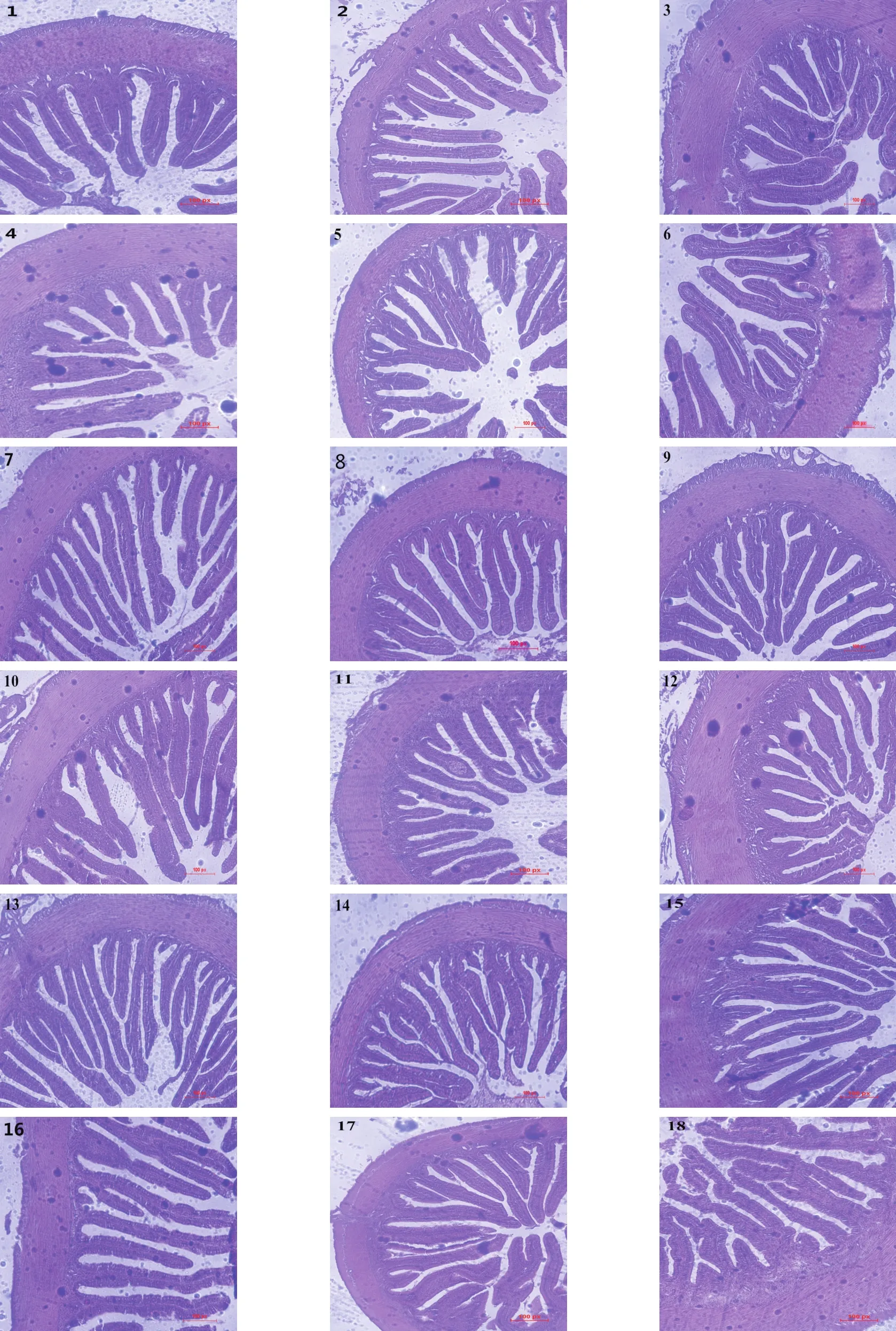
图1 微生态制剂对虎龙斑肠道结构的影响(×100)
如表4和图1所示,试验虎龙斑肠道组织结构在前肠、中肠和后肠中浆膜层在最外侧,肠绒毛高度在最内侧,肌层厚度在两者之间。在前肠的肠绒毛高度中,Diet 2组和Diet 3组显著高于乳化鱼油组(P<0.05),而在中肠中,Diet 2组的肠绒毛高度显著高于乳化鱼油组(P<0.05),肌层厚度和浆膜层在前肠、中肠和后肠中各组之间的高度没有显著性差异(P>0.05)。
2.4 两种微生态制剂对虎龙斑肝脏组织结构的影响
在鲜肝颜色上,各添加组的肝脏颜色都是鲜红的,而对照组和乳化鱼油组的肝脏颜色相对是浅红的。肝脏组织切片的显微观察结果如图2和表5所示,各组的肝细胞都出现不同程度的脂肪空泡化现象,其中乳化鱼油组最严重,脂肪空泡化程度分级++,对照组、Diet 1、Diet 2、Diet 3组和Diet 4组的肝细胞脂肪空泡化程度分级+,但从图2(D)和图2(E)中可以看出,Diet 2组和Diet 3组效果是较好的,其肝细胞未发生病变和出现较少的脂肪空泡化现象。在肝脏细胞坏死程度上,乳化鱼油组的程度分级++,其肝细胞脂肪变性,排列不规则紊乱,细胞核被挤压甚至消失,有的细胞核溶解破裂变性,变性后的肝细胞随后坏死。对照组、Diet 1组和Diet 4组的程度分级+,其肝组织轻度脂肪变性,肝细胞部分肿胀,排列不整齐,发生轻度病变与坏死。Diet 2组和Diet 3组的程度分级-,试验虎龙斑的肝细胞排列整齐而完整,肝细胞索明显,且肝细胞形态正常,核大而圆,居中央。
2.5 两种微生态制剂对虎龙斑头肾组织结构及免疫细胞数量的影响
虎龙斑的头肾位于心腹隔膜前,呈红褐色扁平状,分为左右2叶,在头肾的基部相连。在心腹隔膜前为头肾,心腹隔膜后为后肾。由图3的组织切片观察,虎龙斑头肾外覆盖一层结缔组织性的被膜,可见少量的圆形细胞和其它免疫细胞。头肾是一种网状结构的淋巴样实质组织,实质组织无肾单位,主要由淋巴组织和造血组织构成。淋巴组织是由淋巴细胞、中性粒细胞和黑色素巨噬细胞等免疫细胞组成,头肾组织间分布有动脉血管、静脉血管和其形成的其它分枝。淋巴细胞在头肾组织中是数量最多的细胞,细胞较小,呈圆形或椭圆形;中性粒细胞数量较少,细胞呈圆形或椭圆形,细胞核较大;黑色素巨噬细胞在头肾组织中是数量最少的,其细胞核较大,胞质较少。肾上组织和造血组织分布于淋巴组织间。
如表6所示,微生态制剂对虎龙斑各组间的头肾组织细胞总数没有显著差异(P>0.05);在淋巴细胞中,Diet 2组显著高于乳化油组(P<0.05),其他各组之间均无显著差异(P>0.05);微生态制剂对虎龙斑头肾组织的中性粒细胞没有影响,均无显著差异(P>0.05);微生态制剂可以显著增加Diet 2组和Diet 3组的黑色素巨噬细胞,数量显著地大于乳化鱼油组(P<0.05),其他各组之间无显著差异(P>0.05)
3 讨论
3.1 两种微生态制剂对虎龙斑肌肉体成分的影响
张雯等(2015)研究发现,在饲料中拌喂微生态制剂并在养殖水体中施用,可以显著提高建鲤肌肉的粗蛋白含量,但只在养殖水体中施用微生态制剂对试验鱼没有显著的影响。艾炎军等(2013)研究发现,以芽孢杆菌、光合细菌、EM菌按1∶2∶2和2∶1∶2的比例混合在养殖水体中施用并投喂大鳞副泥鳅(Misgurnus anguillicaudatus)32 d,试验组泥鳅机体的粗蛋白质含量显著提高,粗脂肪和灰分含量显著降低,作者认为可能的原因是,微生态制剂本身富含各种营养成分,并改善了机体的代谢,提高了机体肠道内的各种消化酶,从而促进了机体营养成分的沉积。在本研究中,相对于乳化鱼油组,饲料中添加芽孢杆菌制剂和光合细菌制剂可以提高虎龙斑机体粗蛋白质含量,降低虎龙斑的粗脂肪和灰分含量,与上述研究结果相一致。
3.2 两种微生态制剂对虎龙斑肠道消化酶的影响
鱼类的消化和吸收能力在其生长中起着重要的作用(Hakim等,2006)。Suzer等(2008)发现,金头鲷稚鱼摄食益生菌富营养化的生物饵料后,稚鱼蛋白酶、脂肪酶及淀粉酶活力均高于对照组。张雯等(2015)研究发现,在饲料中拌喂微生态制剂并在养殖水体中施用可以显著提高建鲤肠道的蛋白酶、脂肪酶和淀粉酶。类似的,在本试验中,各个微生态制剂添加组的虎龙斑肠道胰蛋白酶和淀粉酶都显著增加。但光合细菌制剂高浓度组的淀粉酶没有明显增加,还有虎龙斑肠道脂肪酶相比对照组和乳化鱼油组没有显著的影响,这有可能因持续或过量的添加会抑制内生酶的活性,从而影响了虎龙斑肠道的脂肪酶活性,Tovar-Ramirez等(2004)也发现了类似的结果。当机体肠道内消化酶活性提高时,机体可以更有效的对饲料中营养物质的吸收,转化和应用,从而促进了鱼类的生长,降低了鱼类的饲料系数。在本研究中,饲料中添加芽孢杆菌制剂和光合细菌制剂可以提高虎龙斑肠道的消化酶,促进虎龙斑的生长,这与相关研究类似(Ziaei-Nejad等,2006;Gullian等,2004)。

图2 微生态制剂对虎龙斑肝脏组织结构的影响(×200)

表5 两种微生态制剂对虎龙斑肝脏组织结构的影响
3.3 两种微生态制剂对虎龙斑肠道组织结构的影响
虎龙斑幼鱼的肠道可分为前肠、中肠和后肠,其肠道结构由外到内分为浆膜层、肌层、黏膜下层和黏膜层。在本试验研究中,虎龙斑幼鱼的肠绒毛高度前肠>中肠>后肠,肌层厚度后肠>前肠>中肠,这与另一种杂交石斑鱼(青龙斑)的肠道组织结构相似(李加儿等,2016)。有研究说明,黄鳍鲷(Sparus latus)和驼背鲈(Chromileptes altivelis)的肠绒毛高度从前肠到后肠是逐渐降低(王永翠等,2012;区又君等,2011),这与本研究结果相同,表明虎龙斑幼鱼前肠的营养物质吸收消化能力最强,后肠最弱。

图3 虎龙斑头肾组织学结构(×1 000)

表6 两种微生态制剂对虎龙斑头肾免疫细胞数量的影响(个/张切片)
鱼类肠道绒毛高度和密度的多少对其营养物质的吸收和消化是至关重要的,有研究发现,饲料中添加芽孢杆菌可以显著提高欧洲龙虾的肠绒毛高度和密度(Daniels等,2010),Pirarat等(2011)研究表明在基础日粮中添加乳酸菌对尼罗罗非鱼(Oreochromis niloticus)的肠绒毛高度有显著地影响。此外,在虹鳟鱼(Oncorhynchus mykiss)的研究中还发现,微生态制剂对试验鱼的肠道组织结构和发育都有积极的影响(Merrifield等,2010)。在本研究中,饲料中添加芽孢杆菌制剂和光合细菌制剂可以改善虎龙斑幼鱼的肠道组织结构,促进了虎龙斑肠绒毛的生长和发育,保护了虎龙斑肠道组织结构的完整性和稳定性,这与罗辉等(2006)在鲤鱼(Cyprinus carpio)中的研究结果一致。但微生态制剂对虎龙斑幼鱼肠道组织结构影响的具体原因尚不明确,需要人们进一步对其详细机理进行研究和评估。
3.4 两种微生态制剂对虎龙斑肝脏组织结构的影响
肝脏是鱼类身体内以代谢功能为主的一个器官,并在身体里面扮演着氧化,储存肝糖,解毒等功能。试验虎龙斑各组都出现不同程度的脂肪空泡化现象,这可能与饲料中的脂肪含量和添加到饲料中的乳化鱼油有关,本试验饲料的粗脂肪含量为10%,有研究表明,当饲料中的脂肪含量高于10%时,美国红鱼(Sciaenops ocellatus)和红鳍东方鲀(Takifugu rubripes)的肝脏都会出现较严重的脂肪空泡化和不同程度的病变现象(李雪菲等,2015;孙阳等,2013),鱼肝油乳的成分含有鱼肝油,过量的摄食可能是造成脂肪空泡化的原因之一。但也有可能是饲料中存在一些抗营养因子,饲料发生霉变、污染或者过量投喂等原因。
雷晓中等(2015)研究表明,摄食配合饲料中加苏丹草和浮萍与直接摄食苏丹草和浮萍的草鱼肝脏组织和细胞形态结构正常,但只摄食配合饲料的草鱼肝细胞发生了病变与坏死,可能苏丹草或浮萍中含有一些免疫增强剂,增强了草鱼的免疫力,从而减少对草鱼肝脏组织的损伤。在本研究发现,Diet 2组和Diet 3组相对其他试验组,肝细胞形态正常,排列整齐,较少出现脂肪空泡化现象,这可能是虎龙斑摄食了芽孢杆菌制剂和光合细菌制剂之后,其自身的免疫力提高,从而减少对虎龙斑肝脏组织的损伤,至于微生态制剂对鱼类肝脏组织结构影响的具体原因还需要进一步的研究。
3.5 两种微生态制剂对虎龙斑头肾组织结构及免疫细胞数量的影响
在虎龙斑头肾结构上,分为左右2叶,与徐晓津等(2008)在大黄鱼(Pseudosciaena crocea)和 Abdel-Aziz等(2010)在尼罗罗非鱼(Oreochromis niloticus)中报道的相似。在胚胎时期,鱼类的头肾起源于前肾,具有泌尿功能。但到了成体后,不同种间的鱼类,其头肾结构和功能也有较大的差异,如Safter等(1982)报道在弹涂鱼(Periophthalamus koelreuteri)的头肾中有许多肾单位结构,且与后肾的肾单位较难区分,而条石鲷(Oplegnathus fasciatus)、驼背鲈(Chromileptes altivelis)、鲻(Mugil cephalus)等大多数硬骨鱼类头肾无肾单位(胡玲玲等,2010;区又君等,2015;曹守花等,2013)。在本研究中,虎龙斑的头肾中无肾单位,其淋巴组织主要由淋巴细胞、中性粒细胞和黑色素巨噬细胞等免疫细胞构成,头肾组织间还分布着血管等造血组织,说明虎龙斑的头肾具有免疫和造血功能,与区又君等(2015)在驼背鲈头肾的研究中类似。
头肾免疫细胞是鱼类参与免疫应答与反应的重要细胞,影响着鱼类的特异性免疫和非特异性免疫功能,从而影响鱼类的生长与健康。研究表明,复合微生态制剂可以显著提高花鲈(Lateolabrax japonicus)头肾巨噬细胞数量和巨噬细胞的杀伤力(吴桂玲等,2007),夏耕等(2012)在饲料中添加抗菌肽和枯草芽孢杆菌可以提高花鲈头肾的非特异性免疫功能。在本试验研究中,相比乳化鱼油组,高浓度芽孢杆菌制剂组可以显著提高虎龙斑头肾的淋巴细胞数量和黑色素巨噬细胞数量,低浓度光合细菌制剂组显著提高了黑色素巨噬细胞数量。这表明饲料中添加芽孢杆菌制剂和光合细菌制剂在一定程度上可以提高虎龙斑头肾免疫细胞的数量,从而提高虎龙斑的免疫力。
