植物乳杆菌对尼罗罗非鱼的肠道黏膜免疫调节及生长性能的影响
2018-12-29刘长军
■刘长军
(象山县水产技术推广站,浙江象山315700)
益生菌是一类能在肠道内定植,维护肠道菌群平衡,并刺激肠黏膜免疫组织,对肠道黏膜免疫有重要的影响的有益微生物群落。近些年来已有很多学者研究表明,益生菌可以影响动物的免疫功能,增加肠道黏膜对外界的抵抗力,增强动物机体的抗病性[1-3]。然而,不同菌株的特性、稳定性及作用机制各不相同,尚待进一步挖掘与研究。随着水产动物饲料中抗生素等化学药物的应用带来的负面作用日益突出,如何有效地提高水产动物的免疫力和对疾病的抵抗力成为水产养殖业可持续发展的关键和研发热点。由于具有使用安全和方便等优点,益生菌被逐渐应用于鱼类、甲壳类等水产动物饲料中,如酵母菌、乳酸菌等复合益生菌应用于罗非鱼养殖中,结果发现罗非鱼的生长及成活率都有所提高,并且可以显著提高抗氧化水平和肠道蛋白酶活性[4-5]。
尼罗罗非鱼(Oreochromis niloticus)引种于非洲,因其生长快、体型大、肌间刺少、口感鲜美,深受消费者喜爱。在养殖中,国内外关于罗非鱼细菌性疾病的报道较多,主要有无乳链球菌(Streptococcusagalaciate)、蜡状芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)等,其中嗜水气单胞菌可引起罗非鱼体色发黑、肝脏充血、腹腔积水,死亡率很高[6]。有最新研究表明,商业化益生菌制剂AquaStar Growout饲喂罗非鱼可提高生长性能,并且调节肠道黏膜免疫和提高抗细菌感染能力[7]。本研究基于前期分离的植物乳杆菌(Lactobacillusplantarum)08.923,研究其对尼罗罗非鱼肠道黏膜免疫调节的作用,以及对生长性能和抗病力的影响。
1 材料与方法
1.1 细菌菌株和培养
植物乳杆菌08.923(L.plantarum08.923)分离于发酵乳,由浙江省重点实验室惠赠;嗜水气单胞菌NJ-1(NJ-1)由上海海洋大学惠赠。将分离保存的植物乳杆菌 08.923接种于MRS(de Man,Rogosa,Sharpe)肉汤培养基,37℃厌氧培养48 h。嗜水气单胞菌NJ-1用LB(Luria-Bertani)培养基培养,37 ℃摇床培养12 h,300 r/min。将菌液离心(3 500×g,10 min,4℃),弃上清。用无菌PBS缓冲液漂洗三次后加入适量的PBS重悬,参照嗜水气单胞菌的标准曲线计算悬浊液中嗜水气单胞菌的浓度[8]。
1.2 尼罗罗非鱼的饲养及饲料的制备
健康尼罗罗非鱼购自浙江武义水产良种场,为尼罗罗非鱼吉福品系,初始体重(18.0±2.5)g/尾。基础饲料参考《罗非鱼配合饲料》(SC/T 1025—2004),每日上午和下午各投喂1次,饱饲量投喂。试验采用的养殖设施为椭圆形玻璃缸(总体积0.4 m3,水体体积0.25 m3)。循环流水系统,曝气自来水,每池进水速率大约为0.8 L/min。养殖试验期间均连续充氧(除投饵期间外)。试验期间水温(25.0±1.0)℃,pH值7.5±0.5,溶氧≥5 mg/l,氨氮<0.2 mg/l,余氯<0.1 mg/l。
饲料共两组:植物乳杆菌组和对照组。植物乳杆菌组的饲料制备:将培养好的L.plantarum08.923经PBS缓冲液漂洗后重悬,参照Zhou等[8]中的标准曲线,细菌定量为107个细胞/ml PBS缓冲液,按照1 ml PBS缓冲液∶1 g基础饲料的比例,在无菌培养皿中均匀喷洒含有L.plantarum08.923的PBS缓冲液,用脱脂牛奶作为保护剂,在每毫升PBS缓冲液加入0.01 g脱脂牛奶,配成107CFU/g饲料。对照组中只喷洒无菌PBS,20℃风干15 h。并参照Harikrishnan等[9]的方法包装、存放、检测细菌存活率。
1.3 实验动物分组
购买的尼罗罗非鱼暂养7 d稳定后开始实验,实验时间为70 d。将实验鱼随机分为2组,每组3个重复,每个重复40尾。一组用于饲喂添加L.plantarum08.923的饲料,一组饲喂用PBS制备的饲料作为对照组,分别持续饲喂70 d后用嗜水气单胞菌NJ-1进行浸浴攻毒实验,每组10尾用低浓度(105CFU/ml)攻毒,攻毒12 h后将尼罗罗非鱼冲洗三遍并移到普通饲养水中,在攻毒后的第1、2、3 d进行肠道取样(n=3)用于PAS染色黏多糖及细胞因子表达的分析。每个重复剩余的30尾,用一次性注射器通过腹腔注射嗜水气单胞菌菌液0.2 ml/尾(菌液质量浓度为半数致死量1 000万CFU/ml),并记录攻毒后1、24、36、48、72 h和96 h内鱼死亡情况,计算存活率(Survival rate,SR)。
1.4 生长性能指标测定
在养殖实验开始和结束时分别对尼罗罗非鱼称质量,计算平均增重(Average weight gain,AWG)、增重率(Weight gain rate,WGR)、特定生长率(Specific growth rate,SGR)及饵料系数(Feed coefficient,FC)。
平均增重(AWG)=终末均重-初始均重
增重率(WGR,%)=(终末均重-初始均重)/初始均重×100
特定生长率(SGR,%/d)=(ln终末均重-ln初始均重)/实验天数×100
饵料系数(FC)=投饵量/(终末均重-初始均重)
1.5 肠道切片PAS染色
取鱼的肠道切片进水脱蜡后,放至过碘酸溶液2~5 min,用蒸馏水充分漂洗,在室温浸于希夫试剂15 min,再置于亚硫酸盐溶液,反复换液三次,每次2 min,此后在流动的水溶液中冲洗5 min,再用蒸馏水漂洗1 min,用Harris苏木精复染,然后再在流动的水溶液中冲洗,再用蒸馏水漂洗,用85%乙醇和100%乙醇脱水,最后二甲苯处理后中性树脂封片。
1.6 实时荧光定量PCR检测
用Trizol提取总RNA,逆转录为cDNA后进行扩增,引物由英潍捷基(上海)贸易有限公司合成(见表1)。采用实时荧光定量PCR仪(Nano,Roche),其中内参基因为 RpL13。RT-PCR 采用 20 μl体系:2×SYBR Green Mix 10 μl,20 μM的正反引物各0.4 μl,cDNA模板2 μl,ddPCR水7.2 μl。

表1 实时荧光定量PCR引物参数
进行PCR扩增的程序为:95℃预变性15 min,95 ℃变性20 s,60 ℃退火20 s,72℃延伸20 s,40个循环,72℃延伸10 min。在65℃时绘制溶解曲线,72℃时检测荧光信号。
1.7 数据处理
实验中获得的各组数据均采用Origin8.0和SPSS 16.0进行统计分析。结果均采用“平均数±标准差”表示,各组数据进行单因素方差分析(One-way ANOVA),比较均值使用Duncan’s极差检验,P<0.05,认为存在显著性差异;P<0.01,认为存在极显著差异。
2 结果
2.1 植物乳杆菌对尼罗罗非鱼生长性能的影响(见表2)
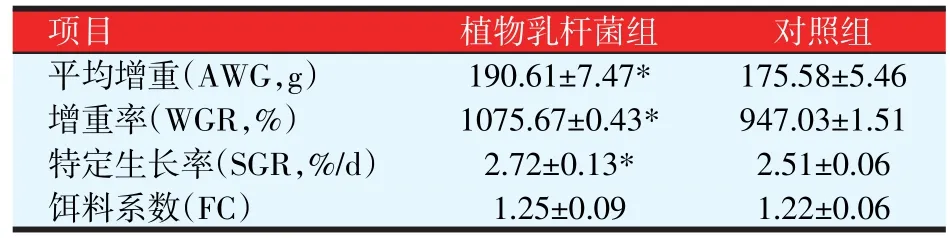
表2 植物乳杆菌对尼罗罗非鱼生长性能的影响
从表2可见,植物乳杆菌组的平均增重、增重率和特定生长率显著高于对照组(P<0.05),而饵料系数两组间无显著差异(P>0.05)。
2.2 植物乳杆菌对尼罗罗非鱼肠道黏膜免疫的影响
2.2.1 植物乳杆菌对尼罗罗非鱼肠道PAS显色黏液细胞的影响(见图1)
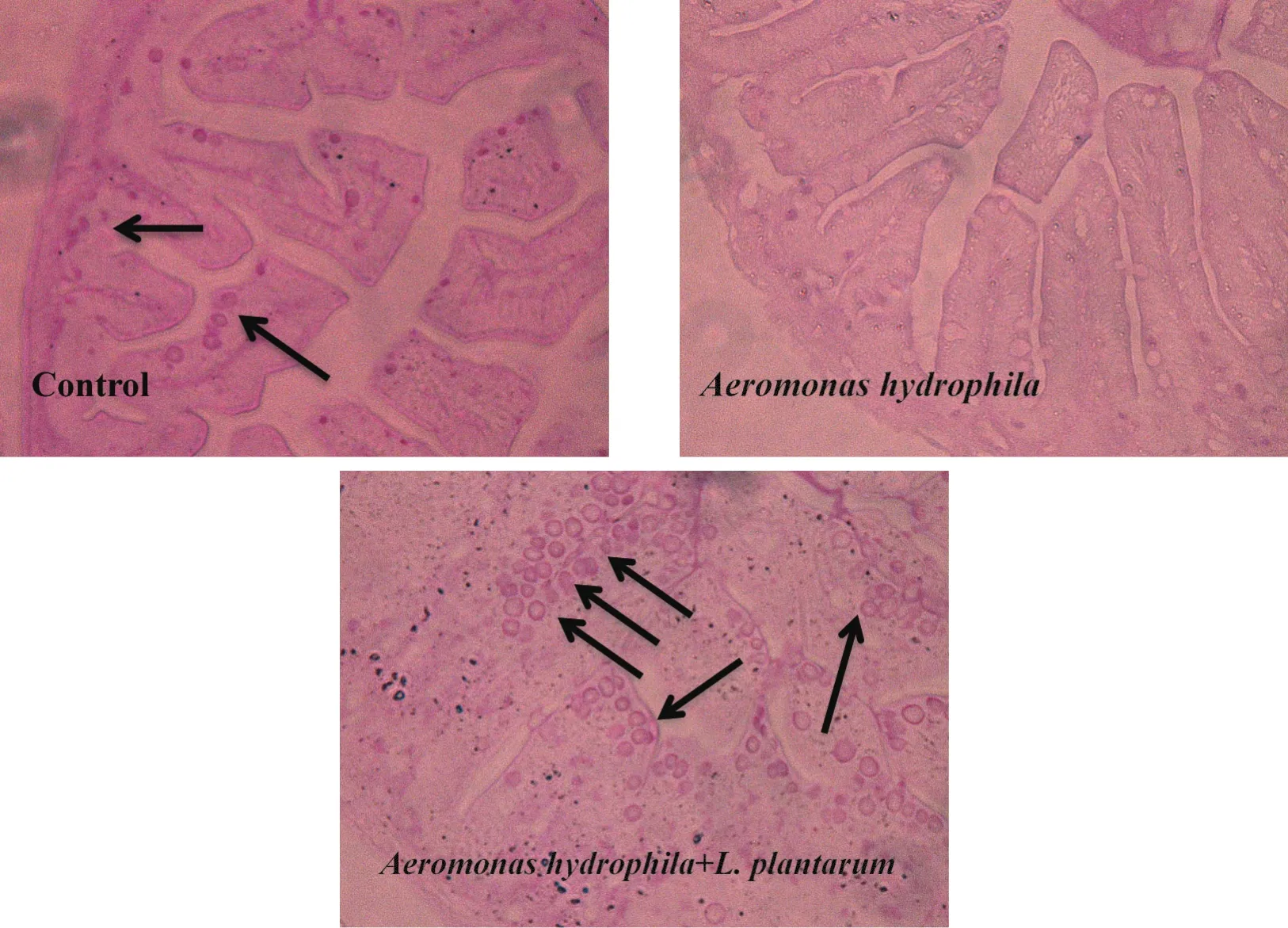
图1 PAS染色反应显示不同组肠道分泌的中性黏多糖
用研究级倒置显微镜观察PAS反应,如图1所示,箭头所指红色部分为肠绒毛游离面和杯状细胞膨大部。由于PAS反应能使中性黏多糖反应为红色,因此可以看出不同处理可以影响罗非鱼杯状细胞分泌中性黏多糖的含量。从实验结果可以看出,与对照组相比,低浓度嗜水气单胞菌NJ-1攻毒后肠道分泌的中性黏多糖明显减少,而在植物乳杆菌组使杯状细胞分泌的中性黏多糖显著增多。
2.2.2 植物乳杆菌对抗感染肠道细胞因子表达量变化的影响(见图2)
图2显示了低浓度嗜水气单胞菌NJ-1攻毒后尼罗罗非鱼肠道细胞因子的变化。在对照组和植物乳杆菌组中,四种细胞因子的相对表达量在攻毒后趋势不同。在攻毒后第1 d,饲喂L.plantarum08.923组的细胞因子IL-1β的相对表达量比对照组显著提高(P<0.001),但是随着攻毒后时间的延长,植物乳杆菌组的尼罗表达量逐渐与对照组接近(P<0.01),直到攻毒后第3 d两组无显著差异。而对于TNF-α和IL-10的相对表达量,在攻毒后的第1 d,饲喂L.plantarum 08.923比对照组都显著升高(P<0.01),但是在攻毒后的第3 d,TNF-α和IL-10的相对表达明显回落,但是植物乳杆菌组的IL-10还是处于一种较高的相对表达水平状态(P<0.05)。在攻毒后第1 d和第2 d,两组细胞因子NFκB的相对表达量均升高,且两组间差异不明显;但在攻毒后的第3 d,对照组NFκB的相对表达量急剧回落,而植物乳杆菌组仍保持较高水平,两组间差异显著(P<0.01)。
2.3 植物乳杆菌对尼罗罗非鱼抗病性的影响
在尼罗罗非鱼的饲料中添加植物乳杆菌后持续饲喂70 d,再用嗜水气单胞菌NJ-1腹腔注射攻毒,得到对照组与L.plantarum08.923处理组累积死亡率的变化如图3所示。对照组96 h累积死亡率为98.89%,植物乳杆菌组与对照组相比有明显的减少(P<0.01),96 h累积死亡率为36.67%。可见添加L.plantarum 08.923对罗非鱼的抗病性有了明显的提升。
3 讨论
本实验探讨了植物乳杆菌08.923对尼罗罗非鱼的肠道黏膜免疫调节、生长性能及抗病力的影响。结果表明,植物乳杆菌组的平均增重、增重率和特定生长率显著高于对照组,说明菌株具有提高尼罗罗非鱼生长性能的作用。PAS肠道染色反应显示了添加植物乳杆菌08.923对尼罗罗非鱼肠道中杯状细胞分泌的中性黏多糖的覆盖情况,发现饲喂菌株后能有效刺激鱼肠道中中性黏多糖的分泌量的增多,从而推测其能在肠黏膜保护中起到增强化学屏障作用。
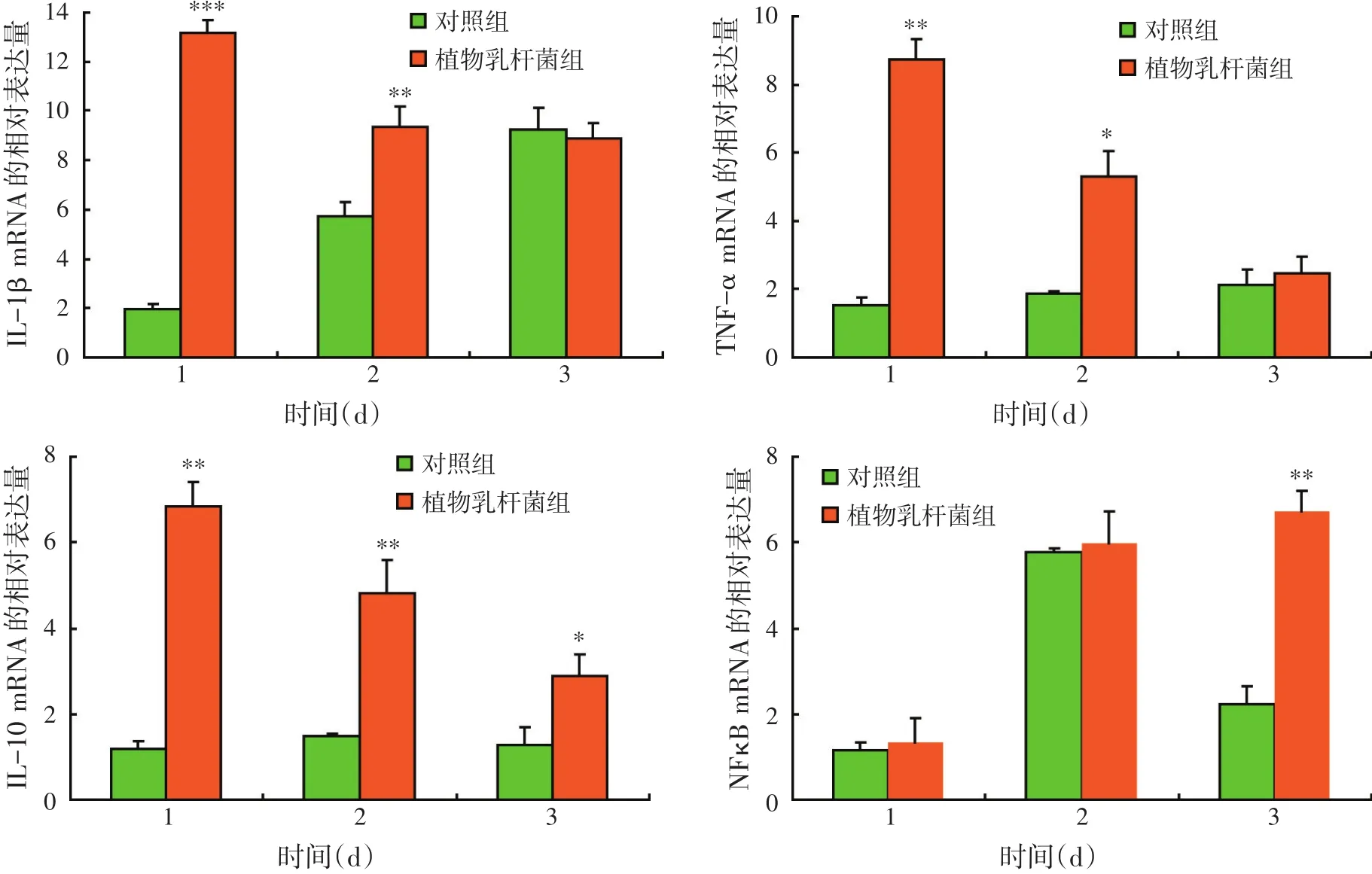
图2 低浓度嗜水气单胞菌NJ-1攻毒后植物乳杆菌对尼罗罗非鱼体内细胞因子相对表达量的影响
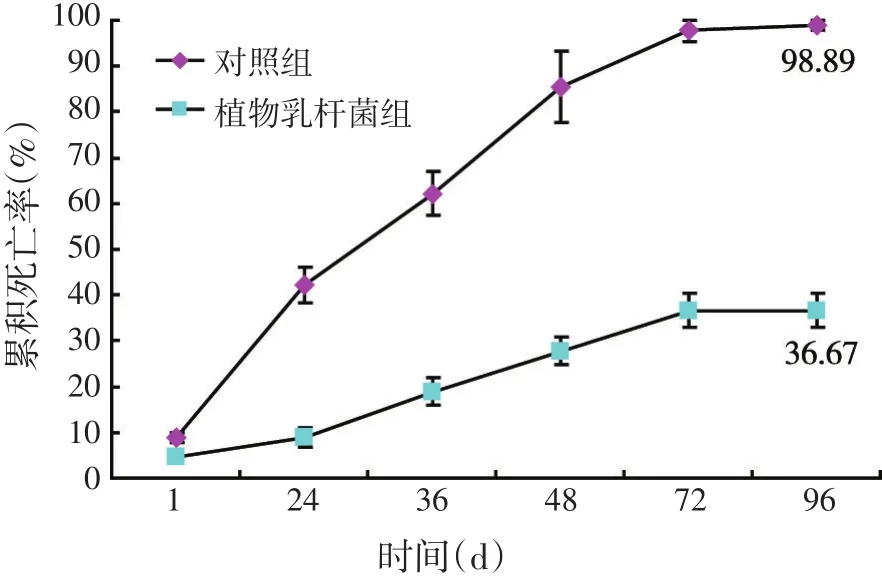
图3 嗜水气单胞菌NJ-1注射攻毒罗非鱼的平均累积死亡率
IL-1β和TNF-α是促炎性因子,IL-10是抑炎性细胞因子,而核因子κB(NFκB)体系主要涉及机体防御反应、组织损伤和应激、细胞分化和调亡以及肿瘤生长抑制过程的信息传递[10]。实验结果显示,添加植物乳杆菌08.923对于细胞因子NFκB、TNF-α和IL-10的相对表达比对照组都相对较高,说明菌株对尼罗罗非鱼的免疫刺激可能是通过NFκB信号通路实现的。抑炎性细胞因子IL-10具有限制肠上皮细胞对致病菌的免疫应答和维持对共生细菌稳态的作用[11],添加植物乳杆菌组的尼罗罗非鱼肠道中抑炎因子IL-10的相对表达量显著升高,揭示了植物乳杆菌08.923可以减小机体对于致病菌引起的炎症反应。有研究报道,益生菌(包括混合益生菌制剂VSL#3、单一的双歧杆菌、乳酸杆菌或乳酸乳球菌)能够促进单核/巨噬细胞或者树突细胞产生IL-10[12-14]。我们进行的嗜水气单胞菌攻毒实验,发现添加L.plantarum08.923后尼罗罗非鱼的累积死亡率显著降低,可能是因为植物乳杆菌08.923增强了肠道黏膜屏障和提高细胞免疫因子的调控分泌,使得其抗病力提升。
综上所述,植物乳杆菌08.923对尼罗罗非鱼有显著的黏膜免疫调节能力,在一定程度上能抑制炎症反应,增强机体的免疫应答,因而能显著提高生长性能及抗病力。植物乳杆菌08.923可作为预防水产动物疾病和促进生长的理想选择,本研究结果也为阐明益生菌先天性免疫调节作用机理提供证据。
