发酵乳中乳酸菌数测定的不确定度评估
2018-12-29黄宝莹佘之蕴沈宏林周臣清王文敏
黄宝莹,佘之蕴,沈宏林,周臣清,王文敏
(广东产品质量监督检验研究院,广东 顺德 528000)
0 引 言
乳酸菌是一类能发酵糖类产生大量乳酸的无芽孢、革兰氏阳性球菌或杆菌细菌的总称,是益生菌中最具代表性的菌属之一[1]。酸乳是指以鲜牛(羊)乳或乳粉为原料,经巴氏杀菌后接种乳酸菌,如嗜热链球菌和保加利亚乳杆菌(德氏乳杆菌保加利亚亚种)发酵制成的乳制品[2],产品中含有大量活乳酸菌。目前常用于发酵乳中的乳酸菌主要包含三个属:双歧杆菌属、乳杆菌属和链球菌属[3]。传统发酵乳主要使用德氏乳杆菌保加利亚亚种和嗜热链球菌作为酸奶的发酵菌种[4]。乳酸菌能分解牛(羊)乳中的乳糖和蛋白质,发酵乳中含有丰富的营养物质,如半乳糖、乳糖、乳酸、乳酸菌增殖因子、多种矿物质和维生素、活性乳酸菌等[5-6],具有缓解乳糖不耐症[7-8]、抗氧化[9]、维持肠道菌群正常平衡[10]、防治腹泻[11]、增强免疫[12]、降低胆固醇[13]等促进人体健康作用。乳酸菌要发挥益生作用,其活菌数需要达到106CFU/g[14]。国标GB 19302-2010《食品安全国家标准发酵乳》中规定,乳酸菌数不得低于106CFU/g(CFU/mL)[2]。
CNAS-CL07:2011《测量不确定度的要求》中规定:检测实验室应制定与检测工作特点相适应的测量不确定度评估程序,并将其用于不同类型的检测工作。检测实验室应有能力对每一项有数值要求的测量结果进行测量不确定度评估。GB 4789.35-2016《食品安全国家标准食品微生物学检验乳酸菌检验》[15]于2017年6月23日实施,标准增加了乳酸菌总数培养条件的选择,在原来的需氧培养条件下,增加了厌氧培养的选择,同时将接种方式由涂布法改为倾注法,接种量由0.1 mL改为1 mL。本文对GB 4789.35-2016方法测定发酵乳中乳酸菌总数进行不确定度评定,并确定其置信区间,为其不确定度的评定提供借鉴,保证乳酸菌总数的检测结果在正常误差范围内,证明检测结果的正确性。
1 材料与方法
1.1 材料与试剂
样品:风味发酵乳
培养基:MRS培养基,广东环凯微生物科技有限公司;MC培养基,北京陆桥技术股份有限公司;氯化钠,广州化学试剂厂。
1.2 仪器与设备
CL-40M高压灭菌器,日本ALP;千级洁净室、MS3基本型旋涡混合器,德国IKA;Easymax拍击式均质器,AESChemunex;AnaeroPack厌氧培养罐,日本三菱MGC;JJ1000电子天平(感量0.01 g),常熟市双杰测试仪器厂;GHP-9270隔水式恒温培养箱,上海一恒科学仪器有限公司。
1.3 方法[15]
1.3.1 样品制备
样品的全部制备过程均应遵循无菌操作程序,无菌生理盐水作为稀释液。以无菌操作称取25 g样品,置于225 mL稀释液的无菌均质袋中,用拍击式均质器拍打2 min制成1:10的样品稀释液。
1.3.2 10倍系列稀释
用1 mL无菌分度吸量管吸取1.3.1中1:10样品稀释液1 mL,沿管壁慢慢注入装有9 mL稀释液的无菌中号试管中,操作过程中分度吸量管流液口不能触碰稀释液,否则可能导致检测结果偏高。使用旋涡混合器振摇试管1 min其混合均匀,制成1:100的样品稀释液。另取1 mL无菌分度吸量管,按照上述操作步骤,按10倍系列依次制备样品稀释液,每递增稀释一次,需换用新的分度吸量管。
1.3.3 嗜热链球菌计数A
依据待检样品标签声称的乳酸菌类别和含量,估算待检样品中是否含有嗜热链球菌及其数量,选择(2~3)个合适的连续稀释度,每个稀释度吸取1 mL样品稀释液置于无菌培养皿内,每个稀释度做两个平行。同时分别吸取1 mL空白稀释液加入两个无菌平皿内作空白对照。然后注入约15 mL冷却至(48±1)℃的MC培养基,转动培养皿使之混合均匀。待培养基凝固后置于(36±1)℃培养箱中需氧培养(72±2)h,培养后计数与计算。
1.3.4 双歧杆菌和乳杆菌计数B
依据待检样品标签声称的乳酸菌类别和含量,估算待检样品中是否含有双歧杆菌和乳杆菌及其数量,选择(2~3)个合适的连续稀释度,每个稀释度吸取1 mL样品稀释液置于无菌培养皿内,每个稀释度做两个平行。同时分别吸取1 mL空白稀释液加入两个无菌平皿内作空白对照。然后注入约15mL冷却至(48±1)℃的MRS培养基,转动培养皿使之混合均匀。待培养基凝固后置于(36±1)℃培养箱中厌氧培养(72±2)h,培养后计数与计算。
1.3.5 乳酸菌总数计数C
乳酸菌总数C为嗜热链球菌计数A和双歧杆菌和乳杆菌计数B二者结果之和,即C=A+B。嗜热链球菌计数A和双歧杆菌和乳杆菌计数B的计数范围均为30 CFU~300 CFU之间。每个稀释度的菌落数为两个平行的平均值。
如果只有一个稀释度平板上的菌落数落在计数范围内,直接计算两个平板菌落数的平均数,再除以稀释因子,得到每克中菌落总数结果,按公式(1)计算。

式中:N为样品中的菌落数,CFU/g;∑C为两个平板菌落数之和,CFU;d为稀释因子。
如果有两个连续稀释度的平板菌落数落在计数范围内时,则按公式(2)计算。

式中:N为样品中菌落数,CFU/g;∑C为平板(包含所有落在计数范围内的平板)菌落数之和,CFU;n1为第一稀释度(即低稀释倍数)平板个数;n2为第二稀释度(即高稀释倍数)平板个数;d为稀释因子(第一稀释度)。
1.3.6 不确定度来源
在微生物检测中一般认为不确定度来源于样品量、样品制备、样品种类、微生物在样品中的分布、样品中微生物的含量、样品稀释、培养基、培养条件、计量器具校准、操作人员技能等[16]。大部分微生物定量检测不能进行有效的不确定度评定,因为在微生物含量较低的情况下,检测结果接近方法的检出限,检测结果的重复性和再现性都难以保障,微生物在样品中的分布也是不均匀的。本文只研究发酵乳单一样品种类,样品特点是乳酸菌种类相对稳定,含量较高,一般大于106CFU/g。样品的相对稳定性使得不确定度评定有了基础和意义。本文对影响较大的样品制备、递增稀释、加样体积和重复测量引起的不确定度进行分析。
2 结果与分析
2.1 标准不确定度(不确定度分量)评估
2.1.1 样品制备引起的相对标准不确定度(urel(制备))
样品制备的不确定度主要通过天平、量筒的不确定度传播而导致,通常不是不确定度来源的主因。首次稀释样品量为25 g,加入到225 mL稀释液中。主要由2个不确定度分量组成:称量25 g样品时电子天平相对标准不确定度(urel(称))和量取225 mL生理盐水时量筒相对标准不确定度(urel(量))。
(1)电子天平相对标准不确定度(urel(称))
电子天平(感量0.01 g)引入的不确定度包括示值误差和重复性引入的不确定度。根据电子天平的检定证书,0~50 g量程时示值最大允许误差为±0.05 g,取均匀分布的标准不确定度为重复性最大允许误差为±0.15 g,取均匀分布的标准不确定度为
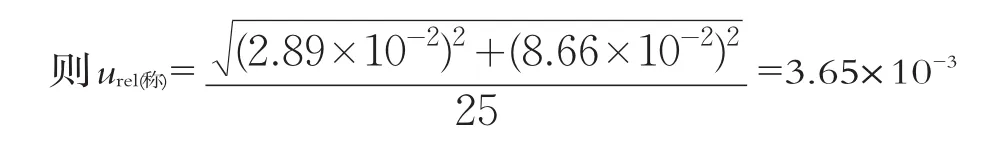
(2)量筒相对标准不确定度(urel(量))
根据JJG 196-2006《常用玻璃量器检定规程方法》得250 mL量出式量筒容量允差为±2.0 mL,取均匀分布的标准不确定度为:
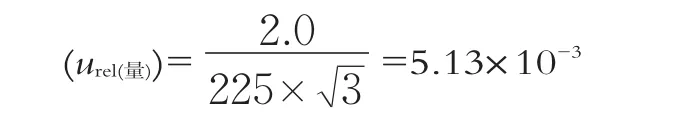
(3)样品制备相对标准不确定度(urel(制备))
urel(称)和(urel(量))是相互独立的2个不确定度分量。
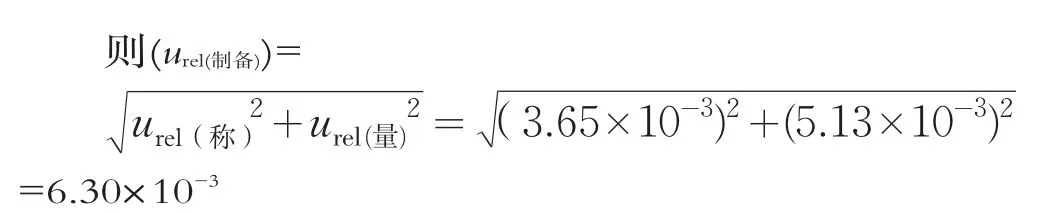
2.1.2 递增稀释引入的相对标准不确定度(urel(稀释))
本次检测结果MRS培养基和MC培养基均以稀释因子为10-6的平板上的菌落总数来计数和报告。主要是由流出式的10 mL分度吸量管和1 mL分度吸量管引入的不确定度。在制备1∶100样品匀液时,10 mL和1 mL分度吸量管分别用了1次。同样,在制备1∶1 000样品匀液时,10 mL和1 mL分度吸量管分别用了1次。同理类推,在10-2至10-6的10倍系列递增稀释过程中,10 mL和1 mL分度吸量管分别使用了5次。根据检定证书的10 mL和1 mL分度吸量管准确度等级均为A级,查JJG 196-2006《常用玻璃量器检定规程方法》得流出式A级10 mL和1 mL分度吸量管的容量允差分别为±0.05 mL和±0.008 mL,取均匀分布的标准不确定度得

2.1.3 加样体积引入的相对标准不确定度(urel(加样))
本次检测结果MRS培养基和MC培养基均以稀释因子为10-6的平板上的菌落总数来计数和报告。MRS培养基和MC培养基在10-6稀释度分别吸取1 mL样品稀释液于无菌培养皿内,每个稀释度做两个平行。在加样过程中使用了1 mL分度吸量管4次。取均匀分布的标准不确定度得加样时相对标准不确定度为:
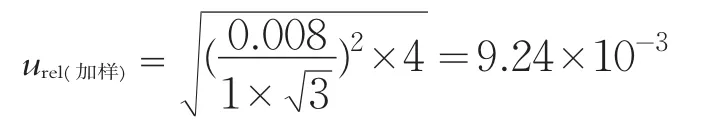
2.1.4 重复检测引起的不确定度(urel(SR))
重复检测引起的不确定度,主要是检测过程中多种因素作用下随机性造成的乳酸菌总数数值不同引起的。由于微生物定量检测结果发散性较大,一般认为重复性检测是不确定的的主要影响因素。由同一人员在相对恒定的实验条件下,对同一待测样品进行连续10次的重复检测,然后对检测结果进行不确定度分析和评定,考量重复检测带来的不确定度。乳酸菌数的检测结果见表1。平板计数的结果不是正态分布而是偏态分布,将检测数据转换成对数,使分布接近正态分布,然后再进行分析。
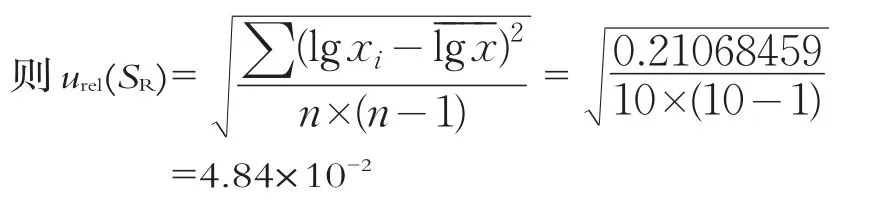
2.2 合成标准不确定度计算
样品制备、递增稀释、加样体积和重复测量引起的不确定度是相对独立的不确定度分量,合成不确定度为:

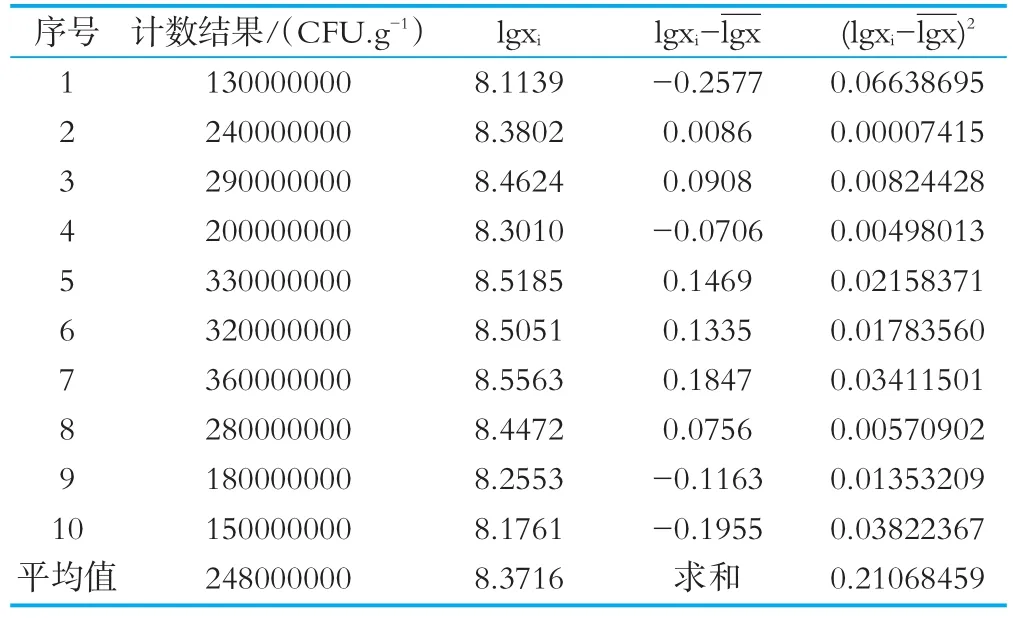
表1 乳酸菌数的检测结果
2.3 扩展不确定度
取置信概率p=95%,自由度v=10-1=9,由t分布表查得K=2.26,则扩展不确定度为:
U=K·ucrel=2.26×5.12×10-2=0.1157
所以检测结果的对数值范围为:lgx=8.3716±0.1157,也就是:8.2559≤lgx≤8.4873
反对数得:180000000≤x(乳酸菌数)≤310000000
2.4 结果取值范围
该样品中乳酸菌数含量为x=108.3716CFU/g=235288120 CFU/g,修约后取两位有效数字,结果为2.4×108CFU/g。检测结果的对数值范围为8.2559≤lgx≤8.4873,取反对数并修约取两位有效数字后,结果取值范围为1.8×108~3.1×108CFU/g。
3 结论
在微生物定量检测中,不确定度的来源较为分散,且很多因素对不确定度的影响较大。样品均匀性、样品的性质、保存条件、检测环境、培养基质量、稀释液、试管、分度吸量管、均质袋、培养条件(温湿度)、培养时间、取样量、人员操作等因素都会引入不确定度。平板计数法检测乳酸菌数的结果表明,不确定度主要来源依次为:重复检测、递增稀释、加样体积和样品制备。重复检测引入的不确定度分量最大,这是因为乳酸菌采用MRS培养基厌氧培养和MC培养基需氧培养相结合的方法,检测过程和培养过程较为复杂,对操作人员技术要求较高,相比其他微生物定量检测会产生更多不确定性。其次是递增稀释引入的不确定度,取决于样品的微生物含量。乳酸菌数的检测递增稀释次数较多,一般为6次或以上,对不确定度带来较大影响。加样体积和样品制备引起的不确定度较小。通过对发酵乳中乳酸菌数的不确定度评估,明确了不确定度的主要来源,方便实验室有针对性的加强质量管理。
